- Vulpinsäure
-
Strukturformel 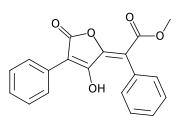
Allgemeines Name Vulpinsäure Andere Namen - Letharsäure
- Pulvinsäuremethylester
- 2-(2,5-Dihydro-3-hydroxy- 5-oxo-4-phenyl-2-furanyliden)- 2-phenyl-essigsäuremethylester
- Methyl-2-(3,5-dioxo- 4-phenyl-2-furyliden)- 2-phenylacetat (IUPAC)
Summenformel C19H14O5 CAS-Nummer 521-52-8 PubChem 51844 Kurzbeschreibung gelbe Kristalle[1]
Eigenschaften Molare Masse 322,33 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit - unlöslich in Wasser und Ethanol[1]
- gut löslich in Diethylether und Chloroform[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar H- und P-Sätze H: siehe oben EUH: siehe oben P: siehe oben EU-Gefahrstoffkennzeichnung [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: (1/2)-22-24/25-36-45 LD50 178 mg·kg−1 (Maus, intravenös) [4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Vulpinsäure, auch Letharsäure, ist eine organische chemische Verbindung, die zu den Lactonen, Estern, Enolen und zur Gruppe der Pulvinsäure-Farbstoffe zählt. Vulpinsäure ist ein starkes natürliches Gift, das von manchen Flechtenarten, wie etwa der Wolfsflechte (Letharia vulpina), produziert wird. Es dient vermutlich als Fraßschutz vor Schnecken. Da es für alle fleischfressenden Wirbeltiere giftig ist, wurde es früher in Skandinavien zum Vergiften von Wolfs- und Fuchsködern genutzt.
Inhaltsverzeichnis
Geschichte und Vorkommen
Die Vulpinsäure wurde 1831 bei der Untersuchung von Flechten durch den französischen Apotheker und Chemiker Antoine Bebert entdeckt, aber erst 1860 von Franz Möller und Adolph Strecker genauer untersucht und beschrieben. Beim längeren Erhitzen der Säure in wässriger Bariumsulfat-Lösung erhielten Möller und Strecker neben Methanol und Kohlenstoffdioxid einen Methylether der Oxalsäure, Phthalsäure und Benzoesäure.[5] Jacob Volhard synthetisierte als erster die Vulpinsäure sowie die Pulvinsäure. Außer in Flechten findet sich Vulpinsäure in vielen Pilzen wie den Röhrlingen als gelber Farbstoff.
Chemische und biologische Eigenschaften
Vulpinsäure ist keine Carbonsäure, sie besitzt ähnlich wie Ascorbinsäure (Vitamin C) eine Enolgruppierung, die sauer wirkt. In basischen Lösungen bilden sich die Alkoholate der Vulpinsäure, wobei das Ammonium-, die Alkali- und Erdalkalisalze (mit Ausnahme des Kaliumsalzes) gut löslich, die Verbindungen aller anderen Metalle schwer löslich in Wasser sind.[5] Die Verseifung von Vulpinsäure liefert die Carbonsäure Pulvinsäure.
Die Vulpinsäure ist ähnlich wie die Abscisinsäure ein natürlicher Wachstumsinhibitor bei Pflanzen und besitzt beim Menschen antiinflammatorische und antibakterielle Wirkung.[6]
Einzelnachweise
- ↑ a b c d Hermann Römpp, Jürgen Falbe und Manfred Regitz: Römpp Lexikon Chemie, 9. Auflage, Georg Thieme Verlag, Stuttgart 1992.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Datenblatt Vulpinsäure bei Carl Roth, abgerufen am 14. Dezember 2010.
- ↑ Vulpinsäure bei ChemIDplus.
- ↑ a b Canstatt's Jahresbericht über die Fortschritte in der Pharmacie und verwandte Wissenschaften in allen Ländern, Harvard Universität, Jahrgang 10 (1861).
- ↑ Robert L. Frank, George R. Clark, James N. Coker: „The Synthesis of Vulpinic Acid from Polyporic Acid“, in: J. Am. Chem. Soc., 1950, 72, S. 1824–1826; doi:10.1021/ja01160a121.
Weblinks
 Wiktionary: Vulpinsäure – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: Vulpinsäure – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wikimedia Foundation.
