- 2-Fluorethanol
-
Strukturformel 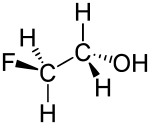
Allgemeines Name 2-Fluorethanol Andere Namen Ethylenfluorhydrin
Summenformel C2H5FO CAS-Nummer 371-62-0 PubChem 9737 Kurzbeschreibung entzündliche, flüchtige, farblose Flüssigkeit
Eigenschaften Molare Masse 64,06 g·mol−1 Aggregatzustand flüssig
Dichte 1,1040 g·cm−3[1]
Schmelzpunkt −26,3 °C[1]
Siedepunkt 103,5 °C[1]
Dampfdruck pKs-Wert 14,42[2]
Löslichkeit mischbar mit Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 

Gefahr
H- und P-Sätze H: 226-300-310-330 EUH: keine EUH-Sätze P: 260-264-280-284-302+350-310 [3] EU-Gefahrstoffkennzeichnung [1] 
Sehr giftig (T+) R- und S-Sätze R: 10-26/27/28 S: 36/37/39-45 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 2-Fluorethanol ist eine chemische Verbindung aus der Gruppe der substituierten Alkohole und organischen Fluorverbindungen.
Inhaltsverzeichnis
Geschichte
Auf der Suche nach neuen Schädlingsbekämpfungsmitteln begann die systematische Erforschung der Fluorcarbonverbindungen 1934 in Deutschland durch Schrader (IG-Farben), wobei eine hohe Toxizität auf Mensch und Nutztiere festgestellt wurde. Der Grund für die Beendigung der Forschung liegt u. a. in der Entdeckung der phospororganischen Verbindungen, welche sich durch geringe Modifikationen im Molekül einerseits als noch toxischere chemische Kampfstoffe anwenden lassen, andererseits aber auch zur Schädlingsbekämpfung besser eigneten (schnellerer Abbau und andere geeignetere Eigenschaften). Die Fluorcarbonverbindungen bleiben durch ihre feste F–C-Bindung sehr lange stabil, sodass eine viel zu lange Vergiftung des Nutzbodens entsteht.
Gewinnung und Darstellung
2-Fluorethanol kann durch die Umsetzung von Ethylenoxid mit Fluorwasserstoff unter Druck hergestellt werden.[5] Weiterhin gelingt die Darstellung durch die Reaktion von Ethylencarbonat mit Kaliumfluorid[6] oder Diethylcarbonat mit Kaliumhydrogenfluorid.[7] Die Verbindung kann auch durch nucleophile Substitutionsreaktionen an Ethylenglycol, 2-Chlorethanol oder 2-Bromethanol mittels Kaliumfluorid erhalten werden.[8][9][10]
Eigenschaften
2-Fluorethanol ist eine farblose Flüssigkeit mit einem dem Ethanol ähnlichen Geruch. Der Siedepunkt liegt bei Normaldruck bei 103 °C. Die Dampfdruckfunktion ergibt sich nach August entsprechend log10(P) = −A/T+B (P in mmHg, T in K) mit A = 2306 und B = 9,060.[11] Die Verbindung schmilzt bei −26 °C. Es ist mit Wasser und Ethanol in jedem Verhältnis mischbar.[12] Auf Grund der Fluorsubstitution ist die Säurestärke mit einem pKs–Wert von 14.42 etwas höher als bei reinem Ethanol mit einem pKs–Wert von 16.
Toxische Eigenschaften
Fluorethanol wird im Körper leicht zu Fluoressigsäure oxidiert[13], die die toxischen Erscheinungen hervorruft. Fluorethanol kann nach oraler Aufnahme, nach Inhalation und in geringerem Maße nach perkutaner Resorption seine toxische Wirkung entfalten. Der Geruch ist dem des Ethanol ähnlich.
Die Latenzzeit beträgt 0,5 bis 6 Stunden. Die Vergiftungssymptome sind Muskelzuckungen, Tremor, Atemstörungen, klonische Krämpfe der Gesichts- und Nackenmuskulatur, Rückwärtsbeugung des Rumpfes, Pupillenerweiterung, Erbrechen, Kribbeln, Taubsein der Haut, Erregungs- und Angstzustände, epilepsieähnliche Krämpfe, die sich unregelmäßig wiederholen. Der Tod kann durch Herzstillstand, Sauerstoffmangel während der Krämpfe oder durch Aussetzen der Atmung erfolgen. Da kein spezielles Antidot vorhanden ist, enden Vergiftungen mit Fluorethanol und ähnlichen Fluorcarbonverbindungen in größerer Giftmenge immer tödlich. Es wird nur symptomatisch behandelt, wobei auf der durch Fluor ausgelösten Hypokalzämie, der Cholinesterasehemmung und den Eingriffen in den intermediären Stoffwechsel (Citratzyklus) die Hauptaugenmerke liegen. Krämpfe können mit Hexobarbital oder Diazepam bekämpft werden.Bei Überstehen des akuten Stadiums können Begleiterscheinungen und Nachfolgeerkrankungen auftreten: Blutdruckabfall, Arrhythmie, Kammerflimmern und Myokardschäden.[14]
Verwendung
2-Fluorethanol wird zur Herstellung von Schädlingsbekämpfungsmitteln verwendet.[1]
Sicherheitshinweise
Die Dämpfe von 2-Fluorethanol können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 34 °C) bilden.[1]
Literatur
- G. Ahrens: Giftgesetz und Giftverkehr, Ein Kompendium für Leiter, Beauftragte und Prüfende, 5. Auflage, Johann Ambrosius Barth, Leipzig, 1987.
- M. Bäsig, H. Gorges, H. Kießlich-Köcher, B. Martin, R. Stohr: Chemische Kampfstoffe und Schutz vor chemischen Kampfstoffen, Militärverlag der DDR, Berlin 1977.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 371-62-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. Februar 2010 (JavaScript erforderlich).
- ↑ 2-Fluorethanol bei ChemIDplus.
- ↑ a b Datenblatt 2-Fluoroethanol bei Sigma-Aldrich, abgerufen am 20. März 2011.
- ↑ a b c Datenblatt 2-Fluorethanol bei AlfaAesar, abgerufen am 18. Februar 2010 (JavaScript erforderlich).
- ↑ I.L. Knunjanz: Akademii Nauk SSSR 55 (1947) S. 223.
- ↑ I. Shahak, E.D. Bergmann: Chemical Communications (London) 1965; S. 122.
- ↑ N. Tsukimori, N. Nanbu, T. Noritoshi, M. Takehara, M. Ue, Y. Sasaki: Chemistry Letters 37 (2008) S. 368–369. doi:10.1246/cl.2008.368
- ↑ F.W. Hoffmann: Preparation of Aliphatic Fluorides in J. Am. Chem. Soc. 70 (1948) 2596–2597. doi:10.1021/ja01187a506
- ↑ P.S. Bhadury, S.K. Raza, D.K. Jaiswal: A semi-molten mixture of hexadecyltributylphosphonium bromide and potassium fluoride in the synthesis of organofluorine compounds in J. Fluor. Chem. 99 (1999) 115–118. doi:10.1016/S0022-1139(99)00121-9
- ↑ H. McCombie; B.C. Saunders: Fluoroacetates and Allied Compounds in Nature 158 (1946) 382–385. doi:10.1038/158382a0.
- ↑ C.E. Redemann, S.W. Chaikin, R.B. Fearing, G.J. Rotariu, J. Savit, D. van Hoesen: The Vapor Pressures of Forty-one Fluorine-containing Organic Compounds in J. Am. Chem. Soc. 70 (1948) 3604–3606. doi:10.1021/ja01191a017
- ↑ Römpp Chemie Lexikon, 9. Auflage, Thieme Verlag 1995.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ Ahrens, Giftgesetz und Giftverkehr, 5. Auflage.
Wikimedia Foundation.
