- Phenoxybenzamin
-
Strukturformel 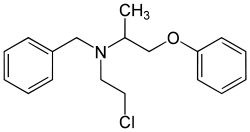
1:1-Gemisch der (R)- und der (S)-Form Allgemeines Freiname Phenoxybenzamin Andere Namen - (RS)-N-Benzyl-N-(2-chlorethyl)-1-(phenoxy)-
-2-aminopropan (IUPAC) - (RS)-Benzyl-(2-chlorethyl)-
(β-phenoxyisopropyl)-amin - Dibenylin
Summenformel C18H22ClNO CAS-Nummer 59-96-1 PubChem 4768 ATC-Code DrugBank DB00925 Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: Ja Eigenschaften Molare Masse 303,83 g·mol−1 Schmelzpunkt Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [2] Hydrochlorid


Achtung
H- und P-Sätze H: 302-351 EUH: keine EUH-Sätze P: 281 [2] EU-Gefahrstoffkennzeichnung [2]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 22-40 S: 22-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phenoxybenzamin ist ein Arzneistoff, der zur Gruppe der Alphablocker (α-Sympatholytika) gehört. Er wirkt peripher blutgefäßerweiternd und wird als Antihypertensivum bei Phäochromozytom eingesetzt.
In Deutschland findet Phenoxybenzamin auch als urologisches Spasmolytikum bei neurogenen Blasenentleerungsstörungen Anwendung.
Der Wirkstoff wird in racemischer Form verwendet.
Inhaltsverzeichnis
Wirkmechanismus
Phenoxybenzamin ist ein irreversibler Blocker von α1- und α2-Rezeptoren, wobei die Blockade auf einer Alkylierung des Rezeptors beruht.
Unerwünschte Wirkungen
Die gravierendste Nebenwirkung von Phenoxybenzamin ist die orthostatische Hypotonie, die für Alphablocker charakteristisch ist.
Herstellung
Die Synthese von racemischem Phenoxybenzamin gelingt schrittweise ausgehend von 1-Phenoxypropan-2-ol. Zunächst wird die Alkoholfunktion mittels Thionylchlorid durch ein Chloratom substituiert, dann erfolgt eine nucleophile Substitution mit Ethanolamin. Das so erhaltene sekundäre Amin wird mit Benzylchlorid umgesetzt und anschließend die mit dem Ethanolamin eingeführte Alkoholfunktion analog zum ersten Schritt durch Thionylchlorid zum Chlorderivat umgesetzt. Dieses wird zunächst als Hydrochlorid erhalten, aus dem die freie Base mit Natronlauge freigesetzt wird.[1] Das als Ausgangsmaterial erforderliche 1-Phenoxypropan-2-ol ist aus den gängigen Industrieprodukten Propylenoxid und Phenol zugänglich.[3]
Stereoisomerie
Phenoxybenzamin enthält ein Stereozentrum, es gibt also zwei Enantiomere, die (R)-Form und die (S)-Form. Alle Handelspräparate enthalten den Arzneistoff als Racemat.
Handelsnamen
Phenoxybenzamin ist in Deutschland und Österreich unter dem Namen Dibenzyran im Handel erhältlich.
Literatur
- T. Karow (Hrsg.):Pharmakologie und Toxikologie. Köln 2005, S. 68.
- C. J. Estler (Hrsg.): Pharmakologie und Toxikologie. 4. Auflage. Schattauer, Stuttgart u. New York 1995, S. 69–71.
- H. Hildebrandt (Hrsg.): Pschyrembel Klinisches Wörterbuch. 257. Auflage. Walter de Gruyter, Berlin/New York 1994.
Einzelnachweise
- ↑ a b Patent US2983719: Veröffentlicht am 1954, Erfinder: J. F. Kerwin, G. E. Ullyot.
- ↑ a b c Datenblatt Phenoxybenzamine hydrochloride bei Sigma-Aldrich, abgerufen am 18. April 2011.
- ↑ A. R. Sexton, E. C. Britton: Synthesis and identification of propylene glycol phenyl ethers. In: J. Am. Chem. Soc. 70, 1948, S. 3606–3607.
Kategorien:- ATC-C04
- ATC-G04
- Gesundheitsschädlicher Stoff
- Stoff mit Verdacht auf krebserzeugende Wirkung
- Arzneistoff
- Alphablocker
- Spasmolytikum
- Benzylamin
- Phenolether
- Chloralkan
- (RS)-N-Benzyl-N-(2-chlorethyl)-1-(phenoxy)-
Wikimedia Foundation.
