- Phenylacetylen
-
Strukturformel 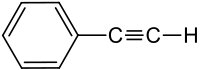
Allgemeines Name Phenylacetylen Andere Namen - Ethinylbenzen (IUPAC)
- Ethinylbenzol
- Phenylethin
Summenformel C8H6 CAS-Nummer 536-74-3 PubChem 10821 Kurzbeschreibung gelbliche Flüssigkeit[1]
Eigenschaften Molare Masse 102,14 g·mol−1[1] Aggregatzustand flüssig
Dichte 0,93 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 142–144 °C (1013 hPa)[1]
Dampfdruck 2,7 hPa (25 °C)[1]
Löslichkeit 0,46 g·l−1 in Wasser (25 °C)[1]
Brechungsindex 1,547 (bei 20 °C, 589 nm)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 


Gefahr
H- und P-Sätze H: 226-304-315-319 EUH: keine EUH-Sätze P: 210-301+310-302+352-305+351+338-331 [1] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 10-36/37-65 S: 26-62 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Phenylacetylen ist das einfachste aromatische Alkin. Es ist eine farblose, viskose Flüssigkeit mit einem Flammpunkt von 27 °C.[1] In der Forschung wird es manchmal als Analogon zu Acetylen verwendet, als Flüssigkeit ist es leichter zu handhaben als gasförmiges Acetylen.
Inhaltsverzeichnis
Herstellung
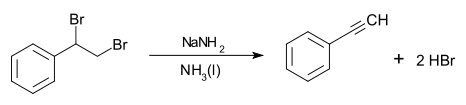
Im Labor kann Phenylacetylen durch Eliminierung von Bromwasserstoff aus 1,2-Dibromphenylethan (auch fälschlicherweise als Styroldibromid bezeichnet) mit Natriumamid in flüssigem Ammoniak erhalten werden:[2]
Es kann auch durch Eliminierung von Bromwasserstoff aus 1- oder 2-Bromphenylethen (als Trivialnamen 1- oder 2-Bromstyrol) mit geschmolzenen Kaliumhydroxid hergestellt werden.[3]
Eigenschaften
Wie Acetylen reagiert auch seine Ethinylgruppe (–C≡C–H) gegenüber sehr starken Basen (wie z.B. NaNH2) als Säure und zeigt andere, für Alkine typische Reaktionen, wie elektrophile Additionen, Hydrierung oder Polymerisationen. Die Dämpfe von Phenylacetylen sind entzündlich. Der Flammpunkt liegt bei 31 °C.[4]
Reaktionen
- Phenylacetylen kann durch Wasserstoff über dem Lindlar-Katalysator zu Styrol reduziert (hydriert) werden.
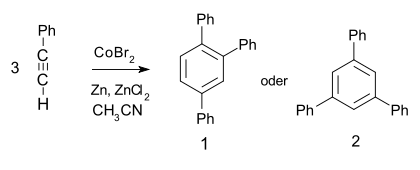
- Es trimerisiert unter Metallkatalyse zu 1,2,4- (97%) und 1,3,5-Triphenylbenzol (3%):[5]
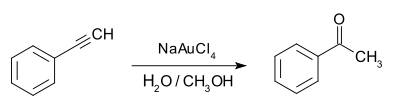
- Es addiert unter Katalyse von Natriumtetrachloroaurat Wasser. Das zunächst entstehende Enol tautomerisiert spontan zu Acetophenon:
Diese Reaktion hat jedoch keine praktische Bedeutung, da Acetophenon durch eine einfache Friedel-Crafts-Acylierung von Benzol mit Acetylchlorid und Lewis-Säuren herstellbar ist.
Einzelnachweise
- ↑ a b c d e f g h i j k l Datenblatt Phenylacetylen bei Merck, abgerufen am 19. April 2011.
- ↑ Kenneth N. Campbell, Barbara K. Campbell: Phenylacetylene, in: Organic Synth. Coll. Vol. 4 1963, S. 763.
- ↑ John C. Hessler: In Organic Synth. Coll. Vol. 1 1941, S. 438.
- ↑ Datenblatt Phenylacetylen bei AlfaAesar, abgerufen am 15. Dezember 2010 (JavaScript erforderlich).
- ↑ Gerhard Hilt , Thomas Vogler, Wilfried Hess, Fabrizio Galbiati : In A simple cobalt catalyst system for the efficient and regioselective cyclotrimerisation of alkynes Chemical Communications, 2005, 11, S. 1474–1475.
Wikimedia Foundation.