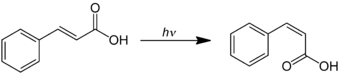- Zimtsäure
-
Strukturformel 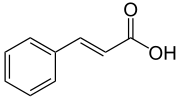
Allgemeines Name Zimtsäure Andere Namen - 3-Phenylacrylsäure
- trans-3-Phenylpropensäure
- (E)-3-Phenylpropensäure
- trans-Zimtsäure
- (E)-Zimtsäure
Summenformel C9H8O2 CAS-Nummer - 621-82-9
- 140-10-3 (trans-Zimtsäure)
- 102-94-3 (cis-Zimtsäure)
PubChem 444539 Kurzbeschreibung Eigenschaften Molare Masse 148,16 g·mol−1 Aggregatzustand fest
Dichte 1,25 g·cm−3[2]
Schmelzpunkt Siedepunkt 300 °C[2]
pKs-Wert 4,44[3]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [4] trans

Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [4] EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/38 S: 22-24/25-36/37/39-38 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Zimtsäure (trans-3-Phenylacrylsäure) ist ein weißer Feststoff mit charakteristischem Geruch. Zimtsäure kommt in manchen Pflanzen natürlich vor und ist ungiftig. Neben Zimtaldehyd und Eugenol ist sie ein wichtiger Bestandteil des Zimtes. Zimtsäure gehört zu den Aromaten und ist eine ungesättigte Carbonsäure mit einer trans-substituierten Kohlenstoff-Kohlenstoff-Doppelbindung in der Seitenkette. Die isomere cis-Zimtsäure hat nur eine geringe Bedeutung. Die Angaben in diesem Artikel beziehen sich nur auf die trans-Zimtsäure.
Inhaltsverzeichnis
Darstellung
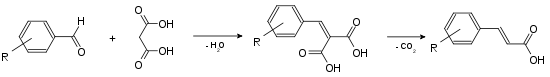
Zimtsäure kann aus Benzaldehyd hergestellt werden, beispielsweise über die Knoevenagel-Reaktion mit Malonsäure (Doebner-Variante).
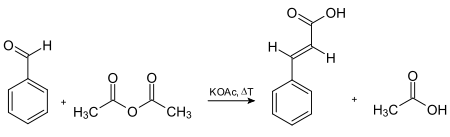
Ein speziell für die Zimtsäure entwickelter Reaktionsweg ist die Perkin-Reaktion:
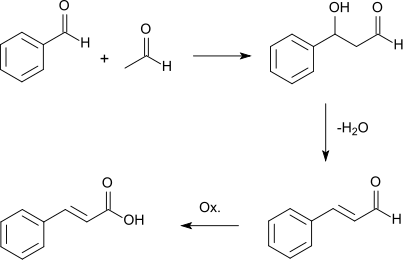
Ein anderer Syntheseweg verläuft über eine Aldolkondensation von Benzaldehyd und Acetaldehyd.
Zimtsäure entsteht auch durch die schon an der Luft stattfindende Oxidation von Zimtaldehyd.
Eigenschaften
Zimtsäure kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/n und den Gitterparametern a = 779 pm, b = 1807 pm, c = 567 pm und β = 97°. In der Elementarzelle befinden sich vier Formeleinheiten.[5] Eine weitere metastabile Form ist bekannt,[6][7] die Kristallstruktur dieser β-Modifikation ist isomorph zu 4-Chlorzimtsäure.[8]
Biosynthese
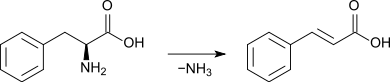
Zimtsäure entsteht aus der Aminosäure L-Phenylalanin im Zuge einer Desaminierung durch die Phenylalanin-Ammoniak-Lyase (EC 4.3.1.5), die in einer analogen Reaktion auch die Aminosäure L-Tyrosin zur para-Cumarsäure (4-Hydroxyzimtsäure) desaminiert. Sie ist ein Zwischenprodukt der Biosynthese von Chalkonen (und damit Vorstufe der Flavonoidbiosynthese) und Stilbenen.
Verwendung und Reaktivität
Zimtsäure kann zur Darstellung von Phenylacetylen verwendet werden. Einige ihrer Ester sind als Riechstoffe in Anwendung. Bei der UV-Bestrahlung von trans-Zimtsäure erfolgt eine Isomerisierung unter Bildung von cis-Zimtsäure (Allozimtsäure):[9]
Derivate
Am Phenylring durch eine Hydroxygruppe substituierte Derivate gehören zur Gruppe der Phenolsäuren. Die Sinapinsäure (3,5-Dimethoxy-4-hydroxy-zimtsäure) und auch α-Cyano-4-hydroxy-zimtsäure (HCCA) kommen als organische Matrix bei der MALDI-MS (Matrix assisted laser desorption ionization mass spectrometry) zum Einsatz. Dazu gehören zum Beispiel auch die Ferulasäure und die Kaffeesäure.
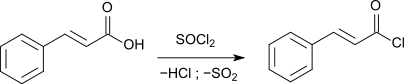
Durch die Reaktion mit Thionylchlorid (SOCl2) wird Zimtsäure in das reaktionsfreudige Zimtsäurechlorid umgewandelt.
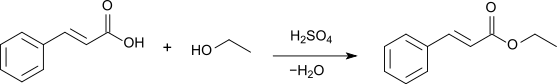
Durch Veresterung mit Ethanol in Gegenwart von Schwefelsäure[10] oder Salzsäure[11] als Katalysator kann der Aromastoff Zimtsäureethylester gewonnen werden.
Einzelnachweise
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c d e f Eintrag zu Zimtsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Februar 2009 (JavaScript erforderlich).
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Datenblatt trans-Cinnamic acid bei Sigma-Aldrich, abgerufen am 25. April 2011.
- ↑ J. Ladell, T. R. R. McDonald, G. M. J. Schmidt: "The crystal structure of α-trans-cinnamic acid." in Acta Cryst. 1956, 9, S. 195.Abstract
- ↑ J. H. Urbanus, S. Jiang: "Polymorphism of trans-cinnamic acid", MSc graduation assignment. Volltext
- ↑ G. M. J. Schmidt: "385. Topochemistry. Part III. The crystal chemistry of some trans-cinnamic acids" in J. Chem. Soc., 1964, S. 2014-2021. doi:10.1039/JR9640002014
- ↑ I. Abdelmoty, V. Buchholz, L. Di, C. Guo, K. Kowitz, V. Enkelmann, G. Wegner, B. M. Foxman: "Polymorphism of Cinnamic and α-Truxillic Acids: New Additions to an Old Story" in Crystal Growth & Design 2005, 5(6), S. 2210–2217. doi:10.1021/cg050160s
- ↑ Siegfried Hauptmann: Organische Chemie, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 407.
- ↑ C. S. Marvel, W. B. King: "Ethyl Cinnamate" in Organic Syntheses, 1929, 38, S. 38. Volltext
- ↑ E. Fischer, A. Speier: "Darstellung der Ester" in Berichte der deutschen chemischen Gesellschaft 1895, 28, S. 3252ff. Volltext
Weblinks
Siehe auch
Wikimedia Foundation.