- Sklerosierende chronische Enteritis
-
Klassifikation nach ICD-10 K50.- Crohn-Krankheit [Enteritis regionalis] [Morbus Crohn] K50.0 Crohn-Krankheit des Dünndarmes I5642 K50.1 Crohn-Krankheit des Dickdarmes I5646 K50.8 Sonstige Crohn-Krankheit K50.9 Crohn-Krankheit, nicht näher bezeichnet ICD-10 online (WHO-Version 2006) Der Morbus Crohn gehört zur Gruppe der chronisch-entzündlichen Darmerkrankungen. [1][2][3] Es handelt sich um eine chronisch-granulomatöse Entzündung, die im gesamten Magen-Darm-Trakt von der Mundhöhle bis zum After auftreten kann. Bevorzugt befallen sind der untere Dünndarm (terminales Ileum) und der Dickdarm (Colon), seltener die Speiseröhre (Ösophagus) und der Mund. Charakterisierend für Morbus Crohn ist der diskontinuierliche, segmentale Befall (sog. „skip lesions“) der Darmschleimhaut, es können also gleichzeitig mehrere Darmabschnitte erkrankt sein, die durch gesunde Abschnitte voneinander getrennt sind.
Das Krankheitsbild wurde zweimal unabhängig voneinander beschrieben, 1904 vom polnischen Chirurgen Antoni Leśniowski (1867-1940) und 1932 vom amerikanischen Magen- und Darmspezialisten Burrill Bernard Crohn (1884-1983), nach dem die Krankheit benannt wurde. Andere Bezeichnungen für die Krankheit sind Enteritis regionalis Crohn, Ileitis terminalis, Enterocolitis regionalis und sklerosierende chronische Enteritis, bzw. die Abkürzungen MC, CD (Crohn's Disease) und zusammen mit der Colitis ulcerosa als CED (Chronisch entzündliche Darmerkrankung, engl. IBD: inflammatory bowel disease).
Inhaltsverzeichnis
Häufigkeit
In den westlichen Industriestaaten liegt die jährliche Anzahl von Neuerkrankungen von M. Crohn bei etwa 7-8 auf 100.000 Einwohner, die Prävalenz (der Bestand an Erkrankten) bei etwa 150 auf 100.000[4]. Die Zahl der Erkrankungen nahm in den letzten 20 Jahren zu. Beide Geschlechter sind gleich häufig betroffen, meist erkranken junge Erwachsene zwischen dem 16. und 35. Lebensjahr sowie ältere Menschen ab einem Alter von 60 Jahren. Es ist eine familiäre Häufung zu beobachten.
Entstehung des Morbus Crohn
Die Ätiologie und Pathogenese des Morbus Crohn sind nicht geklärt. Burill B. Crohn hielt den M. Crohn für eine durch intrazelluläre Bakterien oder Viren ausgelöste Erkrankung. Dies konnte bis heute nicht bewiesen werden. Es sind aber eine Reihe von Umständen bekannt, die bei der Entstehung der Erkrankung von Bedeutung sind.
Autoimmunerkrankung
Morbus Crohn wird als Autoimmunerkrankung der Darmschleimhaut klassifiziert. Das Hauptargument für diese Einteilung ist das gute Ansprechen der Krankheit auf das Immunsystem hemmende Medikamente wie Cortison und Azathioprin sowie der fehlende Nachweis eines spezifischen Erregers. Wie bei allen anderen Autoimmunerkrankungen ist die Ursache nicht bekannt. Da keine spezifische Ursache bekannt ist, kann die Therapie nicht kausal erfolgen, sondern muss symptomatisch und/oder immunmodulierend erfolgen.
Als Autoantikörper wurden bei Morbus Crohn gehäuft perinukleäre anti-neutrophile cytoplasmatische Antikörper (p-ANCA) serologisch identifiziert. Allerdings sind diese Autoantikörper nur bei circa 20% der Crohn-Patienten nachweisbar.
Rauchen
Das Risiko der Entwicklung eines Morbus Crohn ist bei Rauchern doppelt so hoch wie bei Nichtrauchern. Eine Beendigung des Rauchens wirkt sich in der Regel günstig auf den Krankheitsverlauf oder auf die Rezidivrate nach einer Operation aus.[5]
Genetik
Es besteht möglicherweise eine erbliche Veranlagung für die Krankheit. Mittlerweile wurden mehrere Erbfaktoren entdeckt, die das Risiko für das Auftreten der Krankheit erhöhen. Gene, die ursächlich mit Morbus Crohn in Verbindung gebracht werden, sind NOD2 (nach neuer Nomenklatur: CARD15), IL23R (Chromosom 1p31) [6], ATG16L1, DLG5 und NELL1 (Chromosom 11p15.1) [7]. Ein Faktor scheint die verminderte Anzahl an Genabschnitten zu sein, die für die Produktion von beta-Defensinen verantwortlich sind. Defensine sind eine Art natürliches Antibiotikum, das in Schleimhäuten zur Abwehr von Bakterien vorkommt. Menschen mit Morbus Crohn im Dickdarm haben drei Defensin produzierende Genabschnitte am Chromosom Nr. 8, während gesunde Menschen im allgemeinen vier davon tragen. Dementsprechend ist auch ihr Defensin-Spiegel in der Schleimhaut höher. Für den wesentlich häufigeren Morbus Crohn im Dünndarm gibt es diesen Zusammenhang allerdings nicht.
Barrierestörung
Vieles deutet daraufhin, dass zumindest bei einem Teil der Morbus-Crohn-Patienten die Barriere zwischen dem Darmlumen und dem Organismus defekt ist. Konkrete Hinweise auf diesen Barrieredefekt zeigen sich z. B. im Mangel an anti-infektiv wirksamen Peptiden (Defensinen) im Mucus (Schleim), der der Darmschleimhaut aufgelagert ist. Zudem sind häufig die abdichtenden Verbindungen zwischen den Epithelzellen der Darmschleimhaut „undicht“, d. h. nicht mehr funktionell und in ihrer Zahl vermindert. Ob der kontrollierte Zelltod (Apoptose) vieler Epithelzellen ein primäres oder sekundäres Phänomen ist und damit dem Krankheitsbild ursächlich zugrunde liegt oder nur zur Chronifizierung der Entzündung beiträgt, ist unklar. Durch den Defekt der Barrierefunktion gelangen - im Gegensatz zur Situation beim Gesunden - Bakterien der normalen Darmflora in großer Zahl direkt auf das Epithel der Darmschleimhaut und dringen teilweise auch in die Darmwand ein, wo sie dann an sich regelrechte Entzündungen im Rahmen der Abwehr durch den Körper auslösen, die die Barriere noch weiter schädigen, sodass im Sinne eines Teufelskreises weitere Bakterien der Darmflora in die Darmwand eindringen und die Entzündung weiter anfachen. Der primäre Defekt der Barrierestörung kann zumindest teilweise genetisch bedingt sein. So ist die Produktion bestimmter alpha-Defensine bei Morbus-Crohn-Patienten mit für Morbus Crohn charakteristischen Mutationen in einem Gen (NOD2/CARD15), welches einen intrazellulären Sensor für bakterielle Strukturen codiert, gegenüber Morbus-Crohn-Patienten ohne diesen Gendefekt noch stärker vermindert, obwohl die Defensinproduktion auch bei Morbus-Crohn-Patienten ohne diesen Gendefekt bereits drastisch gegenüber Gesunden reduziert ist. Dieses gilt für den Dünndarmbefall, bei Lokalisation im Dickdarm ist offenbar die Zahl der beta-Defensin-Gene und dementsprechend die beta-Defensinsynthese vermindert. Somit erklären die verschiedenen Defensindefekte die unterschiedlichen Lokalisationen der Erkrankung.
Weitere mögliche Ursachen
Übermäßige Hygiene
Welche Faktoren der Umwelt zur verbreiteten Entwicklung des Morbus Crohn in Gesellschaften mit hohem hygienischem Standard führen, ist unklar. Möglicherweise führt ein Befall mit bestimmten Parasiten – beispielsweise Würmern – zu einer spezifischen Modulation der Immunantwort, die verhindert, dass die Entzündungsreaktion chronisch wiederkehrt. Es existieren andere Hypothesen, wie die Schädigung der Darmbarriere durch die zunehmende Exposition gegenüber Detergentien wie Seifen, Weichmachern oder Emulgatoren, die dazu beitragen könnten, die Barrierefunktion der Darmwand zu schädigen und so dem Eindringen von Bakterien der normalen Darmflora Vorschub zu leisten. Wahrscheinlich sekundär ist, dass die Darmflora bei Morbus-Crohn-Patienten verändert ist: Im Vergleich zu Gesunden findet man eine deutliche Reduktion der Anzahl verschiedener Bakterienspezies.
Ernährung
Früher vermutete Zusammenhänge mit einer spezifischen Ernährung, wie etwa vermehrter Gebrauch von raffinierten Zuckersorten bei MC-Patienten, werden heute als sekundär erachtet, da viele Morbus-Crohn-Patienten aufgrund der Entzündungen im Dünndarm eine generell verminderte Resorption und damit eine schlechtere Nahrungsverwertung aufweisen.
Psychosomatik
Es ist bekannt, dass emotionale Belastungen Veränderungen der Darmfunktionen und abdominelle Beschwerden wie Bauchschmerzen und Durchfälle auslösen oder verstärken können. Psychosozialer Stress kann zur Symptomauslösung oder -verstärkung führen. Es wird vermutet, dass bei den CED psychosozialer Stress auch zu einer Fehlregulation der Immunantwort und - bei entsprechender Veranlagung - zur Krankheitsaktivierung führen kann. Stress kann bei Morbus-Crohn-Patienten zum Auftreten erneuter Entzündungen führen.
Mykobakterien
Es gibt einige Indizien, dass am Krankheitsverlauf Bakterien oder Viren, namentlich das Mycobacterium avium subsp. paratuberculosis (MAP), beteiligt sind. Bei vielen Crohn-Patienten kann MAP nachgewiesen werden. MAP löst bei Rindern und anderen Tieren ebenfalls eine chronische Darmentzündung, die Paratuberkulose, aus. Das Mycobakterium avium paratuberculosis induziert beim Menschen spezifische Antikörper. Diese Antikörper werden im Blut von bis zu zwei Dritteln aller Morbus Crohn Patienten gefunden. Zur Zeit laufen Untersuchungen, ob Crohn-Patienten erfolgreich mit einer Antibiotikakombination behandelt werden können [8].
Symptomatik
Morbus Crohn beginnt meist beim jungen Erwachsenen mit Müdigkeit, Schmerzen im rechten Unterbauch und (meist unblutigen) Durchfällen. Ebenfalls können unklares Fieber, starker Gewichtsverlust, Übelkeit und Erbrechen entstehen. Eine Manifestation der Erkrankung ohne Durchfall ist auch möglich. Schubweise auch mit Fieber, einem Anstieg der weißen Blutkörperchen und einer Anämie (Abnahme des roten Blutfarbstoffes). Bei vielen Patienten jedoch ist die Art und das Empfinden der Symptome unterschiedlich. Es kann beispielsweise zu Beginn und im Verlauf einer „Entzündungsphase“ (einem so genannten „Schub“) zu Appetitlosigkeit, Schmerzen oder Krämpfen im gesamten Unterbauch und Oberbauch kommen. Auch wird von Betroffenen „schmetterlingsartiges Kribbeln“ beschrieben, das nach einem Toilettengang verschwindet.
Bei bis zu 50 Prozent der Morbus-Crohn-Patienten treten zudem extraintestinale Manifestationen auf. Am häufigsten sind hierbei die Gelenke betroffen; es kann zu Arthralgien bzw. Arthritiden kommen. Im Rahmen des Morbus Crohn sind ferner Hautveränderungen in Form des Erythema nodosums oder des Pyoderma gangraenosums möglich. Ebenso kann es zur Begünstigung einer Rosacea (Rosazea) kommen sowie zu Entzündungen des Auges (etwa als Uveitis). Die Manifestationen außerhalb des Darmtraktes (extrainstinale Symptome) können selten auch Monate bis Jahre vor der Darm-Symptomatik auftreten. Normalerweise verschwinden die extrainstinalen Symptome, wenn der Morbus Crohn als Grunderkrankung behandelt wird. Neben der Erkrankung selbst kommen auch Nebenwirkungen der Medikation als Auslöser für extraintestinale Manifestationen in Frage.
Komplikationen
- Mechanischer Ileus: Anfangs häufig durch Einengung des betroffenen Darmsegmentes während des entzündlichen Prozesses bedingt, im späteren Stadium durch fibröse Strikturen. Ein Ileus tritt bei zirka 20 % bis 30 % der Patienten im Verlauf der Erkrankung auf.
- Fistel: Fisteln treten im chronischen Verlauf recht häufig auf und können recht verschieden sein: kutan, enteroenteritisch, enterovesikal, enterovaginal, peranal, rektal. Seltener hingegen sind Fisteln in die freie Bauchhöhle hinein, da die Umgebung des Darms meist stark verwachsen ist.
- Abszess: intra- und retroperitoneale Abszesse kommen vor.
- intestinale Blutungen
- toxisches Megakolon: (= durch „Gift“ bedingte abnorme Weitstellung des Dickdarms) eher selten bei Morbus Crohn, dafür häufiger bei Colitis ulcerosa
- Karzinom: Vor allem für Dünndarmkarzinome besteht ein erhöhtes Risiko.
- Osteoporose oder Osteopenie: Veränderungen der Knochendichte treten häufig als Folgeerscheinungen von Malabsorption sowie als Nebenwirkung einer Cortisontherapie auf.
- Gallensteine (durch den gestörten Leber-Darm-Kreislauf)
Diagnostik
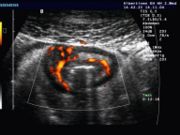
- Abdomensonographie (Ultraschall-Untersuchung des Bauches): Typisch ist die segmentale Verdickung der Darmmukosa.
- Labor: Entzündungsparameter sind erhöht (BSG und CRP), Veränderung der Parameter durch Malabsorption, Anämie (verursacht durch Blutverlust oder Vitamin B12 Mangel / Perniziöse Anämie), Leukozytose, Antikörper gegen Saccharomyces cerevisiae (ASCA).
- Röntgenuntersuchung oder Magnetresonanztomographie mit Kontrastmittel: Pflastersteinrelief, Fisteln, segmentale Stenosen
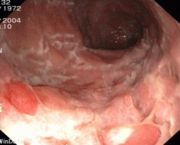
- Ileo-Koloskopie: Frühstadium: Schleimhautläsionen, fleckige Rötungen. Während eines aktiven Schubs: Ulzerationen, Pflastersteinrelief, Fissuren, Fisteln. Spätstadium: Stenosen.
- Biopsie: siehe Pathologie/Morphologie weiter unten
Pathologie/Morphologie
Makroskopisch sind folgende Veränderungen charakteristisch:
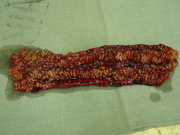
- Gartenschlauchphänomen: Durch Fibrosierung verursachte Segmentstenosen
- Pflastersteinphänomen: Entzündlich verdickte Schleimhautareale wechseln sich mit tief ulzerierten Schleimhautarealen ab, wodurch ein pflastersteinartiges Aussehen entsteht.
- Entzündlicher Konglomerattumor: Verschiedene Darmabschnitte verkleben miteinander.
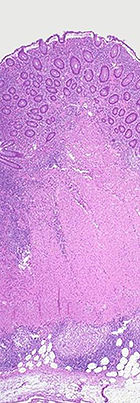
Histologisch (feingeweblich) erkennt man vor allem eine Häufung von Lymphozyten, (eosinophilen) Granulozyten und Histiozyten in der Biopsie des entzündeten Darmgewebes. Angrenzende Lymphknoten sind meist vergrößert. Häufig bilden sich Granulome, die sich in zwei Typen unterscheiden lassen: Epitheloidzellgranulome und Mikrogranulome (kleiner und ohne zentrale Nekrose).
Differentialdiagnostik
Der Morbus Crohn ist manchmal schwer von der Colitis ulcerosa abzugrenzen, in manchen Fällen gelingt es gar nicht (zu den Unterschieden siehe auch die Tabelle unter chronisch-entzündliche Darmerkrankungen).
Darüber hinaus muss eine Reihe anderer Krankheiten ausgeschlossen werden, was mit Hilfe von Bildgebung (Sonografie, CT) und zusätzlichen Untersuchungen geschieht:
- Appendizitis: meist ein sich rasch entwickelnder Schmerz im rechten Unterbauch. Häufig eine Temperaturdifferenz > 1°C zwischen rektaler und axillärer Messung.
- Divertikulitis: tastbare Resistenzen bei meist linksseitigem Unterbauchschmerz.
- Yersiniose: Erregernachweis aus dem Stuhl oder aus dem Biopsiematerial, Anstieg des Antikörpertiters.
- Darmtuberkulose: In Mitteleuropa mittlerweile sehr selten. Die Darmtuberkulose geht häufig mit Beteiligung der Lunge einher. Es finden sich „verkäsende“ epitheloidzellige Granulome im Biopsiematerial.
- jede andere invasive infektiöse Colitis (Salmonellenenteritis, pseudomembranöse Colitis etc.)
Aktivitätsindex
Um festzustellen, ob es sich um einen akuten, behandlungsbedürftigen Schub handelt, wird eine Punktzahl nach dem Crohn's Disease Activity Index (CDAI) nach Best errechnet. Bei einem CDAI>150 handelt es sich um einen akuten, behandlungsbedürftigen Schub.
Therapie
Grundsätzlich unterscheidet man bei der Therapie des Morbus Crohn zwischen der Schubtherapie und der Remissionserhaltung. Ziel der Schubtherapie ist bei Verschlechterung, das heißt bei Vorliegen eines Schubes, die Linderung der akuten Symptome. Mit der remissionserhaltenden Therapie soll die Zahl der Schübe verringert werden, das heißt, es soll die Zeit der Remission verlängert werden. Die konservativen (Medikamente) und operativen Therapieansätze ergänzen sich dabei. Grundsätzlich versucht man, Resektionen des Darmes zu vermeiden, aber in einigen Situationen ist die Chirurgie der Inneren Medizin überlegen. Dies ist vor allem bei Fisteln, Stenosen (narbigen Engen) und lebensgefährlichen Komplikationen der Fall.
Derzeit wird eine wissenschaftliche Debatte geführt, ob das Ziel der Therapie die Beschwerdefreiheit des Patienten oder die komplette Abwesenheit von Entzündung (so genannte Mucosal Healing) sein sollte. Befürworter des Mucosal Healing argumentieren, dass so sowohl einem Funktionsverlust des Darmes, als auch häufigen Schüben und der Entstehung von Krebserkrankungen vorgebeugt werden könnte. Beweise für diese Hypothesen stehen noch aus.
Für Diagnose und Therapie gibt es evidenzbasierte Leitlinien der deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten im Konsens mit der deutschen Gesellschaft für Pathologie[9] und auch auf europäischer Ebene den European evidence based consensus on the diagnosis and management of Crohn's disease für die Diagnose[10], die allgemeine Therapie[11] und für Spezialfälle[12].
Akuter Schub
In der Schubtherapie unterscheidet man zwischen leicht bis mittelgradigen Schüben und mittelgradigen bis schweren Schüben. Außerdem spielt die Lokalisation der Erkrankung gerade beim Morbus Crohn, der den gesamten Magen-Darm-Trakt befallen kann, für die Therapieentscheidung eine wichtige Rolle. Bei perianalem Befall mit Fisteln oder Abszessen kommen wieder andere Therapien zum Einsatz.
- Eine Diät, eventuell mit parenteraler Ernährung oder voll resorbierbarer, ballaststoffarmer Flüssignahrung, kann Symptome während eines schweren Schubes lindern. Leider scheint man einen Schub nicht mit einer Diät alleine behandeln zu können.
- Glukokortikoide sind die wichtigsten Medikamente bei der Behandlung des Morbus Crohn. Sie führen selbst in schwersten Fällen noch bei der Hälfte aller Patienten zu einer Remission. Bei einem leichten bis mittelgradigen Schub verbessern sich die Beschwerden bei rund 90 % aller Patienten. Bei einem Befall der rechten Hälfte des Dickdarms und des terminalen Ileums kann auch Budesonid verwendet werden, ein Kortisonpräparat, das vor allem dort wirkt und wenig Nebenwirkungen im Rest des Körpers verursacht. Bei einem Befall des Mastdarmes kann auch Kortison als Klysma eingesetzt werden, das ebenfalls weniger Nebenwirkungen hervorruft.
- Salazosulfapyridin kann im Gegensatz zu Mesalazin (5-Aminosalicylsäure) bei einem leicht- bis mittelgradigen Schub des linken Dickdarmes durchaus zu einer Verbesserung führen. Obwohl etwa die Hälfte aller Crohn-Patienten eines dieser beiden Medikamente verschrieben bekommen, hat sich mittlerweile gezeigt, dass die Wirksamkeit nur gering ist. Allerdings stehen Untersuchungen, ob Teilgruppen von Patienten nicht doch von Mesalazin profitieren, noch aus.
- Metronidazol und Ciprofloxacin können vor allem zur Behandlung von Fisteln eingesetzt werden.
- Tylosin zeigte sich im Tierversuch in seiner antientzündlichen Wirkung dem Metronidazol mindestens ebenbürtig. Eine Anwendung am Menschen wird seitens der Industrie geprüft.
- Bei schweren, therapierefraktären Schüben werden insbesondere TNF-Blocker wie Infliximab, Adalimumab aber auch Ciclosporin oder Tacrolimus eingesetzt.
- Eine chirurgische Therapie mit Resektion betroffener Darmabschnitte führt zu keiner definitiven Heilung, ist aber bei schwereren Fällen unter Umständen unerlässlich, um schwere Komplikationen wie Stenosen, Fisteln, Abszesse oder Perforationen zu vermeiden oder zu behandeln.
Remissionserhaltung
Derzeit gibt es kein Mittel, das man jedem Patienten mit Morbus Crohn empfehlen kann und das Schübe verhindert. Während bei der Colitis ulcerosa Mesalazin gut wirksam ist, hat es beim M. Crohn nur bei operierten Patienten eine schubunterdrückende Wirkung. Patienten, die schwere Schübe haben, bei denen häufige Schübe auftreten, aber auch Patienten, bei denen beim Versuch, Kortison abzusetzen, die Krankheit immer wieder aufflammt, sollten eine remissionserhaltende Therapie bekommen. Dazu kommen derzeit zwei Medikamentengruppen in Frage:
- Immunsuppressiva: Die Immunsuppressiva, für die eine Wirkung beim M. Crohn bewiesen sind, sind Azathioprin bzw. 6-Mercaptopurin und Methotrexat. Diese Medikamente können in Einzelfällen schwere Nebenwirkungen verursachen, so dass zu Beginn der Therapie eine regelmäßige Kontrolle unerwünschter Effekte erfolgen muss. Wenn diese Kontrollen durchgeführt werden, können die Immunsuppressiva von Betroffenen über mehrere Jahre oder gar Jahrzehnte eingenommen werden.
- TNF-α-Blocker: in der EU sind Infliximab und Adalimumab zur Therapie des M. Crohn zugelassen, in der Schweiz auch Certolizumab. Unter einer Therapie mit TNF-α-Blockern kann eine Tuberkulose reaktiviert werden, so dass vor einer Therapie mit diesen Medikamenten eine Infektion mit Tuberkelbakterien ausgeschlossen oder behandelt werden muss.
Begleitende Therapiemöglichkeiten
Die folgenden „alternativen“ Therapiemöglichkeiten sind nicht wissenschaftlich belegt:
- Ernährungstherapie, etwa mit Modulen (nährstoffbilanzierte Trinknahrung zur ausreichenden Versorgung mit Makro- und Mikronährstoffen)
- Psychotherapie und Entspannungsmethoden (beispielsweise Feldenkrais-Methode, progressive Muskelentspannung, autogenes Training) können Hilfe bei der Stressbewältigung sein und damit zur Verminderung der psychosomatischen Einflussfaktoren beitragen.
Prognose
Es handelt sich um eine chronische Erkrankung mit hoher Rezidiv-, also Wiederauftrittsrate. Komplikationen machen in den meisten Fällen eine operative Therapie erforderlich, die aber auch zu keiner definitiven Heilung führt. Ob sich die Erkrankung auf die Lebenserwartung auswirkt, ist umstritten. Es existieren sowohl Untersuchungen, bei denen keine Signifikanz festgestellt werden konnte, als auch solche, die zu dem Schluss kamen, dass die Lebenserwartung durch die Erkrankung geringfügig sinkt. Wieder andere Studien ermitteln für MC-Patienten sogar eine geringfügig erhöhte Lebenserwartung. Das wird damit erklärt, dass MC-Kranke regelmäßig ärztlich untersucht werden, so dass andere, potentiell gefährliche Erkrankungen bei ihnen frühzeitig entdeckt werden. Vorausgesetzt wird hierbei immer eine adäquate Therapie.
Literatur
- Baumgart DC, Wiedenmann B, Dignass A: Biologische Therapie chronisch-entzündlicher Darmerkrankungen. Z Gastroenterol 2003; 41: 1017–1032, PMID 14562200.
- Baumgart, Daniel C.: „Diagnostik und Therapie von Morbus Crohn und Colitis ulcerosa.“ Dtsch Arztebl Int 2009; 106(8): S. 123-33 Artikel PDF
- Burgdorf W: Cutaneous manifestations of Crohn´s disease. J Am Acad Dermatol 1981; 5: 689, PMID 6459345.
- Cheifetz A, Smedley M, Martin S, Reiter M, Leone G, Mayer L, Plevy S: The incidence and management of infusion reactions to infliximab: a large center experience. Am J Gastroenterol 2003; 98: 1315–1324, PMID 12818276.
- D'Haens G, Van Deventer S, Van Hogezand R, Chalmers D, Kothe C, Baert F, Braakman T, Schaible T, Geboes K, Rutgeerts P: Endoscopic and histological healing with Infliximab antibodies in Crohn´s disease: a European multicenter trial. Gastroenterology 1999; 116: 1029–1034, PMID 10220494.
- Ghosh S, Goldin E, Gordon FH et al.: Natalizumab for active Crohn´s disease. N Engl J Med 2003; 348: 24–32, PMID 12510039.
- Grange F, Djialali-Bouzina F, Weiss AM, Polette A, Guillaume JC: Corticosteroid-resistant pyoderma gangraenosum associated with Crohn`s disease: rapid cure with infliximab. Dermatology 2002; 205: 278–280, PMID 12399677.
- Herfarth H, Obermeier F, Andus T, Rogler G, Nikolaus S, Kuehbacher T, Schreiber S: Improvement of arthritis and arthralgia after treatment with infliximab (Remicade) in a German prospective, open-label, multicenter trial in refractory Crohn´s disease. Am J Gastroenterol 2002; 97: 2688–2690, PMID 12385472.
- Korzenik JR, Dieckgraefe BK: Is Crohn's disease an immunodeficiency? A hypothesis suggesting possible early events in the pathogenesis of Crohn s disease. Dig Dis Sci 2000 Jun;45(6):1121-9, PMID 10877227.
- Menozzi A, Pozzoli C, Poli E, Lazzaretti M, Cantoni A, Grandi D, Giovannini E, Coruzzi G: Effect of the macrolide antibacterial drug, Tylosin, on TNBS-induced colitis in the rat. Pharmacology 2005;74:135-142 (DOI: 10.1159/000084324)
- Petrelli EA, McKinley M, Troncale FJ: Ocular manifestations of inflammatory bowel disease. Ann Ophthalmol 1982; 14: 356, PMID 6125121.
- Podolsky DK: Inflammatory Bowel Disease. N Engl J Med 2002; 347: 417–429, PMID 12167685.
- Present DH, Rutgeerts P, Targan S, Hanauer SB, Mayer L, van Hogezand RA, Podolsky DK, Sands BE, Braakman T, DeWoody KL, Schaible TF, van Deventer SJ: Infliximab for the treatment of fistulas in patients with Crohn's disease. N Engl J Med 1999; 340: 1398–1405, PMID 10228190.
- Sands BE, Anderson FH, Bernstein CN, Chey WY, Feagan BG, Fedorak RN, Kamm MA, Korzenik JR, Lashner BA, Onken JE, Rachmilewitz D, Rutgeerts P, Wild G, Wolf DC, Marsters PA, Travers SB, Blank MA, van Deventer SJ: Infliximab maintenance therapy for fistulizing Crohn's disease. N Engl J Med 2004; 350: 876–885, PMID 14985485.
- Stoll M, Schreiber S: Morbus Crohn: Zweites krankheitsassoziiertes Gen entdeckt. Biologie in unserer Zeit 34(4), S. 208 - 209 (2004), ISSN 0045-205X.
- Targan SR, Hanauer SB, van Deventer SJ, Mayer L, Present DH, Braakman T, DeWoody KL, Schaible TF, Rutgeerts PJ: A short-term study of chimeric monoclonal antibody cA2 to tumor necrosis factor alpha for Crohn´s disease. Crohn´s Disease cA2 Study Group. N Engl J Med 1997; 337: 1029–1035, PMID 9321530.
- Wehkamp J, Harder J, Weichenthal M, Schwab M, Schaffeler E, Schlee M, Herrlinger KR, Stallmach A, Noack F, Fritz P, Schroder JM, Bevins CL, Fellermann K, Stange EF: NOD2 (CARD15) mutations in Crohn´s disease are associated with diminished mucosal a-defensin expression. Gut. 2004 Nov;53:1658-64, PMID 15479689.
- Wehkamp J, Salzman NH, Porter E, Nuding S, Weichenthal M, Petras RE, Shen B, Schaeffeler E, Schwab M, Linzmeier R, Feathers RW, Chu H, Lima H Jr, Fellermann K, Ganz T, Stange EF, Bevins CL: Reduced Paneth cell {alpha}-defensins in ileal Crohn's disease. Proc Natl Acad Sci U S A. 2005 Dec 13;102:18129-34, PMID 16330776.
- Weiner SR, Clarke J, Taggart N, Utsinger PD: Rheumatic manifestations of inflammatory bowel disease. Semin Arthritis Rheum 1991; 20: 353.
Weblinks
- Kompetenznetz-CED – Netzwerk Deutscher Unikliniken zum Thema "Chronisch entzündliche Darmerkrankungen"
- Endoskopiebilder bei M. Crohn
- Sonographiebilder bei M. Crohn
- Der UltraschallAtlas Qualitativ hochwertige Ultraschallbilder aus dem Bereich der Medizin
- S3-Leitlinie „Diagnostik und Therapie des Morbus Crohn“ der DGVS (Stand 2008)
Vereine und Selbsthilfegruppen
- Deutsche Morbus-Crohn-/Colitis-ulcerosa-Vereinigung (DCCV e. V.)
- Österreichische Morbus Crohn/Colitis ulcerosa Vereinigung (ÖMCCV)
- Schweizerische Morbus Crohn und Colitis ulcerosa Vereinigung (SMCCV)
- European Federation of Crohn's and Ulcerative Colitis Associations (EFCCA) - Dachverband der europäischen Patientenvereinigungen
Einzelnachweise
- ↑ Baumgart DC, Carding SR: Inflammatory bowel disease: cause and immunobiology.. In: The Lancet. 369, Nr. 9573, 2007, S. 1627–40. doi:10.1016/S0140-6736(07)60750-8. PMID 17499605
- ↑ Baumgart DC, Sandborn WJ: Inflammatory bowel disease: clinical aspects and established and evolving therapies.. In: The Lancet. 369, Nr. 9573, 2007, S. 1641–57. doi:10.1016/S0140-6736(07)60751-X. PMID 17499606
- ↑ Xavier RJ, Podolsky DK: Unravelling the pathogenesis of inflammatory bowel disease.. In: Nature. 448, Nr. 7152, 2007, S. 427-34. doi:10.1038/nature06005. PMID 17653185
- ↑ Jacobsen BA et al. Increase in incidence and prevalence of inflammatory bowel disease in northern Denmark: a population-based study, 1978-2002. Eur J Gastroenterol Hepatol. 2006 Jun;18(6):601-6.
- ↑ DCCV.de: Erhöhtes Risiko für Raucher, abgerufen am 14.Mai 2008
- ↑ aerzteblatt (27. Oktober 2006)
- ↑ [1] (August 2007)
- ↑ Mpofu et al: Microbial mannan inhibits bacterial killing by macrophages: a possible pathogenic mechanism for Crohn's disease., Gastroenterology 2007 Nov;133(5):1487-98
- ↑ http://www.uni-duesseldorf.de/awmf/ll-na/021-004.htm
- ↑ http://gut.bmj.com/cgi/content/full/55/suppl_1/i1
- ↑ http://gut.bmj.com/cgi/content/full/55/suppl_1/i16
- ↑ http://gut.bmj.com/cgi/content/full/55/suppl_1/i36
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.