- Trichlorethen
-
Strukturformel 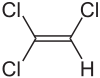
Allgemeines Name Trichlorethen Andere Namen - Trichlorethylen (Tri)
- Ethylentrichlorid
- Acetylentrichlorid
- TCE
Summenformel C2HCl3 CAS-Nummer 79-01-6 Kurzbeschreibung farblose Flüssigkeit mit süßlich-etherischem Geruch[1]
Eigenschaften Molare Masse 131,39 g·mol−1 Aggregatzustand flüssig
Dichte 1,46 g·cm−3 [1]
Schmelzpunkt Siedepunkt 87 °C [1]
Dampfdruck Löslichkeit schlecht in Wasser (1 g·l−1) [1]
Brechungsindex 1,4782 (20 °C)[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 

Gefahr
H- und P-Sätze H: 350-341-319-315-336-412 EUH: keine EUH-Sätze P: 201-273-308+313-305+351+338-302+352 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Giftig (T) R- und S-Sätze R: 45-36/38-52/53-67 S: 53-45-61 LD50 2402 mg·kg−1 (Maus, oral) [4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Trichlorethen (Trivialname: Trichlorethylen, Trichlor, Tri) ist eine farblose, klare Flüssigkeit. Sie riecht nach Chloroform und ist unentzündlich. Sie wirkt als starkes Lösungsmittel und wurde deshalb früher in Formen- und Walzenwaschmitteln in der Druckindustrie und in metallverarbeitenden Betrieben als Teilereinigungsmittel eingesetzt.
Trichlorethen löst Polyolefine und chemisch verwandte Kunststoffe an und macht sie weich und undurchsichtig.
Inhaltsverzeichnis
Gewinnung und Darstellung
Bis Anfang der 1970er Jahre wurde Trichlorethen meist in einem Zwei-Schritt-Verfahren aus Ethin hergestellt. Zunächst wird Ethin mit Chlor und einem Eisenchlorid-Katalysator bei 90 °C zu 1,1,2,2-Tetrachlorethan umgesetzt[5] :
Das 1,1,2,2-Tetrachlorethan wurde dann zu Trichlorethen dehydrochloriert. Dies kann entweder mit einer wässrigen Lösung von Calciumhydroxid[6]
oder in der Gasphase durch Erhitzen auf 300–500 °C mit einem Barium- oder Calciumchlorid-Katalysator geschehen:
Heute wird Trichlorethen meist aus Ethen produziert. Dieses wird zuerst mit Hilfe eines Eisenchlorid-Katalysator durch Chlorierung in 1,2-Dichlorethan umgewandelt
und dann bei 400 °C mit zusätzlicher Chlor in Trichlorethen umgewandelt.
Diese Reaktion kann durch eine Vielzahl von Stoffen katalysiert werden. Der am häufigsten verwendete Katalysator ist eine Mischung aus Kaliumchlorid und Aluminiumchlorid. Allerdings können auch verschiedene Formen von porösem Kohlenstoff verwendet werden. Diese Reaktion produziert als Nebenprodukt auch Tetrachlorethen, welches, je nach Menge von zugeführtem Chlor, auch Hauptprodukt werden kann. Typischerweise werden Trichlorethen und Tetrachlorethen gesammelt und dann durch Destillation abgetrennt.[2]
Verwendung
Aufgrund seiner guten fettlösenden Eigenschaft, der Flüchtigkeit und Nichtbrennbarkeit ist Trichlorethen, neben verwandten Verbindungen wie z. B. Perchlorethen, eines der gebräuchlichsten Reinigungs-, Entfettungs- und Extraktionsmittel gewesen. Es fand beispielsweise Verwendung in der Metall- und Glasindustrie, bei der Chemischen Reinigung und in der Textilbearbeitung. Noch heute ist es von Bedeutung als Schwerflüssigkeit bei Mineralien und als Zwischenprodukt bei chemischen Synthesen. Außerdem wird es in der Bitumen- und Asphaltindustrie als Lösemittel für Bitumen verwendet.
Sicherheitshinweise
Trichlorethen ist gesundheitsschädlich und stark narkotisierend: Das Einatmen von Luft mit 200 ppm führt zu Müdigkeit. Es wurde von der MAK-Kommission als krebserzeugend (Kategorie 2[1][3]) und keimzellmutagen (Kategorie 3B) eingestuft. Es ist als "giftig" zu kennzeichnen.
Luftgrenzwert am Arbeitsplatz: In Deutschland besteht zur Zeit kein verbindlicher Grenzwert. In den USA beträgt der Grenzwert 50 ppm.
Akute Vergiftungen führen zu Hirnschäden, Erblindung und zur Aufhebung der Geruchs- und Geschmacksempfindung.
Im Körper wird es durch Monooxigenasen zu Trichlorethenoxid, Trichloracetaldehyd, Trichlorethanol und Trichloressigsäure umgewandelt. Trichlorethanol wird glukoronidiert und mit dem Urin ausgeschieden, während sich die Trichloressigsäure wegen ihrer starken Bindung an Eiweiße des Blutplasma anreichert und neurotoxisch wirkt.
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu Trichlorethen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Sep. 2007 (JavaScript erforderlich)
- ↑ a b Trichlorethylen (Inchem)
- ↑ a b Eintrag zu CAS-Nr. 79-01-6 im European chemical Substances Information System ESIS
- ↑ Trichlorethen bei ChemIDplus
- ↑ Lawrence Fishbein, Potential Industrial Carcinogens and Mutagens, ISBN 978-0-444-41777-0
- ↑ Joachim Buddrus: Grundlagen der Organischen Chemie, Walter de Gruyter Verlag, Berlin, 4. Auflage, 2011, S. 252, ISBN 978-3-11-024894-4.
Wikimedia Foundation.





