- Neuwelt-Schraubenwurmfliege
-
Neuwelt-Schraubenwurmfliege 
Neuwelt-Schraubenwurmfliege (Cochliomyia hominivorax)
Systematik Klasse: Insekten (Insecta) Ordnung: Zweiflügler (Diptera) Familie: Schmeißfliegen (Calliphoridae) Gattung: Cochliomyia Art: Neuwelt-Schraubenwurmfliege Wissenschaftlicher Name Cochliomyia hominivorax (Coquerel, 1858) Die Neuwelt-Schraubenwurmfliege (Cochliomyia hominivorax) ist eine Schmeißfliegen-Art, deren Maden ihren Wirt von außen befallen und damit als Ektoparasiten leben. Sie befallen als sogenannte obligate Parasiten stets Warmblüter und ernähren sich von deren Körpergewebe. Dadurch unterscheiden sie sich von den Larven der anderen drei Arten der Gattung Cochliomyia, die als fakultative Parasiten nur gelegentlich lebende Organismen befallen und sich ansonsten in Aas oder Fäkalien entwickeln. Aus diesem Grund wird die Neuwelt-Schraubenwurmfliege oft auch als „primäre Schraubenwurmfliege“ bezeichnet. Die Eiablage erfolgt mit Vorliebe an Wunden, worauf die Larven schlüpfen und sich unter die Haut fressen. Dieser Befall kann ernsthafte, mitunter tödliche Folgen für den Wirtsorganismus haben.
Die Neuwelt-Schraubenwurmfliege war die erste Art, an der die Sterile-Insekten-Technik getestet und in natürlicher Umgebung angewandt wurde. Seit den 1950er Jahren wird sie in Nord- und Zentralamerika bekämpft und systematisch ausgerottet. Verbreitet ist sie noch in tropischen bis subtropischen Teilen Zentral- und Südamerikas. Da eine Wiedereinschleppung über Viehtransporte befürchtet wird, müssen beispielsweise in den USA befallene Tierbestände weiterhin gemeldet werden.
Inhaltsverzeichnis
Beschreibung
Imago
Die 8 bis 10 Millimeter großen Imagines haben einen metallisch schillernden, blau-grün-schwarz gefärbten Körper, die Farbe des Kopfs und der Augen reicht von gelb bis orange-rötlich und braun. Auf der Oberseite des Thorax sind drei dunkle, längsgerichtete Streifen vorhanden. Am Kopfschild tragen sie schwarze Setae.[1][2] Diese Setae sind ein Unterscheidungsmerkmal zur ähnlich aussehenden, in Sympatrie lebenden Art Cochliomyia mecallaria, die wenige gelbliche Setae hat. Auch ist die Neuwelt-Schraubenwurmfliege der Altwelt-Schraubenwurmfliege (Chrysomya bezziana) ähnlich. Auffälligster Unterschied ist bei den Weibchen die Farbe der Tegula: Bei der Neuwelt-Schraubenwurmfliege ist sie dunkel braun-schwarz, bei der Altwelt-Schraubenwurmfliege ist sie gelb.[3]
Es besteht ein Geschlechtsdimorphismus, bei Männchen grenzen die Augen direkt oder fast direkt aneinander (holoptisch oder subholoptisch), bei Weibchen sind die Augen deutlich getrennt (dichoptisch).[4] Die Männchen besitzen außerdem 12 Prozent größere Flügel, die aber enger geformt sind.[5] Zudem sind die Männchen größer. Dies könnte auf das territoriale und aggressive Verhalten gegenüber Artgenossen wie auch gegenüber artfremden, meist kleineren Insekten zurückzuführen sein. Zusätzlich verstärkend auf den Konkurrenzkampf wirkt das Verhalten des Weibchens, das nur mit einem Männchen kopuliert.[6] Die geographische Variation ist noch ungenügend erforscht.[7]
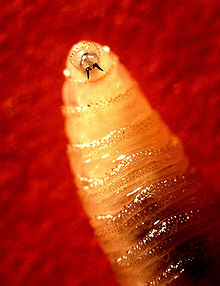
Larve
Die kegelförmigen Larven haben am schmalen Ende leckend-saugende Mundwerkzeuge (Mandibeln).[8] Von anderen Fliegenlarven unterscheiden sie sich vor allem durch die auffällig dunklen, einzigartigen Tracheen. Diese sind als schwarze Streifen erkennbar und ziehen sich ab dem dritten Stadium vom zwölften zum neunten Segment längs durch den Körper. Am breiten Ende hat die Larve zwei Atem-Öffnungen (Stigmen), die im zweiten Stadium in zwei Schlitze und im dritten Stadium in drei Schlitze unterteilt sind. Die Stigmen am schmalen Ende münden in sechs bis elf, meist sieben bis neun „Ästchen“ (auch Lobi genannt). Larven im dritten Stadium sind 6 bis 17 Millimeter groß − im Durchschnitt 15 Millimeter − mit einem Durchmesser von 1,1 bis 3,6 Millimeter. Junge Larven haben einen cremig weißen Farbton. Ausgewachsene Larven bekommen eine rötlich-rosa Haut. Die auffälligen Ringe aus Stacheln, die sich quer um den Körper ziehen, dienen der Larve dazu, ihre Position im Gewebe zu halten. Die Stacheln können in einem oder in zwei spitze Enden auslaufen und sind im dritten Larvenstadium durchschnittlich 130 Mikrometer lang.[9][10]
Entwicklung, Lebensweise und Ökologie
Neuwelt-Schraubenwurmfliegen sind auf einen Wirt angewiesen (obligater Parasitismus), weil die Larven lebendes Gewebe als Nahrung benötigen. Die Art wird im Englischen deshalb auch „Primary Screwworm Fly“ („Primäre Schraubenwurmfliege“) genannt. Mit dieser Lebensweise unterscheidet sie sich von fakultativen Myiasis-Erregern (fakultativer Parasitismus), die vornehmlich nekrotisches Gewebe oder Exkremente verwerten. Fakultative Parasiten können durch Schraubenwurmfliegen-Myiasis angelockt werden und gelten als sekundäre Myiasis-Erreger, so beispielsweise Cochliomyia macellaria. Diese Art wird auch „Sekundäre Schraubenwurmfliege“ („Secondary Screwworm Fly“) genannt, weil sie nach der Neuwelt-Schraubenwurmfliege am häufigsten als Verursacher einer Myiasis zu finden ist.[11]
Die Art ist ovipar, die Gelege umfassen 200 bis 500 Eier bei einer Leistung von 200 bis 300 Eiern in 15 bis 20 Minuten.[12] Die Eiablage erfolgt vornehmlich neben das freiliegende Fleisch von Warmblütern und zumeist am späten Nachmittag bis abends, um die Eier nicht erhöhter, schädigend wirkender Sonnenstrahlung auszusetzen. Die weißen Eier werden dicht aneinandergereiht gelegt und alle gleich ausgerichtet, was charakteristisch für die Neuwelt-Schraubenwurmfliege ist. Die Weibchen können in Abständen von drei Tagen bis zu vier Mal Gelege produzieren. Während einer Lebensdauer von annähernd 31 Tagen kann das Weibchen bis zu 300 Kilometer zurücklegen, durchschnittlich aber nur 40 bis 55 Kilometer pro Woche. In dieser Zeit legt ein Weibchen bis zu 2800 Eier, währenddessen es sich von Nektar und Wundsekreten ernährt. Die Imagines benötigen keine Proteine für ihre Ernährung, beim Weibchen steigern sie jedoch die Produktion der Eier und deren Entwicklung.[13][14]
Die Neuwelt-Schraubenwurmfliege legt die Eier bevorzugt neben Wunden, verursacht beispielsweise durch Enthornung oder Kastration, aber auch neben den Nabel von Neugeborenen oder an Insektenstiche. Es können auch gesunde Stellen mit weichem Gewebe oder Körperöffnungen befallen werden, wie der innere Augenwinkel (Medialer Kanthus) oder das Perineum. Die Neuwelt-Schraubenwurmfliege befällt Wild- und Haustiere, seltener auch Vögel und Menschen. Wechselwarme (poikilotherme) Tiere oder Aas werden nicht befallen.[15][16]
Zwölf bis vierundzwanzig Stunden nach der Eiablage schlüpfen die Larven und fressen sich mittels extraintestinaler Verdauung[17] − ermöglicht durch proteolytische Enzyme im Speichel − gesellig subcutan (also unter der Haut) in Gewebe und Muskeln. Die Larven durchlaufen drei Stadien mit zwei Häutungen, welche die Wachstumsgeschwindigkeit fördern.[18] Fünf bis sieben Tage nach dem Schlüpfen lassen sich die Larven zu Boden fallen, um sich zu vergraben und zu verpuppen. Die Puppe entwickelt sich im Puparium, einem dunklen, verhärteten Schutz aus der Oberhaut des dritten Larvenstadiums. Nach weiteren drei bis fünf Tagen schlüpfen sie als Imago, üblicherweise zu Tagesbeginn, um am Boden ihre Flügel in der Sonne zu trocknen und um tagaktiven Räubern zu entgehen. Männchen können in 24 Stunden geschlechtsreif sein, während beim Weibchen die Bildung der Eierstöcke sechs bis sieben Tage dauert. Das Weibchen paart sich allerdings bereits im Alter von drei bis vier Tagen und legt seine Eier dann vier Tage später.[19] Die Paarung erfolgt auf Vegetation. Weibchen kopulieren nur einmal und behalten die Spermien des Männchens ein Leben lang, was bei den Ausrottungsprogrammen mit der Sterile-Insekten-Technik ausgenutzt wurde. Die Männchen hingegen paaren sich bis zu zehn Mal. Sie verhalten sich scheu und verstecken sich in der Vegetation, bis sie ein Weibchen ausmachen.[20]
Die Larvenentwicklung und Verpuppungsdauer ist temperaturabhängig und kann bei einer Durchschnittstemperatur von 29 °C in 18 Tagen vollendet sein, oder aber unter ungünstigen Bedingungen zwei bis drei Monate in Anspruch nehmen; ein Lebenszyklus kann in 20 Tagen abgeschlossen sein. Eine Diapause erfolgt nicht. Bei langanhaltenden Temperaturen unter 8 °C sterben die Larven.[19]
Pathologie und Vektortätigkeit
Die Larven verursachen eine Myiasis, die in diesem Fall auch Schraubenwurmkrankheit („Screwworm myiasis“) genannt wird.[21]
Da sich die Larven tief ins Fleisch fressen und nur eine relativ kleine Öffnung zurücklassen, ist ein Befall nicht immer offensichtlich. Es kann aber Wundsekret aus der Wunde fließen, dieses das Fell des Tieres verschmutzen und so auf eine Infestation hinweisen.[22] Charakteristisch ist der faulige Geruch der Wunde. Es können auch andere, für Myiasis typische Symptome, herangezogen werden: Appetitmangel, Gewichtsverlust und Ruhelosigkeit des Tieres, regelmäßiges Lecken der Läsion vom Tier, Lethargie, Schwäche und zurückhaltende Bewegungen. Das befallene Tier trennt sich von der Herde und sucht schattige Orte zum Rasten auf. Blutungen können schwerwiegend sein, das umliegende Gewebe ist angespannt, ödematös und heiß. Andauernder Befall hat große, unregelmäßige und sackförmige Löcher zur Folge. Der Wirt kann dadurch erheblichen Schaden erleiden und auch sterben, insbesondere durch Sekundärinfektionen.[23]
Die Fliege spielt eine Rolle als Vektor: Sie kann beispielsweise das Maul-und-Klauenseuche-Virus und jenes der klassischen Schweinepest übertragen. Um die Fliegen für die Sterile-Insekten-Technik zu züchten, muss das Zuchtmedium keimfrei sein, was zum Beispiel mithilfe von Formaldehyd erreicht wird.[24]
Lebensraum
Die Neuwelt-Schraubenwurmfliege lebt bevorzugt in baumbewachsenen, schattigen, gewässerreichen oder feuchten Gebieten. Offenes und trockenes Gelände ohne Vegetation wird gemieden. Optimale Temperaturen reichen von 20 bis 30 °C. Frost überlebt die Art nicht; an entsprechenden Orten findet keine Überwinterung statt. Die biologischen und klimatischen Bedürfnisse der Neuwelt- und der Altwelt-Schraubenwurmfliege sind ähnlich, und obwohl sie geografisch getrennt sind, spricht nichts gegen eine zukünftige Überlappung ihrer Ausbreitungsgebiete, würden die Arten durch Viehtransporte verschleppt.[2][25]
Die natürliche Dichte liegt bei unter 200 Fliegen pro Quadratkilometer. Sie ergibt sich vom Lebensraum und der Anzahl geeigneter Wirtstiere, überdies auch von der Form der Agrarwirtschaft: Kleinbauern haben eine bessere Kontrolle über ihre Tiere als Bauern, die großflächige und extensiv bewirtschaftete Flächen nutzen.[14][26]
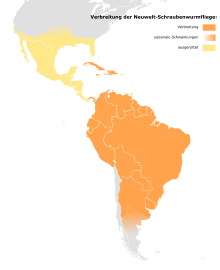
Verbreitung
Ursprüngliches Verbreitungsgebiet waren die südlichen Staaten der USA, Mexiko, Zentralamerika, die nördlichen Staaten Südamerikas bis Uruguay und Nordargentinien einschließlich einigen karibischen Inseln wie Kuba, Trinidad, Hispaniola, Jamaika und Tobago. Derzeit ist die Art aufgrund der Ausrottungsprogramme ausschließlich in Süd- und Mittelamerika bis zum Panamakanal und einigen karibischen Inseln verbreitet. Die Vorkommen in Südargentinien sind dynamisch. Sie sind vor allem abhängig von der Temperatur: Im Winter und frühen Frühling werden in der südlichen Hälfte Argentiniens keine Infestationen verzeichnet.[27] Während in den Wintermonaten die äußersten südlichen und ehemaligen nördlichen Populationen zusammenbrechen, bleiben sie in den Tropen stabil.[28] Vor der Ausrottung in den USA konnte sich die Schraubenwurmfliege in günstigen Jahren bis zur kanadischen Grenze verbreiten. Ausbreitungen geschehen mit einer Geschwindigkeit von etwa 80 bis 160 Kilometer pro Generation.[29]
Chile gilt als frei von Neuwelt-Schraubenwurmfliegen, obwohl die genaue Verbreitung in den Anden ungesichert ist.[30]
Neuwelt-Schraubenwurmfliege und Mensch
Bekämpfung
Im Jahr 1954 wurden erste Tests mit der Sterile-Insekten-Technik (SIT) auf Curaçao vorgenommen, worauf die Neuwelt-Schraubenwurmfliege auf der Insel innerhalb von vier Monaten erfolgreich ausgerottet wurde. Von 1958 bis 1960 wurde die Art in den südöstlichen Staaten der USA ausgerottet, danach in den südwestlichen Staaten. Seit 1966 gilt die Art in den ganzen USA als ausgerottet. Die Bekämpfung zog sich weiter nach Mexiko (1972–1991), den Jungferninseln (1971–1972), Puerto Rico (1975) und in Zentralamerika von Guatemala (1988–1994) nach Belize (1988–1994), El Salvador (1991–1995), Honduras (1991–1995), Nicaragua (1992–1999) und Costa Rica (1995–2000). 1998 wurden in Panama erste sterile Fliegen losgelassen. Ziel ist es, in Panama eine dauerhafte Barriere gegen Neuwelt-Schraubenwurmfliegen-Invasionen aufzubauen. Dies wird durch wöchentliche sterile Neuwelt-Schraubenwurmfliegen-Freilassungen mit bis zu 50 Millionen Insekten erreicht.[28][31] Die Insekten werden in Massen in Fabriken gezüchtet, mit ionisierender Strahlung behandelt und somit sterilisiert. Wichtig dabei ist, dass die gezüchteten Insekten keine Behinderung für den Konkurrenzkampf mit wilden, fertilen Insekten erleiden. Forscher untersuchen die Möglichkeiten und Verfahren, zukünftig genetisch sterilisierte Männchen zu produzieren. Diese Methode ist aber noch nicht praxistauglich.[32]
 Das USDA versieht Neuwelt-Schraubenwurmfliegen mit Nummern, um ihr Verhalten zu studieren.
Das USDA versieht Neuwelt-Schraubenwurmfliegen mit Nummern, um ihr Verhalten zu studieren.
Unterstützt wird die Bekämpfung von der Forschung vor Ort: Mittels Duftstoff- und Pheromon-Fallen sowie mit „Fleisch-Fallen“ werden laufend Populationskontrollen durchgeführt. Es können unter anderem Informationen zur Populationsdichte und dem Anteil von sterilen und fertilen Insekten gewonnen werden. Der Agricultural Research Service des USDA studiert das Verhalten, die Lebensdauer und Verbreitung mittels mit Nummern versehenen Insekten. Mit den Forschungsdaten wurde auch schon ein Programm entwickelt, das Populationsdynamiken simulieren kann.[33]
Nicht erfolgreich war die SIT zwischen 1999 und 2005 auf Jamaika. Es wird vermutet, dass es den aus Mexiko importierten (gezüchteten) Individuen unmöglich war, sich mit den einheimischen Weibchen zu paaren, die ursprünglich aus Südamerika stammen.[34] Bevor in Südamerika Ausrottungsprogramme gestartet werden, sind noch weitere Forschungen über die Kopulations-Kompatibilität, Variationen und mögliche kryptische Arten der Populationen nötig. Auch muss die Bevölkerung für zukünftige Bemühungen bezüglich der Ausrottung sensibilisiert werden.[35]
1988 wurde die Art in Libyen eingeschleppt und hat sich dort schnell etabliert und ausgebreitet. Wiederum kam die SIT zum Einsatz: In einem Gebiet von über 100.000 Quadratkilometern in Libyen und dem angrenzenden Tunesien wurden wöchentlich bis zu 40 Millionen sterile Männchen ausgesetzt. Der letzte Fall von infizierten Tieren geht auf den April 1991 zurück. Die SIT wurde aber, um sicher zu gehen, während neun weiterer Lebenszyklen angewandt.[36][37][28]
Bedeutung als Krankheitserreger
Menschen werden vor allem an Nacken und Kopf befallen; wobei in manchen Fällen mehr als 100 Maden vorhanden sind. Ernste bis tödliche Läsionen entstanden durch Infestationen im Ohr, Mund, in der Nase und am Auge. An diesen Körperöffnungen können auch gesunde Menschen befallen werden. Menschenbefall ist in den Verbreitungsgebieten keine Seltenheit.[23][15] Erhöhte Anfälligkeit ist unter Menschen zu verzeichnen, die mit Tieren oder auf Feldern arbeiten, vor allem solche mit verletzter Haut. Zusätzlich sind Menschen gefährdet, die wenig Körperpflege betreiben, in ärmlichen Lebensverhältnissen leben oder an Alkoholismus oder Diabetes leiden. Auch Sonnenbader und ältere Menschen sind einem erhöhten Risiko ausgesetzt.[27][38] In Brasilien beispielsweise ist die Neuwelt-Schraubenwurmfliege für die meisten Myiasis-Fälle verantwortlich. Die am häufigsten mit Myiasis einhergehende Krankheit ist eine durch Läusebefall verursachte Pedikulose, und Symptome von Myiasis können von Patienten für Pedikulose-Symptome gehalten werden.[39]
Obwohl alle Warmblüter als Wirte in Frage kommen, sind die größten ökonomischen Verluste bei Rindern, Schafen und Ziegen zu vermelden. Um das Risiko des Befalls von Tieren zu verringern, können in Gebieten, wo saisonale Schwankungen der Neuwelt-Schraubenwurmfliegen-Populationen auftreten, diese Schwankungen ausgenutzt werden. Beispielsweise wurden Geburten, Kastrationen, das Aufbringen von Brandzeichen, Enthornungen, Ohrmarkierungen und Schur auf Neuwelt-Schraubenwurm-freie Zeiten hin geplant.[29] Bei Befall von Tieren empfiehlt beispielsweise das California Department of food and agriculture einen Veterinär aufzusuchen, das Tier unter Quarantäne zu stellen und die Wunde mit einem Larvizid zu behandeln und zu pflegen. Präventiv bedeutend ist eine den Umständen gerechte Wundversorgung. Weil Larven unterschiedlicher Arten und Alters in einer Wunde sein können, sollten für diagnostische Zwecke Larven im tiefsten Teil der Wunde herangezogen werden.[13] Allein mit Wundversorgungen kann die Neuwelt-Schraubenwurmfliege aber nicht ausgerottet werden, da Wildtiere ein Reservoir an Wirten bilden.[29]
Die Schäden, welche die Neuwelt-Schraubenwurmfliege zwischen 1958 und 1960 in der südöstlichen USA verursachte, wurden auf 20 Millionen Dollar geschätzt, während das Ausrottungsprogramm 11 Millionen Dollar kostete.[20] Neuere Einschätzungen belaufen sich auf eine jährliche Ersparnis für die USA von etwa 796 Millionen US-Dollar, für Mexiko 292 Millionen US-Dollar und für Zentralamerika um 77,9 Millionen US-Dollar.[40] Die Ausrottung in den südlichen USA kam vor allem dem land- und forstwirtschaftlichen Sektor zugute: Während in einigen Jahren bis zu 80 % des Weißwedelhirsch-Nachwuchses der Neuwelt-Schraubenwurmfliege zum Opfer fielen, führte die Ausrottung zu einem wirtschaftlichen Aufschwung in der Hirschzucht.[11]
Zur Madentherapie eignet sich die Larve der Neuwelt-Schraubenwurmfliege wegen ihrer Malignität nicht.[41]
Systematik und Forschungsgeschichte
Die Neuwelt-Schraubenwurmfliege ist der Gattung Cochliomyia der Familie der Schmeißfliegen zugehörig. Zur Gattung gehören weiterhin die Arten C. aldrichi, C. macellaria und C. minima.[42][4][43][44]
Als Erstbeschreiber gilt Charles Coquerel, der 1858 in den Annalen der Société entomologique de France die Art als Lucilia hominivorax beschrieb.[45] Das Art-Epitheton hominivorax bedeutet wörtlich übersetzt Menschenesser.[46] Die Taxonomie innerhalb der Gattung blieb aber lange umstritten, weil Coquerels Publikation die amerikanischen Entomologen nicht erreichte. Weiterhin erschwerten die Ähnlichkeit von C. macellaria mit der Neuwelt-Schraubenwurmfliege und ihre geographische Überlappung korrekte Identifikationen.[7] Aufgrund der Verwechslung mit C. macellaria wurden infizierte Kadaver verbrannt oder vergraben, in der Annahme, mit diesem Vorgehen die Neuwelt-Schraubenwurmfliege zu bekämpfen, bis 1933 E. C. Cushing und P. C. Patton die Neuwelt-Schraubenwurmfliege identifizierten und Cochliomyia americana nannten. Nach der Identifikation des Krankheitserregers begannen Edward F. Knipling und Raymond C. Bushland die Art zu untersuchen und entwickelten die SIT, wofür sie 1992 den Welternährungspreis erhielten.[46][47]
In älterer Literatur ist auch noch der wissenschaftliche Gattungsname Callitroga anzutreffen, wie in Callitroga hominivorax oder Callitroga americana (jeweils bezeichnend für die Neuwelt-Schraubenwurmfliege). Die ICZN entschied aber 1986, dass der Gattungsname „Callitroga Brauer, 1883“ ungültig sei und dass „Cochliomyia Townsend, 1915“ der fortan offizielle wissenschaftliche Gattungsname sein soll.[48]
Quellen
Literatur
- Weltorganisation für Tiergesundheit (OIE) Terrestrial Manual 2008: New World Screwworm (Cochliomyia hominivorax) and Old Worm Srewworm (Chrysomya bezziana) (PDF-Dokument, 491,5 KB, englisch; inklusive Zeichnungen und Fotos). Abgerufen am 15. Oktober 2010.
- Luis Trombetta et al.: Case Report: Cutaneous myiasis due to Cochliomyia hominivorax in a drug user, (PDF-Dokument, 212 KB, englisch). Copyright © 2009 Trombetta et al.. S. 874-875. Abgerufen am 26. Oktober 2010.
- M. Vargas-Terán et al.: Impact of Screwworm Eradication Programmes using the Sterile Insect Technique (PDF, 133.5 KB, englisch). Sterile Insect Technique. Principles and Practice in Area-Wide Integrated Pest Management, 629-650. © 2005 IAEA. Springer. Printed in the Netherlands. S. 635. Abgerufen am 24. November 2010.
- Animal Health Australia: Australian Veterinary Emergency Plan (AUSVETPLAN); Disease Strategy Screw-worm fly, Version 3.0, 2007, (PDF-Dokument, 52.2 KB, englisch). Abgerufen am 2. Oktober 2010.
Weblinks
-
 Commons: Cochliomyia hominivorax – Sammlung von Bildern, Videos und Audiodateien
Commons: Cochliomyia hominivorax – Sammlung von Bildern, Videos und Audiodateien - Artikel von der Ernährungs- und Landwirtschaftsorganisation (FAO):
- M. J. R. Hall: Screwworm flies as agents of wound myiasis, (englisch). Abgerufen am 28. Oktober 2010.
- M. Vargas-Terán: The new world screwworm in Mexico and Central America, (englisch). Abgerufen am 28. Oktober 2010.
- James E. Novy: Screwworm control and eradication in the southern United States of America (englisch). Abgerufen am 30. November 2010.
- Screwworm Eradiction Program Records. Eine Sammlung von Texten, Ton-, Bild- und Videomaterial, bereitgestellt von der National Agricultural Library vom United States Department of Agriculture.
- Cochliomyia hominivorax auf merckvetmanual.com (englisch). Abgerufen am 2. Oktober 2010.
- Eintrag in uBio: Cochliomyia hominivorax, (englisch). Abgerufen am 2. Oktober 2010.
- Bilder von Larven und Imagines, bereitgestellt von DPDx (englisch). Abgerufen am 22. Oktober 2010.
Einzelnachweise
- ↑ Proceedings of the Entomological Society of Washington. In der Biodiversity Heritage Library. Abgerufen am 10. Oktober 2010.
- ↑ a b Animal Health Australia: Australian Veterinary Emergency Plan (AUSVETPLAN); Disease Strategy Screw-worm fly, Version 3.0, 2007, (PDF-Dokument, 52.2 KB, englisch). S. 9. Abgerufen am 2. Oktober 2010.
- ↑ Weltorganisation für Tiergesundheit (OIE) Terrestrial Manual 2008: New World Screwworm (Cochliomyia hominivorax) and Old Worm Srewworm (Chrysomya bezziana) (PDF, 491,5 KB, englisch; inklusive Zeichnungen und Fotos). S. 270. Abgerufen am 15. Oktober 2010.
- ↑ a b James P. Dear: A Revision of the New World Chrysomyini (Diptera: Calliphoridae) (PDF-Dokument, 16,2 MB, englisch; inklusive Zeichnungen). Revista Brasileira de Zoologia, Volume 3 1985. S. 136.
- ↑ M. L. Lyra et al.: Wing morphometry as a tool for correct identification of primary and secondary New World screwworm fly (PDF-Dokument, 16,2 MB, englisch; inklusive Zeichnungen und Grafiken). Bulletin of Entomological Research (2010). S. 21. Abgerufen am 22. November 2010. doi:10.1017/S0007485309006762
- ↑ M. L. Lyra et al.: Wing morphometry as a tool for correct identification of primary and secondary New World screwworm fly (PDF-Dokument, 16,2 MB, englisch; inklusive Zeichnungen und Grafiken). Bulletin of Entomological Research (2010). S. 23. Abgerufen am 22. November 2010. doi:10.1017/S0007485309006762
- ↑ a b M. L. Lyra et al.: Wing morphometry as a tool for correct identification of primary and secondary New World screwworm fly (PDF-Dokument, 16,2 MB, englisch; inklusive Zeichnungen und Grafiken). Bulletin of Entomological Research (2010). S. 20. Abgerufen am 22. November 2010. doi:10.1017/S0007485309006762
- ↑ Thomas Schnieder (Hrsg.): Veterinärmedizinische Parasitologie. Parey in MVS Medizinverlage Stuttgart GmbH & Co, Stuttgart 2006, ISBN 3-8304-4135-5 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Thomas Schnieder (Hrsg.): Veterinärmedizinische Parasitologie. Parey in MVS Medizinverlage Stuttgart GmbH & Co, Stuttgart 2006, ISBN 3-8304-4135-5 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Weltorganisation für Tiergesundheit (OIE) Terrestrial Manual 2008: New World Screwworm (Cochliomyia hominivorax) and Old Worm Srewworm (Chrysomya bezziana) (PDF-Dokument, 491,5 KB, englisch; inklusive Zeichnungen und Fotos). S. 269. Abgerufen am 15. Oktober 2010.
- ↑ a b M. J. R. Hall: Screwworm flies as agents of wound myiasis, (englisch). Artikel von der Ernährungs- und Landwirtschaftsorganisation (FAO). Abgerufen am 28. Oktober 2010.
- ↑ John G. Riemann: The Development of Eggs of Cochliomyia Hominivorax (Coquerel), (englisch). Abgerufen am 9. Oktober 2010.
- ↑ a b California Department of Food and Agriculture Animal Health Branch: Fact Sheet: Screwworm (PDF-Dokument, 52.2 KB, englisch). Abgerufen am 2. Oktober 2010.
- ↑ a b Animal Health Australia: Australian Veterinary Emergency Plan (AUSVETPLAN); Disease Strategy Screw-worm fly, Version 3.0, 2007, (PDF-Dokument, 52.2 KB, englisch). S. 16. Abgerufen am 2. Oktober 2010.
- ↑ a b Graham B. White et al.: Filth Flies: Significance, Surveillance and Control in Contingency Operations (englisch). Veröffentlicht vom Armed Forces Pest Management Board. Abgerufen am 17. Oktober 2010.
- ↑ Animal Health Australia: Australian Veterinary Emergency Plan (AUSVETPLAN); Disease Strategy Screw-worm fly, Version 3.0, 2007, (PDF-Dokument, 52.2 KB, englisch). S. 11. Abgerufen am 2. Oktober 2010.
- ↑ Heinrich Behrens et al.: Lehrbuch der Schafkrankheiten. Blackwell Wissenschafts-Verlag, Berlin, Wien 2001, ISBN 3-8263-3186-9 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Weltorganisation für Tiergesundheit (OIE) Terrestrial Manual 2008: New World Screwworm (Cochliomyia hominivorax) and Old Worm Srewworm (Chrysomya bezziana), (PDF-Dokument, 491,5 KB, englisch; inklusive Zeichnungen und Fotos). Abgerufen am 15. Oktober 2010.
- ↑ a b Weltorganisation für Tiergesundheit (OIE) Terrestrial Manual 2008: New World Screwworm (Cochliomyia hominivorax) and Old Worm Srewworm (Chrysomya bezziana) (PDF, 491,5 KB, englisch; inklusive Zeichnungen und Fotos). Abgerufen am 15. Oktober 2010.
- ↑ a b International Screwworm Program (englisch). United States Department of Agriculture (USDA). Abgerufen am 8. Oktober 2010.
- ↑ M. Donald Mc Cavin et al.: Pathologie der Haustiere. 1. Auflage. Urban & Fischer Verlag, Stuttgart 2009, ISBN 978-3-437-58250-9 (Eingeschränkte Vorschau in der Google Buchsuche. S. 1077). Abgerufen am 21. Oktober 2010.
- ↑ Cochliomyia hominivorax auf merckvetmanual.com. Abgerufen am 2. Oktober 2010.
- ↑ a b Animal Health Australia: Australian Veterinary Emergency Plan (AUSVETPLAN); Disease Strategy Screw-worm fly, Version 3.0, 2007, (PDF-Dokument, 52.2 KB, englisch). S. 12. Abgerufen am 2. Oktober 2010.
- ↑ M. F. Chaudhury et al.: Screwworms, Cochliomyia hominivorax, reared for mass release do not carry and spread foot-and-mouth disease virus and classical swine fever virus, (PDF-Dokument, 162.9 KB, englisch). Journal of Insect Science: Vol. 8 | Article 62, veröffentlicht am 23. Oktober 2008. Abgerufen am 23. Oktober 2010.
- ↑ Weltorganisation für Tiergesundheit (OIE) Terrestrial Manual 2008: New World Screwworm (Cochliomyia hominivorax) and Old Worm Srewworm (Chrysomya bezziana) (PDF, 491,5 KB, englisch; inklusive Zeichnungen und Fotos). S. 267. Abgerufen am 15. Oktober 2010.
- ↑ Animal Health Australia: Australian Veterinary Emergency Plan (AUSVETPLAN); Disease Strategy Screw-worm fly, Version 3.0, 2007, (PDF-Dokument, 52.2 KB, englisch). S. 17. Abgerufen am 2. Oktober 2010.
- ↑ a b Luis Trombetta et al.: Case Report: Cutaneous myiasis due to Cochliomyia hominivorax in a drug user, (PDF-Dokument, 212 KB, englisch). Copyright © 2009 Trombetta et al.. S. 874-875. Abgerufen am 26. Oktober 2010
- ↑ a b c Weltorganisation für Tiergesundheit (OIE) Terrestrial Manual 2008: New World Screwworm (Cochliomyia hominivorax) and Old Worm Srewworm (Chrysomya bezziana) (PDF, 491,5 KB, englisch; inklusive Zeichnungen und Fotos). S. 266. Abgerufen am 15. Oktober 2010.
- ↑ a b c James E. Novy: Screwworm control and eradication in the southern United States of America (englisch). Artikel von der Ernährungs- und Landwirtschaftsorganisation (FAO). Abgerufen am 30. November 2010.
- ↑ M. Vargas-Terán et al.: Impact of Screwworm Eradication Programmes using the Sterile Insect Technique (PDF, 133.5 KB, englisch). Sterile Insect Technique. Principles and Practice in Area-Wide Integrated Pest Management, 629-650. © 2005 IAEA. Springer. Printed in the Netherlands. S. 639. Abgerufen am 24. November 2010.
- ↑ M. Vargas-Terán et al.: Impact of Screwworm Eradication Programmes using the Sterile Insect Technique (PDF, 133.5 KB, englisch). Sterile Insect Technique. Principles and Practice in Area-Wide Integrated Pest Management, 629-650. © 2005 IAEA. Springer. Printed in the Netherlands. S. 635. Abgerufen am 24. November 2010.
- ↑ Margret L. Allen und Phillip L. Scholl: Quality of Transgenic Laboratory Strains of Cochliomyia hominivorax (Diptera: Calliphoridae). Entomological Society of America, 2005. doi:10.1603/0022-0493-98.6.2301. S. 2305.
- ↑ Linda McGraw: Squeezing Out Screwworm, (englisch). April-Ausgabe 2001 vom Agricultural Research magazine. Abgerufen am 10 Dezember 2010.
- ↑ L. Mc Donagh et al.: Phylogenetic analysis of New World screwworm fly, Cochliomyia hominivorax, suggests genetic isolation of some Caribbean island populations following colonization from South America (englisch). 2009, The Royal Entomological Society. Abgerufen am 23. November 2010. doi:10.1111/j.1365-2915.2008.00777.x
- ↑ M. Vargas-Terán et al.: Impact of Screwworm Eradication Programmes using the Sterile Insect Technique (PDF, 133.5 KB, englisch). Sterile Insect Technique. Principles and Practice in Area-Wide Integrated Pest Management, 629-650. © 2005 IAEA. Springer. Printed in the Netherlands. S. 639. Abgerufen am 24. November 2010.
- ↑ Britisch journal of entomology and natural history, S. 160. In der Biodiversity Heritage Library. Abgerufen am 10. Oktober 2010.
- ↑ Screwworm (Cochliomyia hominivorax) – a now menace for Africa. In der Biodiversity Heritage Library. Abgerufen am 10. Oktober 2010.
- ↑ Ribeiro MC et al.: Oral myiasis in an elderly patient (englisch). In: Gerodontology, am 1 Oktober 2010. Abgerufen am 21. November 2010. doi:10.1111/j.1741-2358.2010.00432.x.
- ↑ A.C.P. Ferraz et al.: First Record of Human Myiasis Caused by Association of the Species Chrysomya megacephala (Diptera: Calliphoridae), Sarcophaga (Liopygia) ruficornis (Diptera: Sarcophagidae), and Musca domestica (Diptera: Muscidae) (englisch). Journal of Medical Entomology 47(3): S. 487, 2010. doi: 10.1603/ME09143.
- ↑ M. Vargas-Terán et al.: Impact of Screwworm Eradication Programmes using the Sterile Insect Technique (PDF, 133.5 KB, englisch). Sterile Insect Technique. Principles and Practice in Area-Wide Integrated Pest Management, 629-650. © 2005 IAEA. Springer. Printed in the Netherlands. S. 630. Abgerufen am 24. November 2010.
- ↑ Martin Grassberger: Fliegenmaden: Parasiten und Wundheiler. Biologiezentrum Linz/Austria. S. 524.
- ↑ Terry Whitworth: Key to the Genera and Species of Blow Flies (Diptera:calliphoridae) of North America of Mexico (PDF-Dokument, 27,2 MB, englisch; inklusive Zeichnungen). Proceedings of the Entomological Society of Washington, 2006. S. 710-713. Abgerufen am 14. November 2010.
- ↑ Terry Whitworth: Keys to the genera and species of blow flies (Diptera: Calliphoridae) of the West Indies and description of a new species of Lucilia Robineau-Desvoidy (PDF-Dokument, 2,1 MB, englisch; inklusive Zeichnungen und Fotos). Zootaxa 2663: 1–35 (2010). Abgerufen am 21. November 2010.
- ↑ Eintrag in uBio: Cochliomyia hominivorax, (englisch). Abgerufen am 2. Oktober 2010.
- ↑ Charles Coquerel: Notes sur des larves appartenant a une nouvelle èspece de diptère, (Cochliomyia hominivorax) (französisch). Annales de la sociéte entomologique de France, sechster Band, 1858.
- ↑ a b V. A. Dyck et al.: Sterile Insect Technique. Springer, 2005, ISBN 978-1-4020-4050-4 (Eingeschränkte Vorschau in der Google Buchsuche). S. 9.
- ↑ The World Food Prize: 1992: Knipling and Bushland. Abgerufen am 18: Januar 2011.
- ↑ P. K. Tubbs: Opinion 1399. Cochliomyia Townsend 1915 (Diptera, Calliphoridae): Conserved. (englisch). The Bulletin of zoological Nomenclature, Band 43, 1986. S. 154.

Dieser Artikel wurde am 4. Februar 2011 in dieser Version in die Liste der exzellenten Artikel aufgenommen. Kategorien:- Zweiflügler
- Wikipedia:Exzellent
Wikimedia Foundation.