- Diaminodinitroethylen
-
Strukturformel 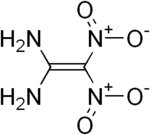
Allgemeines Name Diaminodinitroethylen Andere Namen - FOX-7
- DADE
- DADNE
- 1,1-Diamino-2,2-dinitroethen
Summenformel C2H4N4O4 CAS-Nummer 145250-81-3 Eigenschaften Molare Masse 148,08 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt ab 180 °C Zersetzung [1]
Löslichkeit unlöslich in Wasser, wenig löslich in Acetonitril und Cyclohexanon, löslich in DMSO, Dimethylformamid und N-Methylpyrrolidon[2]
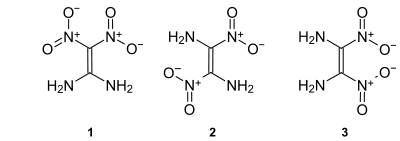
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Für Diaminodinitroethylen können drei isomere Strukturen formuliert werden. Von den möglichen Isomeren 1,1-Diamino-2,2-dinitroethylen (1), trans-1,2-Diamino-1,2-dinitroethylen (2) und cis-1,2-Diamino-1,2-dinitroethylen (3) ist bisher nur Ersteres synthetisch zugänglich.[1]
1,1-Diamino-2,2-dinitroethylen (FOX-7 oder DADE) ist eine energiereiche chemische Verbindung, die als Basis für unempfindliche und zugleich hochbrisante Sprengstoffe geeignet ist. Für die beiden 1,2-Diamino-1,2-dinitroethylen-Isomere gibt es bisher nur theoretische, quantenchemische Berechnungen.[4] Eine reale Herstellung und Charakterisierung der beiden Verbindungen steht noch aus.
Inhaltsverzeichnis
Geschichte
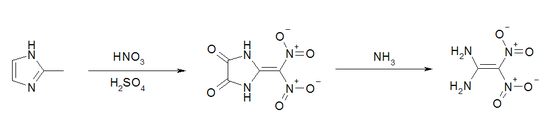
Die Synthese von 1,1-Diamino-2,2-dinitroethylen-Derivaten ist schon 1992 beschrieben worden. Ausgehend vom 1,1-Diiodo-2,2-dinitroethylen können durch den Umsatz mit Alkylaminen die entsprechenden 1,1-Dialkylamino-2,2-dinitroethylen-Verbindungen erhalten werden. Die Umsetzung mit Ammoniak ergab als Reaktionsprodukt das Ammoniumsalz von Cyanodinitromethan und somit nicht die Basisverbindung 1,1-Diamino-2,2-dinitroethylen.[5] 1,1-Diamino-2,2-dinitroethylen (FOX-7) wurde erstmals 1998 am FOI (Swedish Defence Research Agency) synthetisiert.[6] Mit einer Ausbeute < 10 % ist dieser Syntheseweg trotz des billigen Ausgangsstoffes 2-Methyl-imidazol kommerziell nicht sinnvoll.
Gewinnung und Darstellung
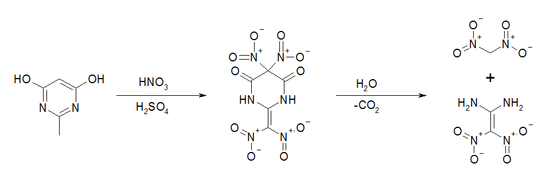
Die Herstellung von Diaminodinitroethylen wird nur in kleinen Ansatzgrößen durchgeführt, woraus ein relativ hoher Preis für die Verbindung resultiert. Eine optimierte Synthese mit einer Ausbeute >90 % geht vom 2,6-Dihydroxy-4-methylpyrimidin aus, welches durch eine Nitrierung in Nitriersäure zu einem Tetranitrozwischenprodukt umgesetzt wird. Das Zwischenprodukt wird danach hydrolytisch zur Zielverbindung, Dinitromethan und Kohlenstoffdioxid gespalten.[7] Die Ausgangsverbindung 2,6-Dihydroxy-4-methylpyrimidin ist durch die Cyclisierung von Acetamidinhydrochlorid mit Malonsäurediethylester in Gegenwart von Natrium und Ethanol zugänglich.[8]
Eine Umsatzkontrolle ist hier über eine flüssigchromatographische Auftrennung über spezielle Graphitsäulen möglich.[9]
Eigenschaften
Physikalische Eigenschaften
1,1-Diamino-2,2-dinitroethylen bildet gelbe Kristalle.[10] Die Verbindung zeigt ein polymorphes Verhalten. Bei Raumtemperatur liegt die α-Form vor, die sich beim Aufheizen bei 114 °C in die β-Form umwandelt. Dieser Phasenübergang ist reversibel. Eine weitere Umwandlung zur γ-Form wird bei 173 °C beobachtet. Die γ-Form ist metastabil und wandelt sich beim Abkühlen nur langsam und unvollständig in die Tieftemperaturform α um.[11] Für die Verbindung kann kein Schmelzpunkt gefunden werden, da DSC-Messungen schon ab 180 °C eine stark exotherme Zersetzungsreaktion anzeigen.[1] Einkristalluntersuchungen an aus NMP/Wasser kristallisierter α-Form ergaben eine monokline Kristallstruktur.[12] Die Anwesenheit von elektronendrückenden und elektronenziehenden Gruppen im Molekül führt zu veränderten Bindungslängen. Die Bindungslänge der Kohlenstoff-Kohlenstoff-Bindung liegt mit 145,6 pm zwischen den typischen Bindungslängen für eine Einfachbindung mit 154 pm bzw. Doppelbindung mit 134 pm.[13] Die Verbindung besitzt somit keinen reine Doppelbindungsstruktur. Es können zwei Resonanzstrukturen formuliert werden, wobei die polare Iminstruktur eher vorliegt.[14] Dies bestätigt sich auch an den beobachteten chemischen Eigenschaften wie z.B. bei elektrophilen Additionen.
Im Molekül existieren zwei starke intramolekulare Wasserstoffbrückenbindungen zwischen den NH- und NO-Funktionen. Daraus resultiert eine planare Grundstrukturdes Moleküls. Im Kristallgitter bildet sich auf Grund intermolekulerer Wasserstoffbrücken eine wellenförmige Schichtstruktur aus.[13] Die Kristallstruktur der β-Form ist orthorhombisch.[13] Die γ–Form zeigt ein monoklines Kristallgitter mit der Raumgruppe P21/n.[15]
Die Verbindung ist in Wasser praktisch unlöslich. In andern Lösungsmitteln wie Aceton, Ethylacetat oder Acetonitril ist die Löslichkeit mit <0,5 g/100 ml gering.[1] Bessere Löslichkeiten werden in N,N-Dimethylformamid mit 21 g/100 ml, in N-Methyl-2-pyrrolidon mit 32 g/100 ml und in Dimethylsulfoxid mit 45 g/100 ml beobachtet.[1]
Die molare Bildungsenthalpie beträgt ΔfH0 = −130 kJ/mol.[1] Die NMR-Spektren der Verbindung stellen sich recht einfach dar. Das 1H-NMR-Spektrum zeigt nur bei 8,77 ppm einen breiten Peak resultierend aus den NH-Protonen.[6] Im 13C-NMR-Spektrum findet man zwei Peaks bei 128,5 ppm für das nitrogruppensubstituierte Kohlenstoffatom sowie bei 158,8 ppm für das die Aminogruppen tragende Kohlenstoffatom.[6]
Thermische Stabilität und Explosionsfähigkeit
1,1-Diamino-2,2-dinitroethylen zeigt beim Erhitzen keinen Schmelzpunkt. Bei thermoanalytischen Messungen wird ab 180 °C eine zweistufige Zersetzung mit einer Zersetzungswärme von −1427 J/g beobachtet.[1] Der Zersetzungsmechanismus ist hinsichtlich auftretender Zwischenverbindungen theoretisch betrachtet worden und führt zu den finalen Produkten Kohlenmonoxid, Stickstoff und Wasser.[16]
Wichtige Explosionskennzahlen wie die Explosionswärme, die Detonationsgeschwindigkeit oder der Detonationsdruck wurden über verschiedene Rechenmethoden abgeschätzt bzw. mittels verschiedener Messmethoden experimentell bestimmt.[1][2][17] Die berechneten Werte liegen für die Explosionswärme zwischen 4442 J·g-1 und 4884 J·g-1, für die Detonationsgeschwindigkeit zwischen 8453 m·s-1 und 8869 m·s-1[1][2][17] und für den Detonationsdruck zwischen 29,3 GPa und 34,0 GPa.[1][17] Die experimentell bestimmten Werte betragen für die Detonationsenergie 4860 J·g-1, die Detonationsgeschwindigkeit zwischen 8325 m·s-1 und 8405 m·s-1 und dem Detonationsdruck 28,4 GPa.[17] Die Verbindung ist mit einer Schlagenergie von 11 - 40 Nm schlagempfindlich.[17][2] Die Schlagempfindlichkeit hängt von der Korngrößenverteilung des geprüften Materials ab.[17] Bis zu einer Reibkraft von 353 N konnte keine Reibempfindlichkeit festgestellt werden.[1][17]
Chemische Eigenschaften
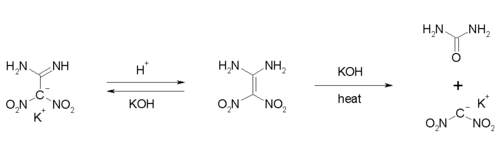
Die Verbindung besitzt acide Eigenschaften. In Gegenwart von Basen kann eine Deprotonierung erfolgen. Der pKa-Wert liegt bei etwa 10,6.[1] Bei einer Umsetzung mit Kalilauge bei niedrigen Temperaturen lässt sich das Kaliumsalz als weißer, kristalliner Feststoff isolieren. Das Erhitzen auf 70 °C mit Kalilauge führt zu einer basischen Hydrolyse, wobei das Kaliumsalz des Dinitromethans und Harnstoff gebildet werden.[1]
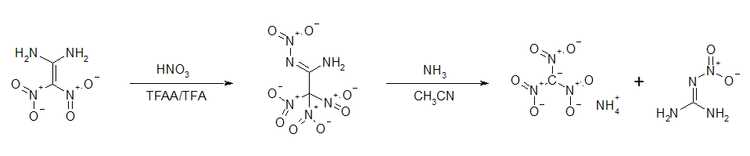
Auf Grund der hohen Polaritätsunterschiede im Molekül ergeben sich interessante Aspekte für chemische Umsetzungen. Die Verbindung kann in Gegenwart von Acetanhydrid oder Trifluoressigsäureanhydrid mittels Salpetersäure weiternitriert werden.[18] Die resultierende Tetranitroverbindung ist thermisch instabil. Eine Zersetzung ist schon ab Raumtemperatur relevant. Bei −20 °C kann die Verbindung etwa eine Woche gelagert werden.[18] Eine Zersetzung in ammoniakalischer Acetonitril-Lösung ergibt das Ammoniumsalz des Trinitromethans und Nitroguanidin.[18]
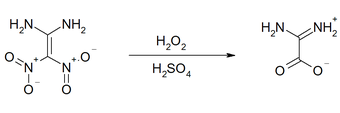
Die Halogenierung mit N-Bromsuccinimid oder N-Chlorsuccinimid erfolgt analog wie bei der Nitierung an das die geminalen Nitrogruppen tragende C-Atom und an eine Aminogruppe.[18] Die Oxydation mit 30 %igen Wasserstoffperoxid in Schwefelsäure oder mit Trifluoressigsäure führt unter Freisetzung von salpetriger Säure und Distickstofftrioxid zur Diaminoessigsäure.[14]
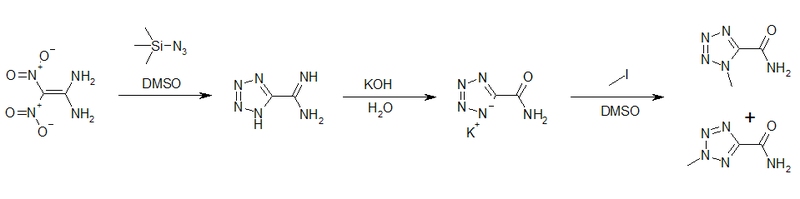
1,1-Diamino-2,2-dinitroethylen kann als Ausgangsstoff für die Herstellung von Tetrazolen genutzt werden. So gelingt durch die Umsetzung mit Trimethylsilylazid in DMSO mit der Bildung des 5-Amidinotetrazols die Tetrazolringbildung. Durch basische Hydrolyse kann das Kaliumsalz des Tetrazol-5-carbonsäureamids erhalten werden. Dessen Umsetzung mit Methyliodid ergibt die beiden Isomere 1-Methyltetrazol-5-carbonsäureamid und 2-Methyltetrazol-5-carbonsäureamid.[14]
Verwendung
Auf Grund seiner aciden Eigenschaften kann FOX-7 mit basischen und nucleophilen Stoffen umgesetzt werden, um weitere hochenergetische Substanzen herzustellen. So gibt die Umsetzung mit Guanidiniumchlorid in Gegenwart von Kalilauge das Guadidiniumsalz G(FOX-7).[19] Der höhere Stickstoffgehalt im Molekül bewirkt bei thermischen Zersetzungen eine höhere Gasentwicklung, was eine Anwendung in Treibsätzen ermöglicht.[19]
Einzelnachweise
- ↑ a b c d e f g h i j k l m n A.J. Bellamy: FOX-7 (1,1-Diamino-2,2-dinitroethene) in Struc. Bond. 125 (2007) 1-33. doi:10.1007/430_2006_054 (Structure & Bonding, Vol. 125: High energy density materials, Ed. T.M. Klapötke. Springer 2007, doi:10.1007/978-3-540-72202-1 ISBN 978-3-540-72201-4)
- ↑ a b c d e Köhler, J.; Meyer, R.; Homburg, A.: Explosivstoffe, zehnte, vollständig überarbeitete Auflage,, Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ P. Politzer, M.C. Concha, M.E. Grice, J.S. Murray, P. Lane, D. Habibollazadeh: Computational investigation of the structures and relative stabilities of amino/nitro derivatives of ethylene in J. Mol. Struct. 452 (1998) 75–83, doi:10.1016/S0166-1280(98)00136-5.
- ↑ K. Baum, S.S. Bigelow, Nguyen Nghi Van, T.G. Archibald, R. Gilardi, J.L. Flippen-Anderson, C. George: Synthesis and reactions of 1,1-diiododinitroethylene in J. Org. Chem. 57 (1992) 235–241, doi:10.1021/jo00027a042.
- ↑ a b c N.V. Latypov, J. Bemm, A. Langlet, U. Wellmar, U. Bemm: Synthesis and reactions of 1,1-diamino-2,2-dinitroethylene in Tetrahedron 54 (1998) 11525–11536, doi:10.1016/S0040-4020(98)00673-5.
- ↑ N.V. Latypov, M. Johansson, E. Holmgren, E.V. Sizova, V.V. Sizov, A.J. Bellamy: On the Synthesis of 1,1-Diamino-2,2-dinitroethene (FOX-7) by Nitration of 4,6-Dihydroxy-2-methylpyrimidine in Org. Process Res. Dev. 11 (2007) 56–59, doi:10.1021/op068010t.
- ↑ M. Anniyappan, M.B. Talawar, G.M. Gore, S. Venugopalan, B.R. Gandhe: Synthesis, characterization and thermolysis of 1,1-diamino-2,2-dinitroethylene (FOX-7) and its salts in J. Hazard. Mat. B137 (2006) 812–819, doi:10.1016/j.jhazmat.2006.03.034.
- ↑ B. Buszewski, M. Michel, S. Cudzilo, Z. Chylek: High performance liquid chromatography of 1,1-diamino-2,2-dinitroethene and some intermediate products of its synthesis in J. Hazard. Mat. 164 (2009) 1051–1058, doi:10.1016/j.jhazmat.2008.09.018.
- ↑ H. Cai, Y. Shu, H. Huang, B. Cheng, J. Li: Study on Reactions of 2-(Dinitromethylene)-4,5-imidazolidinedione in J. Org. Chem. 69 (2004) 4369–4374, doi:10.1021/jo030395f.
- ↑ P.B. Kampa, M. Herrmann: Temperature resolved X-ray diffraction for the investigation of the phase transitions of FOX-7 in Part. Part. Syst. Char. 22 (2005) 418–422, doi:10.1002/ppsc.200501006.
- ↑ U. Bemm, H. Östmark: 1,1-Diamino-2,2-dinitroethylene. A novel energetic material with infinite layers in two dimensions in Acta Cryst. C 54 (1998) 1997–1999, doi:10.1107/S0108270198007987.
- ↑ a b c J. Evers, T. M. Klapötke, P. Mayer, G. Oehlinger, J. Welch: α- and β-FOX-7, Polymorphs of a High Energy Density Material, Studied by X-ray Single Crystal and Powder Investigations in the Temperature Range from 200 to 423 K in Inorg. Chem. 45 (2006) 4996–5007, doi:10.1021/ic052150m.
- ↑ a b c G. Herve; G. Jacob: Novel illustrations of the specific reactivity of 1,1-diamono-2,2-dinitroethene (DADNE) leading to new unexpected compounds in Tetrahedron 63 (2007) 953-959, doi:10.1016/j.tet.2006.11.031.
- ↑ M.-J. Crawford, J. Evers, M. Göbel, T.M. Klapötke, M. Mayer, G. Oehlinger, J.M. Welch: γ–FOX-7: Structure of a high energy density material immediately prior to decomposition in Propellants, Explosives, Pyrotechnics 32 (2007) 478–495, doi:10.1002/prep.200700240.
- ↑ A. Gindulyte, L. Massa, L. Huang, J. Karle: Proposed Mechanism of 1,1-Diamino-Dinitroethylene Decomposition: A Density Functional Theory Study in J. Phys. Chem. A 103 (1999) 11045-11051, doi:10.1021/jp991794a.
- ↑ a b c d e f g W.A. Trzcinski, S. Cudzilo, Z. Chylek, L. Szymanczyk: Detonation properties of 1,1-diamino-2,2-dinitroethene (DADNE) in J. Hazard. Mat. 157 (2008) 605–612, doi:10.1016/j.jhazmat.2008.01.026.
- ↑ a b c d G. Herve; G. Jacob; N. Latypov: The reactivity of 1,1-diamino-2,2-dinitroethylene (FOX-7) in Tetrahedron 61(2005) 6743–6748, doi:10.1026/j.tet.2005.05.010.
- ↑ a b Kangzhen Xu, Jirong Songa, Fengqi Zhao, Haixia Ma, Hongxu Gao, Chunran Changa Yinghui, Rena Rongzu Hu: Thermal behaviour, specific heat capacity and adiabatic time-to-explosion of G(FOX-7) in J. Hazard. Mat. 158 (2008) 333–339, doi:10.1016/j.jhazmat.2008.01.077.
Wikimedia Foundation.