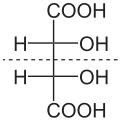
- Tartaric acid
-
Strukturformel 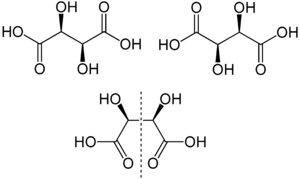
D-(–)-Form (links oben) und L-(+)-Form (rechts oben) sowie meso-Form (unten) mit intramolekularer Spiegelebene (---)
Allgemeines Name Weinsäure Andere Namen - 2,3-Dihydroxybernsteinsäure
- 2,3-Dihydroxybutandisäure
- Threarsäure
Summenformel C4H6O6 CAS-Nummer 87-69-4 [L-(+)-Form]
147-71-7 [D-(–)-Form]
147-73-9 (meso-Form)
133-37-9 [DL-(±)-Form]Eigenschaften Molare Masse 150,09 g·mol−1 Aggregatzustand fest
Dichte 1,7598 g·cm−3 (optisch aktive Formen)[1]
1,666 g·cm−3 (meso-Form)[1]
1,788 g·cm−3(Racemat)[1]Schmelzpunkt 168–170 °C (optisch aktive Formen)[2]
140 °C (meso-Form)[2]
206 °C (Racemat)[2]Löslichkeit gut löslich in Wasser, Methanol, Ethanol
unlöslich in ChloroformSicherheitshinweise Gefahrstoffkennzeichnung [3] 
Reizend (Xi) R- und S-Sätze R: 36 S: 24/25 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Weinsäure, auch als 2,3-Dihydroxybernsteinsäure oder 2,3-Dihydroxybutandisäure, im Lateinischen als acidum tartaricum und im Englischen mit tartaric acid, bezeichnet, ist eine α-Hydroxycarbonsäure. Ihre Salze und Ester heißen Tartrate. L-(+)-Weinsäure tritt beispielsweise in Weintrauben auf und ist in der EU als Lebensmittelzusatzstoff E 334 zugelassen. In Deutschland wird auch der Gesamtsäuregehalt von Weinen – berechnet als Weinsäure – angegeben, obgleich im Wein noch eine Anzahl anderer Säuren, vor allem Äpfelsäure, vorkommt.
Durch intermolekulare Wasserabspaltung entsteht die polymere Metaweinsäure, die unter der Bezeichnung E 353 ebenfalls als Lebensmittelzusatzstoff verwendet wird.
Inhaltsverzeichnis
Geschichte
Vor der Entdeckung der Weinsäure wurde ihr Salz Kaliumhydrogentartrat, der Weinstein, für eine Säure gehalten, da er durch seine schlechte Wasserlöslichkeit im Wein leicht ausfällt, und daher für die frühen Chemiker einfacher erkennbar als die gut lösliche Weinsäure war. 1732 wurde Weinstein daher von Boerhaave als feste Säure angeführt. 1764 wurde von Markgraf ein Alkalimetall im Weinstein nachgewiesen, woraufhin er diesen mit Calcium zu Calciumtartrat zersetzte, das er jedoch nicht genauer untersuchte. Erst 1769 zersetzte Scheele, der gemeinhin als Entdecker der Weinsäure gilt, Calciumtartrat mit Schwefelsäure und bezeichnete die abgeschiedene kristalline Säure als „Weinsteinsäure“. Der Weinstein wurde kurz darauf als saures Kalisalz dieser Säure erkannt. 1819 wurde die Traubensäure vom Fabrikanten Kestner als Nebenprodukt der Weinsäureherstellung entdeckt. Die Isomerie der Weinsäure wurde 1826 von Gay-Lussac festgestellt und von Pasteur detaillierter untersucht, wobei damals nur die optisch aktive „rechtsdrehende Weinsäure“, also die L-Weinsäure und die Traubensäure, als „racemische Säure“ bezeichnet, bekannt waren. Pasteur stellte das Natriumammoniumsalz dieser Säuren her und entdeckte dabei die Chiralität. Mit Lupe und Pinzette trennte Pasteur die Kristalle in linksdrehende und rechtsdrehende Exemplare.
Die so aus dem Racemat gewonnenen enantiomeren Natriumammoniumtartrate brachte Pasteur wieder in Lösung und untersuchte ihren Drehwert im Polarimeter. Dabei stellte er fest, dass beide Lösungen der aus der optisch inaktiven Traubensäure gewonnenen Salze optisch aktiv waren und dieselbe spezifische Drehung wie aus L-Weinsäure gewonnenes Natriumammoniumsalz aufwiesen, jedoch mit entgegengesetztem Vorzeichen. Daraus folgerte Pasteur, dass Traubensäure kein Reinstoff, sondern ein gleichteiliges Gemisch aus rechts- und linksdrehender Weinsäure, also ein Racemat ist. Der Begriff Racemat für eine Mischung zweier Enantiomere zu gleichen Teilen leitet sich aus der lateinischen Bezeichnung für Traubensäure (acidum racemicum) ab.
Die Deutungen von Pasteurs Experiment erschöpfen sich allerdings nicht darin, dass Traubensäure ein Racemat aus L- und D-Weinsäure ist. Zwar erkannte Pasteur, dass optische Aktivität eine Folge einer Eigenschaft des Weinsäuremoleküls selbst sein musste. Doch erst 1874 konnten Le Bel und van 't Hoff, der in der Folge zum ersten Chemie-Nobelpreisträger wurde, dies unabhängig voneinander anhand der Molekülstruktur erklären. Im Wissen, „dass vier unterschiedliche Objekte auf zwei verschiedene Weisen in den Ecken eines Tetraeders angeordnet werden können, und dass sich diese Anordnungen zueinander wie Bild und Spiegelbild verhalten, die nicht zur Deckung zu bringen sind“[4] stellten sie die Hypothese auf, dass die vier an ein Kohlenstoffatom gebundenen Reste tetraedisch angeordnet sind. Davon ausgehend vermuteten sie, dass optisch aktive Moleküle mindestens ein Kohlenstoffatom mit vier verschiedenen Resten, also ein asymmetrisches Kohlenstoffatom, enthalten. „Optisch inaktive organische Substanzen enthalten demnach entweder kein asymmetrisches Kohlenstoffatom oder sie sind Gemische aus gleichen Teilen zweier Enantiomerer.“[4]
Van’t Hoff und Le Bel erkannten damit zum einen die tetraedrische Geometrie des Kohlenstoffatoms, und gaben zum anderen eine schlüssige Erklärung für die optische Aktivität organischer Stoffe. Nur die meso-Verbindungen ließen sich durch ihre Definition nicht abdecken, erst sehr viel später wurde die Struktur der meso-Weinsäure entdeckt. Lange unbekannt blieb auch, welches Enantiomer der Weinsäure nun die Polarisationsebene des Lichts nach rechts, und welches sie nach links dreht. Erst 1951 konnte Bijvoet mit einer speziellen Röntgenmethode anhand des Natriumrubidiumtartrats klären, dass es sich bei L-Weinsäure um das rechtsdrehende (+)-Enantiomer und bei D-Weinsäure um das linksdrehende (−)-Enantiomer handelt. Durch Umwandlung von Weinsäure in andere chemische Verbindungen konnte dies ebenfalls für viele andere Enantiomerenpaare geklärt werden.
Vorkommen
Besonders die L-(+)-Weinsäure sowie deren Calcium-, Kalium- und Magnesiumsalze finden sich reichlich in den Reben, Trauben und Blättern des Weinstocks sowie im Löwenzahn, in Zuckerrüben, in Tamarinden, in unreifen Vogelbeeren, in den Samen des Spindelbaums, in den Blättern der Agaven, in schwarzem Pfeffer, in der Ananas und in vielen weiteren Früchten. Bei der Weinherstellung scheiden sich schwerlösliche Salze der Weinsäure als Weinstein am Boden von Weinfässern oder Weinflaschen ab. Die D-(−)-Weinsäure, auch unnatürliche Weinsäure genannt, findet sich nur in den Blättern des westafrikanischen Baumes Bankinia reticulata. Die meso-Form existiert in der Natur nicht.
Herstellung
Die Herstellung von Weinsäure aus Weinstein gelingt nach der Umwandlung in Calciumtartrat. Aus diesem kann mit Schwefelsäure die Weinsäure freigesetzt werden und es entsteht Gips als Nebenprodukt. Die meso-Form lässt sich durch Oxidation von Fumarsäure oder Maleinsäureanhydrid mit Wasserstoffperoxid, Kaliumpermanganat oder anderen Persäuren herstellen.
Reine D-(−)-Weinsäure kann durch den Abbau mit Penicillium glaucum aus dem Racemat erhalten werden. Das Penicillium glaucum baut nämlich nur die L(+)-Weinsäure ab.
Eigenschaften
Strukturformeln der Weinsäuren in der Fischer-Projektion:
Die zwei Kohlenstoffatome, die die beiden Hydroxylgruppen im Molekül der Weinsäure tragen, sind Stereozentren. Je nach der Konfiguration dieser Zentren liegt D-(+)-Weinsäure [Synonym: (2S,3S)-Weinsäure], L-(−)-Weinsäure [Synonym: (2R,3R)-Weinsäure] oder die optisch inaktive meso-Weinsäure vor. In der Natur kommt meist die rechtsdrehende L-(+)-Form vor. Die beiden Enantiomeren der Weinsäure [L-(+)-Weinsäure und D-(−)-Weinsäure] unterscheiden sich nicht in ihren physikalischen und chemischen Eigenschaften nur im Drehwert gegen linear polarisiertes Licht Der Drehwert α beträgt bei L-(+)-Weinsäure +12,7°, bei D-(−)-Weinsäure -12,7 °[5] bei gleichen Meßbedingungen. Der Drehwert der meso-Weinsäure beträgt, wie bei allen meso-Verbindungen, ±O°. Die physiologischen Eigenschaften aller drei Stereoisomerer der Weinsäure sind verschieden.
Die Alkalisalze der Weinsäure vermögen in alkalischer Lösung Kupfer(II)-Ionen zu komplexieren (zu binden) und dadurch in Lösung zu halten (Fehlingsche Lösung). Als zweibasische, verhältnismäßig starke Säure können auch Hydrogentartrate gebildet werden.
Eine Mischung gleicher Mengen von L-(+)- und D-(−)-Weinsäure (Racemat) wird als Traubensäure bezeichnet, Schmelzpunkt 205–206 °C. Diese Mischung wird manchmal auch racemische Weinsäure genannt. Eine Mischung der drei Stereoisomeren der Weinsäure mit variablen Anteilen L-(+)-, D-(−)- und meso-Weinsäure wird als Isomerengemisch der Weinsäure gehandelt.
Verwendung
In größerem Maßstab findet nur die L-Weinsäure Verwendung, da sie einerseits das Produkt der meisten Syntheseverfahren von Weinsäure darstellt, andererseits Traubensäure in bestimmten Dosen toxisch wirken kann, was ihre Verwendung als Lebensmittelzusatzstoff verhindert. 50 % der produzierten L(+)-Weinsäure gehen in die Lebensmittelindustrie und Pharmazie, die andere Hälfte in technische Anwendungsgebiete.
Verwendung als Lebensmittelzusatzstoff
Der offensichtlichste Anwendungsbereich der Weinsäure liegt in ihrer Verwendung als Lebensmittelzusatzstoff. Die in diesem Bereich als E 334 bezeichnete L-Weinsäure findet sich nicht nur natürlicherweise in vielen Lebensmitteln, sondern wird aufgrund ihrer geschmacklichen und konservierenden Eigenschaften auch vielen Lebensmitteln künstlich zugesetzt. Weinsäure wird bei der Bereitung von Speiseeis, Kunsthonig, Obst, Limonaden und Erfrischungsgetränken, Gelee, Weingummis und Konditorwaren, und bei der Säuerung säurearmer Weine verwendet.
Metaweinsäure wird hauptsächlich zur Weinsteinstabilisierung verwendet; als Schutzkolloid verhindert sie die Kristallisation von Weinstein im Wein.[6]
Technische Verwendungsmöglichkeiten
Weiterhin findet Weinsäure auch in vielen technischen Bereichen Verwendung, unter anderem beim Griffigmachen und Glätten von Seide, auch im Zement und im Gips ist sie enthalten, da sie deren Abbindeverhalten verzögert und damit die Bearbeitungs- und Verformbarkeitszeit verlängert. Moltifill® innen besteht aus Gips, dem Weinsäure als Abbindeverzögerer zugesetzt ist. Wichtig ist die Fähigkeit der Weinsäure, mit Metallen Komplexe zu bilden: Bei diesen Komplexen wird das Metall-Kation durch die Weinsäure fester gebunden, als bei den meisten anderen organischen Säuren. Dadurch ergeben sich zahlreiche Anwendungsmöglichkeiten. Kaliumnatriumtartrat wird beispielsweise als Komplexbildner in Fehlingscher Lösung eingesetzt, Weinsäure zur Oberflächenbehandlung von Kupfer- und Messingartikeln, sie kann ebenfalls zur Reinigung schwermetallkontaminierter Böden verwendet werden, da sie hier giftige Schwermetalle bindet, aber selbst biologisch abbaubar ist. Weiterhin dient sie als Reduktionsmittel und zur Racematspaltung organischer Basen. In der modernen organischen Synthese sind LiAlH4 – Weinsäurederivate wie TADDOL wichtige chirale Reagenzien oder Katalysatoren zur enantioselektiven Reduktion von Ketonen sowie anderen stereoselektiver Synthesen.[7]
Einzelnachweise
- ↑ a b c K. Peter C. Vollhardt: Organische Chemie, VCH Weinheim, 1. korrigierter Nachdruck der 1. Auflage, 1990, S.166, ISBN 3-527-26912-6.
- ↑ a b c The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1557–1558, ISBN 978-0-911910-00-1.
- ↑ Sicherheitsdatenblatt (Carl Roth D-(−)-Weins.)
- ↑ a b H. Hart, L.E. Crane, D.J. Hart: Organische Chemie. WILEY-VCH Verlag, Weinheim, 2002, S. 193
- ↑ E. Breitmaier, G. Jung: Organische Chemie, Thieme Verlag, 4. Auflage, 2001
- ↑ Görtges, S.: Metaweinsäure zur Weinsteinstabilisierung. In: Schweiz. Z. Obst-Weinbau, 2002, 1, S. 8–9. PDF, 43 kB
- ↑ (a) D. Seebach, A. K. Beck und A. Heckel: TADDOLs, their derivatives, and TADDOL analogues: Versatile chiral auxiliaries, Angewandte Chemie International Edition 40 (2001) 92-138.(b) M. Aoki und D. Seebach: Preparation of TADOOH, a hydroperoxide from TADDOL, and use in highly enantioface- and enantiomer-differentiating oxidations, Helvetica Chimica Acta 84 (2001) 187-207.
Siehe auch
Weblinks
Wikimedia Foundation.