- Organische Säuren
-
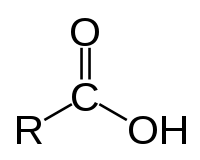
Organische Säuren sind organische chemische Verbindungen, die über eine funktionelle Gruppe verfügen, die mit Wasser oder anderen protonierbaren Lösungsmitteln eine Gleichgewichtsreaktion eingeht. Dabei entsteht im Fall von Wasser das Oxoniumion H3O+, das die Lösung sauer werden lässt, während die Säure ein Proton an das Lösungsmittel Wasser abgibt:
Meist wird der Begriff Organische Säure mit Carbonsäure gleichgesetzt, es gibt jedoch auch organische Säuren, die keine Carboxygruppe tragen. Als Maß für die Säurestärke gilt die Säurekonstante (bzw. der pKs-Wert) eines Stoffes. Diese Werte geben an, inwieweit eine Säure bei der Gleichgewichtsreaktion mit Wasser protolysiert, d. h. wie weit die Gleichung (1) auf die rechte Seite verschoben ist. Dabei gilt: je kleiner der pKs-Wert ist, desto größer ist die Säurestärke des Stoffes.
Inhaltsverzeichnis
Gruppen organischer Säuren
Mitglieder der Gruppe der Carbonsäuren besitzen eine oder mehrere Carboxygruppen (–COOH), die sauer reagieren. Es können aber auch andere Gruppen wie die Hydroxygruppe (–OH), Sulfanylgruppe –SH (Thiole) oder –SO3H (Sulfonsäuren) vorhanden sein, die Protonen abspalten können. Eine saure Reaktion einer Verbindung wird erleichtert, wenn das resultierende Anion durch Mesomerie stabilisiert wird. So hat Ascorbinsäure (Vitamin C) keine Carboxygruppe, wirkt aber durch seine Enolgruppen sauer. Auch die Acidität von Phenol und Acetessigester sind auf die Stabilisierung der Anionen zurückzuführen.
Carbonsäuren
Carbonsäuren haben in der Regel einen deutlich saureren Charakter als beispielsweise Alkohole. Die Säurestärke steigt, wenn in der Nähe der Carboxygruppe (in α-, β- oder γ-Position) weitere elektronenziehende Gruppen vorhanden sind. Trifluoressigsäure oder Trichloressigsäure wirken stärker sauer als Milchsäure, die wiederum eine stärkere Säure als Essigsäure ist. Carbonsäuren mit 1–3 C-Atomen riechen stechend, sind ätzend für die menschliche Haut und sehr gut wasserlöslich. Carbonsäuren mit 4–9 C-Atomen riechen stark ranzig, wie das bekannteste Beispiel Buttersäure zeigt. Carbonsäuren mit 10 und mehr C-Atomen sind geruchlos und wachsartig fest (Fettsäuren).
Alkohole, Phenole, Enole
Unsubstituierte Alkohole besitzen eine sehr geringe Acidität, während Phenole und Naphthole durch die Mesomeriestabilisierung des entstehenden Phenolats leichter deprotonierbar sind: Phenol ist mit dem pKs-Wert von 9,9 um einen Faktor 100 stärker sauer als Alkanole wie etwa Ethanol (mit einem pKs von 16). Substituenten an den Verbindungen, welche einen -I- oder -M-Effekt ausüben, erhöhen ebenfalls die Säurestärke, indem sie die negative Ladung des entstehenden Anions stabilisieren.[1] Dies führt zu stark sauren Verbindungen wie Pikrinsäure (-M-Effekt) oder Pentachlorphenol (-I-Effekt). Bei einigen Substituenten wie Halogenatomen oder Nitrogruppen treten beide Effekte - teils sogar in unterschiedlicher Richtung - auf. Das Endiol Ascorbinsäure besitzt einen pKs von 4,2 und ist damit stärker sauer als Essigsäure (pKs 4,8).
Thiole
Thiole besitzen eine höhere Acidität als die entsprechenden Alkohole, die entstehenden Thiolate daher stabiler als die Alkololate. Dies zeigt der Vergleich der analogen Verbindungen Ethanol (pKs 16) und Ethanthiol (auch Ethylmercaptan, pKs 12).
Schwefelsäureester und Sulfonsäuren
Die Monoester der Schwefelsäure und die Sulfonsäuren besitzen eine der Schwefelsäure vergleichbare Säurestärke. Der +I-Effekt langer Alkylketten stabilisiert dabei die entstehenden Anionen. Die p-Toluolsulfonsäure etwa besitzt einen pKs von 0,7, der Ester des Laurylalkohols mit der Schwefelsäure, Laurylsulfat den Wert -0,09.
Phosphorsäureester und Phosphonsäuren
Auch die Mono- und Diester der Phosphorsäure (Phosphorsäureester), sowie die organischen Derivate der Phosphonsäure (allgemein Phosphonsäuren genannt) reagieren ähnlich, wie ihre anorganischen Verbindungen als starke Säuren.
CH- und NH-acide Verbindungen
Auch Kohlenwasserstoffe ohne Carboxy-, Hydroxy- oder Sulfanylgruppe können aufgrund ihrer CH- oder NH-Acidität als Säuren agieren. Hierbei ist das Vorkommen von Mehrfachbindungen und benachbarten funktionellen Gruppen oder Heteroatomen die Ursache der Acidität. Die bekannteste CH-acide Verbindung ist das Ethin (Acetylen), das aufgrund der Dreifachbindung einen pKs-Wert von 25 aufweist (Ethan: 50). Weitere Beispiele sind das Nitroethan (pKs 8,6) und das Nitrocyclopentadien, das stärker sauer ist (pKs 3,3) als Ameisensäure (3,75). Bei der Deprotonierung entsteht aus dem Nitrocyclopentadien ein Derivat des aromatischen Cyclopentadienyl-Anions. Auch hier bestimmen mesomere Effekte zusammen mit induktiven Effekten die Acidität der Verbindungen. Acetonitril ist ein weiteres Beispiel für eine einfache CH-acide Verbindung. Bekannte NH-acide Verbindungen sind Phthalimid (pKs = 8,3[2]) und Sulfonylharnstoffe (Tolbutamid hat einen pKs von 5,16[3]).
Übersicht
-
Stoffklasse acide funktionelle Gruppe Beispiel pKs-Wert bei 25 °C Carbonsäuren Carboxygruppe: R–COOH 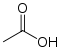 Essigsäure
Essigsäure4,8 Substitutierte
CarbonsäurenCarboxygruppe: R–CHxXy–COOH 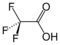 Trifluoressigsäure
Trifluoressigsäure0,23 [4] aromatische
CarbonsäurenCarboxygruppe: Ar–COOH 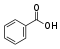 Benzoesäure
Benzoesäure4,2 [4] Alkohole Hydroxygruppe: R–OH 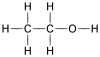 Ethanol
Ethanol16 Phenole Hydroxygruppe : Ar–OH
(Ar=Aryl)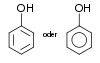 Phenol
Phenol9,9 [5] Naphthole Hydroxygruppe : Ar–OH
(Ar=Aryl)α-Naphthol 3,7 [5] Substituierte Phenole
(Substituenten mit -I-Effekt
wie Halogene, Nitrogruppe)Hydroxygruppe : O2N–Ar–OH
(Ar=Aryl)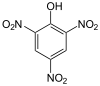 Pikrinsäure
Pikrinsäure0,4 [5] Enole Hydroxygruppe (Enol) : C=C–OH 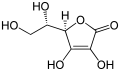 Ascorbinsäure
Ascorbinsäure4,2 Thiole R–SH  Ethanthiol (C2H5–SH)
Ethanthiol (C2H5–SH)12 [6] Schwefelsäureester
(Sulfate)R–O–SO3H Schwefelsäuredodecylester −0,09
Wert für die Säure[7]Sulfonsäuren
(Alkylsulfonsäuren)R–SO3H H3C–SO3H Methansulfonsäure −0,6 [4] Sulfonsäuren
(Arensulfonsäuren)R–Ar–SO3H
(Ar=Aryl)H3C–C6H4–SO3H p-Toluolsulfonsäure ~ 0,7 [8] Phosphate
(= Phosphorsäureester)R–O–PO(OH)2 Adenosinmonophosphat 3,3 [4] org. Phosphonsäuren
(siehe Phosphonate)R–PO(OH)2 H3C–PO(OH)2 Methylphosphonsäure 2,35 CH-acide Verbindungen
AlkineH–C  C–R
C–R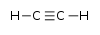 Ethin
Ethin25 CH-acide Verbindungen
NitroalkaneO2N–CRR'–H 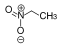 Nitroethan
Nitroethan8,6 [9] CH-acide Verbindungen
β-DicarbonyleRC=OCH2C=OR'  Acetylaceton
Acetylaceton≈ 9 [10] NH-acide Verbindungen
ImideR–(CO)2N–H  Phthalimid
Phthalimid8,3[2] Anorganische Säuren zum Vergleich Mineralsäuren HO–SO2–OH  Schwefelsäure
Schwefelsäure−3
Einzelnachweise
- ↑ Alfons Hädener, Heinz Kaufmann: Grundlagen der organischen Chemie. Springer, 2006, ISBN 9783764370404
- ↑ a b Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, Seite 521, ISBN 3-7776-0406-2.
- ↑ Organische Säuren bei ChemIDplus.
- ↑ a b c d pKa Data Compiled by R. Williams.
- ↑ a b c C. Lüders: Entwicklung von Analysenverfahren und Referenzmaterialien für die Bestimmung von Phenolen in umweltrelevanten Matrices, Dissertation an der Humboldt-Universität zu Berlin, 12. Oktober 1999
- ↑ ChemieOnline Buchstabe E (Ethylmercaptan)
- ↑ P.H. Stahl, C.G. Wermuth: Handbook of Pharmaceutical Salts: Properties, Selection, and Use, 2002, Helvetica Chimica Acta, ISBN 3906390268
- ↑ ChemieOnline Buchstabe P
- ↑ ChemieOnline Buchstabe N
- ↑ ChemieOnline Buchstabe A
Kategorien:- Organische Säure
- Stoffgruppe
- Kohlenstoffverbindung
- Wasserstoffverbindung
- Acidität und Basizität
Wikimedia Foundation.