- Berberin
-
Strukturformel 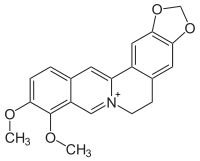
Allgemeines Name Berberin Andere Namen - 5,6-Dihydro-9,10-dimethoxybenzo[g]- 1,3-benzodioxolo[5,6-a]quinolizinium-Chlorid
- Natural Yellow 18
Summenformel C20H18ClNO4 CAS-Nummer 633-66-9 (als Hemisulfat) PubChem 12457 Kurzbeschreibung dunkelgelber Feststoff (als Hemisulfat)[1]
Eigenschaften Molare Masse 371,81 g·mol−1 Aggregatzustand fest
Schmelzpunkt Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Achtung
H- und P-Sätze H: 302-312-332 EUH: keine EUH-Sätze P: 280 [1] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) als Hemisulfat
R- und S-Sätze R: 20-21-22 S: 36 LD50 >15 g·kg−1 [3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Berberin ist ein Alkaloid aus der Gruppe der Isochinolinalkaloide. Es kommt unter anderem in den Pflanzen Berberitze (Berberis vulgaris), die dem Alkaloid den Namen gab, der Orangenwurzel (Hydrastis canadensis) und Coptis chinensis, im Wesentlichen in den Wurzeln, im Rhizom, im Stamm und in der Rinde, vor. Berberin ist kräftig gelb gefärbt, weshalb man früher die Berberitze zum Färben von Wolle und Leder benutzte. Noch heute wird in Nord-Indien Wolle mit Berberin gelb gefärbt. Unter UV-Licht fluoresziert Berberin kräftig gelb.[4] Es wird daher auch zur Anfärbung von Heparin in Mastzellen verwendet.[5] Als natürlicher Farbstoff hat Berberin den Colour Index CI 75160. Es ist der einzige bekannte natürliche Farbstoff mit quartärer Stickstoffbase.
Inhaltsverzeichnis
Vorkommen
Husemann[6] schreibt über das Berberin:
„Das Berberin ist eines der wenigen Alkaloide, die nicht nur über verschiedene Gattungen der nämlichen Pflanzenfamilie verbreitet sind, sondern selbst in Pflanzen der verschiedensten Familien vorkommen. Es findet sich in der Jamaikanischen Wurmrinde, der Rinde von Geoffroya jamaicensis Mur. oder Andria inermis Kuth. (Fam. Casealpineae) nach Gastell, in der Rinde von Xanthoxylum clava Herculis L. (Fam. Xanthoxyleae) nach Perrins, in Podophyllum peltatum. Leontice thalictroides und Jeffersonia diphylla (Fam. Papaveraceae) nach F. F. Mayer (Amer. Journ. Pharm. XXXV. 97), in der westafrikanischen Abeocouta-Rinde von Coelocline polycarpa De C. (Fam. Anonaceae) nach Stenhouse, in den Wurzeln von Hydrastis canadensis L., Xanthorhiza Apiifolia Herit. und Coptis Teeta (Fam. Ranunculaceae) nach Mahla und Perrins in der Colombowurzel, der Wurzel von Cocculus palmatus De C. und in dem Ceylonischen Colomboholz, dem Holz von Coscinium fenestratum Colebr. (Fam. Menispermeae) nach Bödeker und Perrins, in Wurzel, Rinde, Blüten, unreifen Beeren und Blättern von Berberis vulgaris L., sowie auch in den indischen und mexikanischen Berberis-Arten (Fam. Berberidaceae) nach Buchner, Polex, Ferrein, Solley, Wittstein und Anderen, nach Perrins endlich auch in der St. Johannswurzel vom Rio grande, in der Rinde des Pachnelo-Baumes von Bogota und in einem von den Einheimischen Woodunpar genannten gelben Farbholz aus Oberassam.“
Entdeckung des Berberins
Nach Husemann[6] isolierte Hüttenschmidt 1824 erstmals aus der Jamaikanischen Wurmrinde Jamaicin. Berberin wurde 1835 von dem deutschen Pharmakologen Johann Andreas Buchner erstmals aus der Wurzelrinde der Gewöhnlichen Berberitze (Berberis vulgaris L.) isoliert. Gastell allerdings erkannte 1866, dass Jamaicin mit Berberin identisch ist.
Physiologische Wirkung
Für eine Reihe medizinischer Anwendungen scheint Berberin ein weitergehendes pharmakologisches Potential zu besitzen. Berberin und seine Verbindungen Berberinsulfat und -phosphat wurden vielfach im Orient als intestinales Antiseptikum in oraler Form angewendet. Andere systemische Effekte, wie blutdrucksenkend, die Bilirubin-Sekretion steigernd, inotrop, sedativ, antiinflammatorisch (entzündungshemmend)[7], dilatierende Wirkung auf Koronararterien, antikoagulatorisch, mäßige Senkung der Herzfrequenz, Beschleunigung der Reparatur der β-Zellen des Pankreas, Low Density Lipoprotein-Cholesterin (LDL-C) senkend, wurden beschrieben.[8]
- Antiseptische Wirkung
Gegenüber Bakterien[9] und Amöben zeigt sich Berberin antiseptisch. Es zeigt schwache antibiotische Wirkungen. Die Wirkung kann allerdings durch den MDR-Inhibitor 5′-Methoxyhydnocarpin (5′-MHC) potenziert werden.[10][11][12] 5′-MHC ist zusammen mit Berberin Bestandteil vielen Berberis-Arten.[13]
- Zentralnervensystem
Außerdem wirkt Berberin beruhigend auf das Zentralnervensystem. Es moduliert die Neurotransmitter und deren Rezeptorsystem im Gehirn.[14]
- Diabetes mellitus
Bei Diabetes mellitus Typ II beruht der Wirkungsmechanismus von Berberin auf einer Erhöhung der Expression des Insulinrezeptors an der Oberfläche von Zellen.[15] Dadurch wird der Gehalt an Glucose im Blut reduziert. Der Mechanismus ist grundlegend anderer Natur als bei der Einnahme von Metformin oder Rosiglitazon.[16][17]
- Krebserkrankungen
Bei verschiedenen Krebserkrankungen, wie Prostatakrebs[18], Brustkrebs[19], Leukämien[19], Hautkrebs[20] oder Lungenkrebs[21] besitzt Berberin ein anti-neoplastisches Potenzial. Berberin wirkt sowohl in vitro als auch in vivo anti-proliferativ. Zudem wirkt es gegen potenziell karzinogene Mikroorganismen, wie Helicobacter pylori, und Viren, wie beispielsweise das Hepatitis-B-Virus. Auch die pro-apoptotische Wirkung des Berberins ist hier von Vorteil. Als breitbandiger Enzyminhibitor deaktiviert Berberin Enzyme wie N-Acetyltransferase, Cyclooxygenase-2 (COX-2) und Topoisomerasen.[22][23]
In vitro konnte eine mittlere Telomerase-Inhibierung festgestellt werden.[24] Ebenfalls konnte in vitro die Fähigkeit des Beberins als Radikalfänger nachgewiesen werden.[25]
- Herzrhythmusstörungen
Berberin wirkt als Antiarrhythmikum. Es wirkt dabei wie ein Klasse-III-Antiarrhythmikum, indem es spezifisch die Kaliumkanäle blockiert.[26][27]
- Arteriosklerose
Berberin senkt den Cholesterin-Gehalt im Blut. Der Mechanismus ist dabei ein anderer als bei Statinen, den handelsüblichen Lipidsenkern.[28] In Kombination mit Simvastatin wurde deshalb eine deutlich stärke Wirkung als bei einer Monotherapie beobachtet.[29]
- Alzheimer-Krankheit
Berberin nimmt offensichtlich Einfluss auf die Prozessierung des Amyloid-Precursor-Proteins, indem ein geringerer Anteil an β-Amyloid entsteht. Berberin ist daher ein vielversprechender Kandidat für die Behandlung der Alzheimer-Krankheit.[30][31]
- Psychische Erkrankungen
Das Enzym Prolylendopeptidase (PEP) wird von Berberin inhibiert.[32] PEP wird mit einer Reihe psychischer Erkrankungen, wie beispielsweise bipolare Störungen, Schizophrenie und Depressionen in Verbindung gebracht.[33]
Toxizität
Berberin wird in therapeutischen Gaben bis 500 mg gut vertragen. Es wurde früher in Dosen von 60–300 mg bei Erwachsenen bei Amöbiasis und Cholera verwendet. Ernstere Vergiftungen sind nicht bekannt.[34]
Auch in Tierversuchen (Ratte und Maus) wurde eine relativ schwache Toxizität für Berberinchlorid ermittelt. Die höchste Dosis von Berberin, die auch bei andauernder Aufnahme keine erkennbaren und messbaren Wirkungen (Schäden) hinterließ (der sogenannte no-observed-adverse-effect level, NOAEL), wurde erst bei Dosen, die um den Faktor 60–100 über den üblichen pharmakologischen Dosen für den Menschen lagen, beobachtet.[35]
Metabolismus
Berberin wird im Körper weitgehend metabolisiert. Weniger als 5 % der ursprünglichen Berberinmenge wurde bei Kaninchen im Urin, bei einer Gabe von 2 mg/kg intravenös, wieder gefunden.[36] Lediglich 0,5 % Berberin wurden im selben Versuch über die Galle und den Intestinaltrakt ausgeschieden, womit nur 5,5 % des oral aufgenommenen Berberins unverändert den Körper verließen.
In der Leber wird Berberin in der Phase I von Cytochrom P450 demethyliert und in Phase II glucuronidiert, das heißt mit Glucuronsäure umgesetzt.[37] Entsprechend sind im Plasma von Ratten die Metaboliten: Berberrubin (einfach demethyliertes Berberin, (CAS# [15401-69-1]), Thalifendin (CAS# [18207-71-1]) und Jatrorrhizin (CAS# [3621-38-3]), frei oder an Glucuronsäure gebunden, nachweisbar.[38]
Synthese
Biosynthese
Die Syntheseschritte von Berberin in den Berberitzen geht über zehn Stufen und wurde Anfang der 1990er-Jahre aufgeklärt.[39] Die beiden Ausgangsverbindungen sind dabei 4-Hydroxyphenylacetaldehyd und 3,4-Dihydroxybenzyl-2-Ethylamin, die im ersten Schritt in einer Kondensationsreaktion Norcoclaurin bilden. Das wird monomethyliert und bildet dabei Coclaurin. Nach zwei weiteren Schritten bildet sich Reticulin, aus dem wiederum Scoulerin entsteht. Über eine weitere Zwischenstufe entsteht Canadin, aus dem letztlich das Berberin entsteht.[40]
Technische Synthese
Mehrere Synthesen für die Herstellung von Berberin sind beschrieben. Die bekannteste ist die 1910 von Pictet und Gams entwickelte Pictet-Gams-Isochinolin-Synthese.[41][42]
Einzelnachweise
- ↑ a b c d Datenblatt Berberine hemisulfate salt bei Sigma-Aldrich, abgerufen am 13. März 2011.
- ↑ O. A. Neumüller: Roempps Chemie Lexikon 8. Auflage, Franckh´sche Verlagshandlung, Stuttgart, 1979, Band 1, S. 411.
- ↑ MP Biomedicals: Berberine chloride. Sicherheitsdatenblatt vom 10. April 2006.
- ↑ Fluoreszenzfarbstoffe in der Natur. Abgerufen am 31. Dezember 2009.
- ↑ Datenblatt Berberine chloride form bei Sigma-Aldrich, abgerufen am 31. Dezember 2009.
- ↑ a b A. Husemann und T. Husemann, Die Pflanzenstoffe in chemischer, physiologischer, pharmakologischer und toxikologischer Hinsicht, Berlin, 1871.
- ↑ C. L. Kuo u. a.: The anti-inflammatory potential of berberine in vitro and in vivo. In: Cancer Lett 203, 2004, S. 127–137; PMID 14732220.
- ↑ unbekannt: Traditionelle Chinesische Medizin. In: J Kardiol 6, 1999, S. 215.
- ↑ Y. Kaneda u. a.: In vitro effects of berberine sulphate on the growth and structure of Entamoeba histolytica, Giardia lamblia, and Trichomonas vaginalis. In: Annals of Tropical Medicine and Parasitology 85, 1991, S. 417–425; PMID 1796883.
- ↑ R. Verpoorte: Plants as source of medicines. In: Medicinal and Aromatic Plants : Agricultural, Commercial, Ecological, Legal, Pharmacological and Social Aspects R. J. Bogers u. a. (Herausgeber), Verlag Springer, 2006, S. 266. ISBN 978-1-4020-5447-1.
- ↑ N. P. Brenwald u. a.: Prevalence of a Putative Efflux Mechanism among Fluoroquinolone-Resistant Clinical Isolates of Streptococcus pneumoniae. In: Antimicrob Agents Chemother 42, 1998, S. 2032–2035; PMID 9687402; PMC 105728.
- ↑ A. Gärtner: Entwicklung und Charakterisierung von Enzymimmuntests für den Nachweis von Fluorchinolonen. Dissertation, LMU München, 2006, S. 8.
- ↑ F. R. Stermitz u. a.: Synergy in a medicinal plant: Antimicrobial action of berberine potentiated by 5′-methoxyhydnocarpin, a multidrug pump inhibitor. In: PNAS 97, 2000, S. 1433–1437; PMID 10677479; PMC 26451.
- ↑ S. K. Kulkarni, A. Dhir: Berberine: a plant alkaloid with therapeutic potential for central nervous system disorders. In: Phytother Res 24, 2010, S. 317–324, PMID 19998323.
- ↑ H. Zhang, J. Wei, R. Xue, J. D. Wu, W. Zhao, Z. Z. Wang, S. K. Wang, Z. X. Zhou, D. Q. Song, Y. M. Wang, H. N. Pan, W. J. Kong, J. D. Jiang: Berberine lowers blood glucose in type 2 diabetes mellitus patients through increasing insulin receptor expression. In: Metab. Clin. Exp. 59, 2010, S. 285–292 PMID 19800084.
- ↑ C. Fux: Chinesische Medizin bremst Zucker. In: Focus-Online vom 1. August 2006.
- ↑ L. Zhou u. a.: Berberine stimulates glucose transport through a mechanism distinct from insulin. In: Metabolism 56, 2007, S. 405–412; PMID 17292731.
- ↑ S. K. Mantena u. a.: Berberine, a natural product, induces G1-phase cell cycle arrest and caspase-3-dependent apoptosis in human prostate carcinoma cells. In: Mol Cancer Ther 5, 2006, S. 296–308; PMID 16505103.
- ↑ a b T. Issat u. a.: Berberine, a natural cholesterol reducing product, exerts antitumor cytostatic/cytotoxic effects independently from the mevalonate pathway. In: Oncol Rep 16, 2006, S. 1273–1276; PMID 17089049.
- ↑ S. K. Mantena u. a.: Berberine inhibits growth, induces G1 arrest and apoptosis in human epidermoid carcinoma A431 cells by regulating Cdki-Cdk-cyclin cascade, disruption of mitochondrial membrane potential and cleavage of caspase 3 and PARP. In: Carcinogenesis 27, 2006, S. 2018–2027; PMID 16621886.
- ↑ P. L. Peng u. a.: Inhibitory effect of berberine on the invasion of human lung cancer cells via decreased productions of urokinase-plasminogen activator and matrix metalloproteinase-2. In: Toxicol Appl Pharmacol 214, 2006, S. 8–15; PMID 16387334.
- ↑ . Sun u. a.: A systematic review of the anticancer properties of berberine, a natural product from Chinese herbs. In: Anticancer Drugs 20, 2009, S. 757–769; PMID 19704371 (Review).
- ↑ J. Tang u. a.: Berberine and Coptidis rhizoma as novel antineoplastic agents: a review of traditional use and biomedical investigations. In: J Ethnopharmacol 126, 2009, S. 5–17; PMID 19686830.
- ↑ I. Naasani u. a.: FJ5002: A Potent Telomerase Inhibitor Identified by Exploiting the Disease-oriented Screening Program with COMPARE Analysis. In: Cancer Res 59, 1999, S. 4004–4011; PMID 10463599.
- ↑ A. Shirwaikar u. a.: In vitro antioxidant studies on the benzyl tetra isoquinoline alkaloid berberine. In: Biol Pharm Bull 29, 2006, S. 1906–1910; PMID 16946507.
- ↑ J. Sanchez-Chapula: Increase in action potential duration and inhibition of the delayed rectifier outward current IK by berberine in cat ventricular myocytes. In: Br J Pharmacol 117, 1996, S. 1427–1434; PMID 8730735; PMC 1909453.
- ↑ C. W. Lau u. a.: Cardiovascular actions of berberine. In: Cardiovasc Drug Rev 19, 2001, S. 234–244; PMID 11607041 (Review).
- ↑ W. Kong u. a.: Berberine is a novel cholesterol-lowering drug working through a unique mechanism distinct from statins. In: Nat Med 10, 2004, S. 1344–1351; PMID 15531889.
- ↑ W. J. Kong u. a.: Combination of simvastatin with berberine improves the lipid-lowering efficacy. In: Metabolism 57, 2008, S. 1029–1037; PMID 18640378.
- ↑ M. Asai u. a.: Berberine alters the processing of Alzheimer's amyloid precursor protein to decrease Abeta secretion. In: Biochem Biophys Res Commun 352, 2007, S. 498–502; PMID 17125739.
- ↑ F. Zhu und C. Qian: Berberine chloride can ameliorate the spatial memory impairment and increase the expression of interleukin-1beta and inducible nitric oxide synthase in the rat model of Alzheimer's disease. In: BMC Neurosci 78, 2006, 7; PMID 17137520; PMC 1693919.
- ↑ T. Tarrago u. a.: The natural product berberine is a human prolyl oligopeptidase inhibitor. In: ChemMedChem 2, 2007, S. 354–359; PMID 17295371.
- ↑ N. Momeni u. a.: Alterations of prolyl endopeptidase activity in the plasma of children with autistic spectrum disorders. In: BMC Psychiatry 27, 2005, 5; doi:10.1186/1471-244X-5-27; PMID 15932649; PMC 1190193.
- ↑ Berberitze (Berberis vulgaris). Giftinformationszentrale der Universität Bonn, abgerufen am 31. Dezember 2009.
- ↑ G.D. Jahnke u.a.: Developmental toxicity evaluation of berberine in rats and mice. In: Birth Defects Res B Dev Reprod Toxicol 77, 2006, S. 195-206; PMID 16634078.
- ↑ C.M. Chen und H.C. Chang: Determination of berberine in plasma, urine and bile by high-performance liquid chromatography. In: J Chromatogr B 665, 1995, S. 117–123; PMID 7795781.
- ↑ P. L. Tsai u. a.: Hepatobiliary excretion of berberine. In:Drug Metab Dispos 32, 2003, S. 405–412; PMID 15039293.
- ↑ F. Zuo u.a.: Pharmacokinetics of Berberine and Its Main Metabolites in Conventional and Pseudo Germ-Free Rats Determined by Liquid Chromatography/Ion Trap Mass Spectrometry. In: Drug Metabolism and Disposition 34, 2006, S. 2064–2072; PMID 16956957.
- ↑ J. A. Bjorklund: Cryptic Stereochemistry of Berberine Alkaloid Biosynthesis. In: J. Am. Chem. Soc. 1995', 117; doi:10.1021/ja00110a009.
- ↑ Biosynthesis of isoquinoline alkaloids. vom 18. Oktober 2006.
- ↑ A. Pictet und A. Gams. In:Ber Dtsch Chem Ges 43, 1910, S. 2384–2391.
- ↑ C. D. Gilmore u. a.: Orthogonal Synthesis of Indolines and Isoquinolines via Aryne Annulation. In: JACS 130, 2008, S. 1558–1559; doi:10.1021/ja0780582.
Weiterführende Literatur
- M. Ye u. a.: Neuropharmacological and pharmacokinetic properties of berberine: a review of recent research. In: J Pharm Pharmacol 61, 2009, S. 831–837; PMID 19589224.
- M. Imanshahidi und H. Hosseinzadeh: Pharmacological and therapeutic effects of Berberis vulgaris and its active constituent, berberine. In: Phytother Res 22, 2008, S. 999–1012; PMID 18618524.
- M. S. Choi u. a.: Berberine inhibits human neuroblastoma cell growth through induction of p53-dependent apoptosis. In: Anticancer Res 28, 2008, S. 3777–3784; PMID 19189664.
- K. Hayashi u. a.: Antiviral activity of berberine and related compounds against human cytomegalovirus In: Bioorg Med Chem Lett 17, 2007, S. 1562–1564; PMID 17239594.
- S. K. Mantena: Berberine, a natural product, induces G1-phase cell cycle arrest and caspase-3-dependent apoptosis in human prostate carcinoma cells. In: Mol Cancer Ther 5, 2006, S. 296-308; PMID 16505103.
- R. Ovádeková u. a.: Nanostructured electrochemical DNA biosensors for detection of the effect of berberine on DNA from cancer cells. In: Anal Bioanal Chem 386, 2006, S. 2055–2062; PMID 17053918.
- T. Efferth u. a.: Molecular determinants of response of tumor cells to berberine. In: Cancer Genomics Proteomics 2, 2005, S. 115–124.
- H. H. Yu: Antimicrobial activity of berberine alone and in combination with ampicillin or oxacillin against methicillin-resistant Staphylococcus aureus. In: J Med Food 8, 2005, S. 454–461; PMID 16379555.
- K. Weijia u. a.: Berberine is a novel cholesterol-lowering drug working through a unique mechanism distinct from statins. In: Nature Medicine 10, 2004, S. 1344–1351; PMID 15531889.
- C. C. Lin u. a.: Cytotoxic effects of Coptis chinensis and Epimedium sagittatum extracts and their major constituents (berberine, coptisine and icariin) on hepatoma and leukemia cell growth. In: Clin Exp Pharmacol Physiol 31, 2004, S. 65–69; PMID 14756686.
- C. W. Lau u. a.: Cardiovascular actions of berberine. In: Cardiovasc Drug Rev 19, 2001, S. 234–244; PMID 11607041.
- C. W. Wright u. a.: In vitro antiplasmodial, antiamoebic, and cytotoxic activities of some monomeric isoquinoline alkaloids. In: J Nat Prod 63, 2000, S. 1638–1640; PMID 11141105.
- H. L. Lin u. a.: Berberine modulates expression of mdr1 gene product and the responses of digestive track cancer cells to Paclitaxel. In: British Journal of Cancer 81, 1999, S. 416–422; PMID 10507765; PMC 2362909.
- G. H. Rabbani u. a.: Randomized controlled trial of berberine sulfate therapy for diarrhea due to enterotoxigenic E. coli and Vibrio cholerae. In: Journal of Infectious Diseases 155, 1987, S. 979-984; PMID 3549923.
- H. Schmitz: Zur Beeinflussung des Zellstoffwechsels durch Berberin. In: Journal of Cancer Research and Clinical Oncology 57, 1950, S. 137–141.

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- Gesundheitsschädlicher Stoff
- Alkaloid
- Arzneistoff
- Antibiotikum
- Fluoreszenzfarbstoff
- Pflanzenfarbstoff
- Quartäre Ammoniumverbindung
- Benzodioxol
- Isochinolin
- Phenolether
- Textilfarbstoff
- Dihydropyridin
Wikimedia Foundation.



