- Bernsteinsäureanhydrid
-
Strukturformel 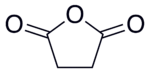
Allgemeines Name Bernsteinsäureanhydrid Andere Namen - BSA
- Dihydro-2,5-furandion
- Oxolan-2,5-dion (IUPAC)
- Butandisäureanhydrid
- 2,5-Diketotetrahydrofuran
- Succinicanhydrid
- Succinyloxid
Summenformel C4H4O3 CAS-Nummer 108-30-5 PubChem 7922 Kurzbeschreibung farblose, stechend riechende Nadeln/Kristalle[1]
Eigenschaften Molare Masse 100,07 g·mol−1 Aggregatzustand fest[1]
Dichte Schmelzpunkt Siedepunkt 261 °C[1]
Dampfdruck Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 
Achtung
H- und P-Sätze H: 302-319-335 EUH: keine EUH-Sätze P: 305+351+338 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36/37 S: (2)-25-46 LD50 1510 mg·kg−1 (oral, Ratte)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bernsteinsäureanhydrid ist eine heterozyklische organische chemische Verbindung und das Säureanhydrid der Bernsteinsäure.
Inhaltsverzeichnis
Gewinnung und Darstellung
Bernsteinsäureanhydrid kann durch Reaktion von Bernsteinsäure und Essigsäureanhydrid, Acetylchlorid oder Phosphoroxychlorid gewonnen werden.[4] Auch bei Erhitzung von Bernsteinsäure über 200 °C bildet sich Bernsteinsäureanhydrid.[5] Die Verbindung kann auch durch die katalytische Hydrierung von Maleinsäureanhydrid erhalten werden.[6]
Eigenschaften
Physikalische Eigenschaften
Bernsteinsäureanhydrid ist ein weißer brennbarer Feststoff, der bei 119–120 °C schmilzt.[7] Bei Normaldruck siedet die Verbindung bei 261 °C.[8] Im Vakuum sublimiert die Verbindung.[5] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,65221, B = 1433,874 und C = −144,107 im Temperaturbereich von 365 K bis 534 K.[9] Die Löslichkeit in Wasser beträgt bei 20 °C 67 g·l−1 Dabei erfolgt eine langsame Hydrolyse. Die wässrige Lösung reagiert sauer.[1] In aromatischen Kohlenwasserstoffen sind die Löslichkeiten relativ gering. Sie betragen in Toluol 10 g·l−1, in Styrol 11 g·l-1, in Ethylbenzol 8 g·l-1 und in Cumol 5 g·l-1.[10] Die Bildungswärme des Feststoffes beträgt −608,6 kJ·mol−1.[11] Für die Verbrennungswärme wurde ein Wert von −1537,1 kJ·mol−1 bestimmt.[11]
-
Dampfdruckfunktion von Bernsteinsäureanhydrid
Chemische Eigenschaften
Bernsteinsäureanhydrid kann in Gegenwart von Natronlauge zur Bernsteinsäure hydrolysiert werden. In Dioxan/Wasser wurde bei 30 °C eine Reaktionswärme von −46,86 kJ·mol−1 bestimmt.[12] Die Umsetzung mit Alkoholen ergibt die entsprechenden Bernsteinsäurehalbester.[13]Die Verbindung kann als Reagenz für Friedel-Crafts-Acylierungen dienen. Die Umsetzung mit Benzol ergibt hier die γ–Oxocarbonsäure β–Benzoylpropionsäure.[14] Aus Grignard-Verbindungen und Bernsteinsäureanhydrid können ebenfalls einfach γ–Oxocarbonsäureester erhalten werden.[15] Die Umsetzung mit Ammoniak bei höheren Temperaturen ergibt das Succinimid.[16] Bei höheren Temperaturen ist der Stoff brennbar, aber er reagiert mit brandfördernden Stoffen sehr heftig. Die Schmelze bildet entzündbare Dampf-Luft-Gemische. Der Flammpunkt beträgt 157 °C.[1]
Gesundheitsgefahren
Die Folgen bei Berührung oder Einatmung des Bernsteinsäureanhydrid sind Reizungen der Haut und Atemwege, wobei die Schleimhäute sich entzünden können.[1] Die Verbindung wurde als Komponente im Hauptstrom einer filterlosen Zigarette nachgewiesen.[17]
Verwendung
Bernsteinsäureanhydrid wird als Synthesechemikalie für andere chemische Verbindungen verwendet[1], wie z.B. in den mehrstufigen Synthesen von Tetralon, 1-Naphthol, Tetralin und Naphthalin[17] sowie von N-Chlor– und N-Bromsuccinimid.[16] Die industrielle Herstellung von Citraconsäureanhydrid (Methylmaleinsäureanhydrid) erfolgt durch Umsetzung von Bernsteinsäureanhydrid mit Formaldehyd.[6] Die Verbindung ist eine Ausgangsverbindung für das in der Papierindustrie verwendete synthetische Leimungsmittel Accosize.[17]
Literatur
- Kühn, Birett: Merkblätter gefährlicher Arbeitsstoffe. Ecomed, Landsberg, 1986, Erg. Lfg.
Einzelnachweise
- ↑ a b c d e f g h i j k l m Eintrag zu CAS-Nr. 108-30-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27.04.2010 (JavaScript erforderlich).
- ↑ Datenblatt Bernsteinsäureanhydrid bei Merck, abgerufen am 27. April 2010.
- ↑ a b Eintrag zu CAS-Nr. 108-30-5 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Fieser, L.F.; Martin, E.L.; Shriner, R.L.; Struck, H.C.: Succinic anhydride. In: Organic Syntheses. Coll. Vol. 2, p. 560 (1943); Vol. 12, p. 66 (1932); PDF.
- ↑ a b Arnold Willmes; Taschenbuch Chemische Substanzen: Elemente - Anorganika - Organika - Naturstoffe - Polymere; ISBN 978-3-8171-1787-1.
- ↑ a b Lohbeck, K.; Haferkorn, H.; Fuhrmann, W.; Fedtke, N.: Maleic and Fumaric Acids in Ullmann's Encyclopedia of Industrial Chemistry,Wiley-VCH Verlag GmbH & Co KGaA, Weinheim 2005. doi:10.1002/14356007.a16_053.
- ↑ Mclean, A.; Adams, R.: Succinic-α-d2,α'-d2, Acid and Its Derivatives in J. Am. Chem. Soc. 58 (1936) 804–810. doi:10.1021/ja01296a038.
- ↑ CRC Handbook of Data on Organic Compounds, 2nd Edition, Weast ,R.C and Grasselli, J.G., ed(s)., CRC Press, Inc., Boca Raton, FL, 1989, 1.
- ↑ Stull, D.R.: Vapor Pressure of Pure Substances Organic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
- ↑ Bartlett, P.D.; Nozaki, K.: The Polymerization of Allyl Compounds. III. The Peroxide-induced Copolymerization of Allyl Acetate with Maleic Anhydride in J. Am. Chem. Soc. 68 (1946) 1495–1504, doi:10.1021/ja01212a033.
- ↑ a b Yan, Y.M.; Pilcher, G.: Enthalpies of combustion of succinic anhydride, glutaric anhydride, and glutarimide in J. Chem. Thermodyn. 22 (1990) 893–898, doi:10.1016/0021-9614(90)90177-R.
- ↑ Conn, J.B.; Kistiakowsky, G.B.; Roberts, R.M.; Smith, E.A.: Heats of organic reactions. XIII. Heats of hydrolysis of some acid anhydrides in J. Am. Chem. Soc. 64 (1942) 1747–1752, doi:10.1021/ja01260a001.
- ↑ Cason, J.: β–Carbomethoxypropionyl chloride. In: Organic Syntheses. Coll. Vol. 3, p. 169 (1955); Vol. 25, p. 19 (1945); PDF.
- ↑ Somerville, L.F.; Allen, C.F.H.: β–Benzoylpropionic acid. In: Organic Syntheses. Coll. Vol. 2, p. 81 (1943); Vol. 13, p. 12 (1933); PDF.
- ↑ Hauptmann, S.; Graefe, J.; Remane, H.: Lehrbuch der Organischen Chemie, Deutscher Verlag für Grundstoffindustrie, Leipzig 1980, S. 421.
- ↑ a b Hauptmann, S.; Graefe, J.; Remane, H.: Lehrbuch der Organischen Chemie, Deutscher Verlag für Grundstoffindustrie, Leipzig 1980, S. 407.
- ↑ a b c Römpp Chemie Lexikon, 9. Auflage, Georg Thieme Verlag, 1995.
Wikimedia Foundation.

