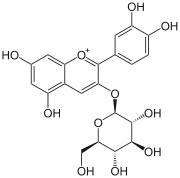
- E163
-
Anthocyane (engl. anthocyanins, von griech. anthos = Blüte, Blume, kyáneos = dunkelblau) sind wasserlösliche Pflanzenfarbstoffe, die in nahezu allen höheren Pflanzen vorkommen und den Blüten und Früchten die rote, violette, blaue oder blauschwarze Färbung geben. Sie gehören zu den Flavon-ähnlichen Stoffen, den Flavonoiden. Die Stoffgruppe der Anthocyane selbst lässt sich in die Zucker-freien Anthocyanidine (Aglykone) und die Anthocyane (Glykoside) unterteilen. Die Anthocyane werden zu den sekundären Pflanzenstoffen gezählt. Sie sind als Lebensmittelzusatzstoff unter der E-Nummer 163 zugelassen. Es sind etwa 250 Anthocyane bekannt.
Namenshinweis: „Anthocyanin“ gibt es nur im Englischen, im Deutschen muss es anstelle von „Anthocyanine“ ausschließlich „Anthocyane“ heißen.
Inhaltsverzeichnis
Vorkommen
Lebensmittel Anthocyane in mg pro
100 g LebensmittelAçai 800–1000 Aronia 200–1000 [1] Aubergine 750 Blutorange ≈ 200 Brombeere ≈ 115 Heidelbeere 80–420 Himbeere 10–60 Kirsche 350–400 Johannisbeere
(schwarze)80–420 Traube
(rote)30–750 Rotwein 24–35 Anthocyane sind chymochrome Farbstoffe, die nur im Zellsaft von Landpflanzen, nicht aber in Tieren, Mikroorganismen oder Wasserpflanzen zu finden sind. Dies liegt daran, dass für die Biosynthese der Anthocyane Produkte benötigt werden, die bei der Photosynthese der Pflanzen entstehen. Bei Wasserpflanzen ist der Umsatz der Photosynthese aufgrund der geringen Lichtintensität unter Wasser jedoch nicht ausreichend für die Produktion. Aber auch nicht alle Landpflanzen enthalten Anthocyane: bei den Nelkenartigen, Kakteen und Mollugogewächsen übernehmen Betalaine die Aufgabe der Anthocyane.
Anthocyane kommen nahezu in allen höheren Pflanzen, meist in den Blüten und Früchten, aber auch in den Blättern und Wurzeln vor. In den jeweiligen Pflanzenteilen sind sie vor allem in den äußeren Zellschichten wie den Epidermiszellen zu finden. Die dort gefundenen Mengen sind relativ groß: Ein Kilogramm Brombeeren enthält zum Beispiel etwa 1,15 Gramm Anthocyane, aus roten und schwarzen Hülsenfrüchten lassen sich bis zu 20 Milligramm pro Gramm Schale gewinnen. Reich an Anthocyanen sind zum Beispiel die Açai-Beere, Aronia, Kirschen, Auberginen, blaue Trauben, Heidelbeeren und Rotkohl sowie Usambaraveilchen. Weniger verbreitet sind Anthocyane zum Beispiel in Bananen, Spargel, Erbsen, Fenchel, Birnen sowie Kartoffeln. Der Tabelle rechts können die Mengenangaben einiger Lebensmittel entnommen werden. Am häufigsten kommen in der Natur die Glykoside von Cyanidin, Delphinidin, Malvidin, Pelargonidin, Peonidin und Petunidin vor. Schätzungsweise werden 2 % des gesamten Kohlenstoffs, der durch die Photosynthese in den Pflanzen fixiert wird, zu Flavonoiden und deren Derivaten wie den Anthocyanen umgesetzt. Das sind nicht weniger als 1 × 109 Tonnen pro Jahr.
In den Pflanzen liegen die Anthocyane zusammen mit anderen natürlichen Farbstoffen wie den chemisch eng verwandten Flavonen, den Carotinoiden, Anthoxanthinen und Betalainen vor. Sie sind neben diesen auch für die Färbung der Blätter im Herbst verantwortlich, wenn die Photosynthese eingestellt und das Chlorophyll nicht neu gebildet wird.
Auch bei noch relativ jungen Pflanzen, bei denen die Chlorophyll- und Wachsproduktion noch nicht eingesetzt hat und die somit vor UV-Licht ungeschützt wären, werden vermehrt Anthocyane produziert. Teile oder sogar die ganze Pflanze werden mit Hilfe der Farbstoffe, die als Jugendanthocyane bezeichnet werden, eingefärbt und geschützt. Wenn die Chlorophyllproduktion beginnt, wird die Produktion der Anthocyanfarbstoffe herabgesetzt. Das Muster der Anthocyanbildung in Pflanzen ist für die Pflanzenart spezifisch, da es von den Bodenbedingungen, Licht, Wärme und Pflanzenart beziehungsweise Sorte abhängt. Dass Pflanzen nur ein Anthocyan als Farbstoff aufweisen, ist äußerst selten, kommt aber dennoch vor. Das Fehlen oder besonders starke Vorkommen eines bestimmten Anthocyans in einer Pflanze ist auf genetische Umstände zurückzuführen.
Aufgabe in Pflanzen
Die Anthocyane haben in den Pflanzen mehrere Aufgaben: Sie sollen
- Pflanzen vor dem starken UV-Licht der Sonne schützen, indem sie bestimmte Wellenlängen absorbieren. So wird eine Schädigung der Proteine in der Zelle und der DNA in den Zellkernen verhindert.
- helfen, Insekten und andere Tiere anzulocken, indem sie aufgrund ihrer Licht-absorbierenden Eigenschaften bei den Pflanzen Farben erzeugen. Diese können den Pflanzen bei ihrer Vermehrung helfen.
- Freie Radikale binden, die bei oxidativem Stress entstehen.
Die ersten beiden Punkte erklären auch, warum die Anthocyane sich in den äußeren Schichten der Pflanzenteile finden: Nur hier können sie ihre Aufgabe erfüllen. Wenn Pflanzen nun starkem UV-Licht oder ionisierender Strahlung ausgesetzt werden, regt die Pflanze über chemische Botenstoffe die Anthocyanproduktion an.
Struktur
Das Grundgerüst der Anthocyane besteht aus einem sauerstoffhaltigen Heterocyclus (Pyran) mit ankondensiertem Benzolring. Der Pyranring ist bei Anthocyanen an Position 2 mit einem Phenylrest verbunden, der selber verschiedene Substituenten tragen kann. Als Gegenion zum Ausgleich des kationischen Sauerstoffs im Pyranring findet sich meistens Chlorid. In dieser positiven Ladung unterscheiden sich die Anthocyane von anderen Flavonoiden. Man bezeichnet Verbindungen mit dieser Grundstruktur als Benzopyryliumsalze.
Einige ausgewählte Anthocyanidine und deren Substitutionsmuster Anthocyanidin Grundstruktur R3′ R4′ R5′ R3 R5 R6 R7 Aurantinidin 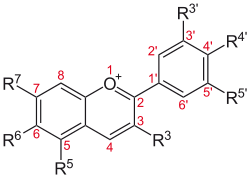
−H −OH −H −OH −OH −OH −OH Cyanidin −OH −OH −H −OH −OH −H −OH Delphinidin −OH −OH −OH −OH −OH −H −OH Europinidin −OCH3 −OH −OH −OH −OCH3 −H −OH Luteolinidin −OH −OH −H −H −OH −H −OH Pelargonidin −H −OH −H −OH −OH −H −OH Malvidin −OCH3 −OH −OCH3 −OH −OH −H −OH Peonidin −OCH3 −OH −H −OH −OH −H −OH Petunidin −OH −OH −OCH3 −OH −OH −H −OH Rosinidin −OCH3 −OH −H −OH −OH −H −OCH3 Anthocyanidine weisen an Position 3 zumeist eine Hydroxylgruppe auf.
Bei den Glykosiden der Anthocyanidinen, den Anthocyanen (engl. anthocyanosides), sind in der Regel an der Hydroxylgruppe am Kohlenstoffatom 3 Zuckermoleküle über eine O-glykosidische Bindung gebunden. Das können Glucose, Galactose, Arabinose, Rhamnose und Xylose in Form eines einzelnen Moleküls oder als Di- oder Trisaccharide sein. Durch Acylierung mit aromatischen Pflanzensäuren an diesen ergibt sich die Vielfalt der Anthocyane. Die Glykosidform verleiht den Molekülen eine erhöhte Wasserlöslichkeit, die wichtig für den Transport in den Pflanzen ist, sowie eine erhöhte Stabilität.
Eigenschaften
Anthocyane absorbieren Licht im Wellenlängenbereich zwischen 270 und 290 Nanometern (ultraviolette Strahlung) sowie im sichtbaren Bereich zwischen 465 und 560 Nanometern (blau bis grün). Der Wellenlängenbereich wird außer von der Molekülstruktur auch vom pH-Wert der Umgebung beeinflusst. Licht dieser Wellenlängen wird aus dem sichtbaren Licht herausgefiltert und der reflektierte Lichtanteil erscheint uns als eine Farbe. Das Farbspektrum reicht dabei von blau bis rot, es finden sich alle Farben bis auf grün. Im sauren Milieu überwiegt die Rotfärbung, im basischen sind vor allem Blau- und Violetttöne zu finden. Farbumschläge finden auch in einigen Pflanzen statt: Die Blüten des Lungenkrauts (Pulmonaria officinalis) sind zuerst rosa, später violett gefärbt, da sich der pH-Wert im Laufe des Lebens ändert. Anthocyan-Extrakte können als Indikatoren für Säuren und Basen dienen: auf die Anthocyane ist so auch die Indikatorwirkung des Rotkohls zurückzuführen.
Die Farbänderungen beruhen auf chemischen Reaktionen. Bei pH-Werten unter 3 sind sie eher rot und liegen in Form von Flavyliumkationen vor. pH-Werte zwischen 4 und 5 führen durch Hydroxylierung zu Carbinol-Pseudobasen und meistens zur Entfärbung, womit die Anthocyane ihre Aufgaben in den Pflanzen nicht mehr erfüllen können. Bei pH-Werten zwischen 6 und 7 liegen sie als Flavenole vor und sind eher purpur, wobei durch Dehydroxylierung eine Hydroxylgruppe in eine Ketogruppe umgewandelt wird (hier wurde willkürlich R2 gewählt). Bei pH-Werten zwischen 7 und 8 wird dieses Molekül zum Flavenolatanion deprotoniert, das eine purpurne Farbe aufweist. pH-Werte über 8 führen zum Aufbrechen des Pyranringes. Das Molekül wird dabei zu einem gelben Chalkon umgewandelt.
Viele Anthocyane bilden Metallkomplexe. Die Komplexierung der Metallionen führt dazu, dass das Absorptionsmaximum der Verbindungen zu kürzeren Wellenlängen, also in den ultravioletten Bereich des elektromagnetischen Spektrums verschoben wird. Dieses verleiht den Anthocyanen eine blaue bis violette Färbung, man spricht von einem bathochromen Effekt.
Besonders häufig sind Aluminium-, Magnesium- und Eisenkomplexe. Beim Vermischen mit Eisen(III)-chlorid-Lösungen entstehen tiefviolette Färbungen. Führt man Pflanzen nun Metallelektrolyte zu, zum Beispiel durch Eingraben von Metallstücken in den Boden, kann eine Farbänderung herbeigeführt werden.
Anthocyane sind licht- und temperaturempfindlich und anfällig gegenüber höheren pH-Werten, bei pH-Werten unter 3 sind sie am stabilsten. Mit Tanninen reagieren Anthocyane und fallen aus wässrigen Lösungen aus. Oxidationsmittel entfärben Anthocyane.
Biosynthese
Die Bildung der Anthocyane folgt der Biosynthese aller Flavonoide (siehe dazu: Biosynthese). Eine biologische Vorstufe sind die oligomeren Proanthocyanidine. Als Schlüsselenzym des Anthocyan-Syntheseweges wurde die Chalkonsynthase (CHS) identifiziert, deren Expression auf mRNA-Ebene reguliert wird. Verschiedene Außenfaktoren, Umwelteinflüsse wie Temperatur, Licht und Wasserverfügbarkeit, haben darauf Einfluss. Aber auch Pflanzenstress kann eine Rolle spielen.
Bei Keimlingen wird etwa die Synthese des so genannten Jugendanthocyans in den Keimblättern und im Hypokotyl durch den Rot- und Blaulichtanteil im Sonnenlicht angeregt, der durch die als Photorezeptoren funktionieren Moleküle Phytochrom (Rotlicht) und Kryptochrom (Blaulicht) registriert wird. Ausgewachsene Pflanzen produzieren vor allem bei ultravioletter Belichtung, die für die Pflanze Stress bedeutet, Anthocyane in Blättern und dem Spross. Dabei stellen die Anthocyane wahrscheinlich nur die stabilen Endprodukte der Synthese dar, wichtig für den Schutz der Pflanze sind jedoch die UV-absorbierenden Vorstufen.
Auch bei der Laubfärbung im Herbst werden Anthocyane gebildet, die den Rotanteil des Herbstlaubes ausmachen. Dabei sind die Anthocyanide hier das Endprodukt des Zimtsäureweges, der durch den Abbau von Phenylalanin angestoßen wird. In Pflanzen, die durch Symbiose mit Bakterien Stickstoff fixieren, findet man diesen Stoffwechselweg nicht. Daher bleibt hier eine Herbstfärbung durch Anthocyane aus.
Grundsätzlich werden Anthocyanide in Blättern immer nur in der äußersten Schicht, der Epidermis, gebildet. In Sprossorganen bilden sich die Anthocyanide in der darunter liegenden Subepidermis und in Blattorganen vor allem nahe der Blattvenen und dem Blattrand. Zurückzuführen ist diese lokale Beschränkung auf die Existenz genetischer Transkriptionsfaktoren in diesen Bereichen, die eine Synthese der Anthocyanide als Reaktion auf bestimmte Faktoren erst ermöglichen. Man spricht in diesem Zusammenhang von einem Kompetenzmuster.
Gewinnung und Darstellung
Die Gewinnung erfolgt durch Extraktion mit sulfitiertem Wasser oder durch chromatographische Verfahren aus den Bestandteilen verschiedener Pflanzen. Am größten ist die Ausbeute zumeist bei den Fruchtschalen oder Blüten.
Synthetisch sind die Anthocyanidine durch eine Knoevenagel-Kondensation von Salicylaldehyden mit α-Methoxyacetophenonen zugänglich. Das Primärprodukt tautomerisiert unter Ringschluss zum α-Flavanol, das bei Zugabe von Säure Wasser abspaltet und das Flavylium-Salz ergibt (Robinson-Anellierung).
Ein weiterer Syntheseansatz ist die elektrophile Cyclisierung von Phenolen mit Benzoylessigsäureestern, der zunächst zu substituierten Flavonen führt.
Verwendung
Anthocyane werden als Lebensmittelzusatzstoff zur Färbung zum Beispiel Fruchtgelees, Süßwaren, Brausen, Marmelade, Konfitüren, Obstkonserven, Backmitteln für feine Backwaren, Überzüge und Speiseeis zugesetzt. Meist werden sie nur sauren Produkten zugesetzt, da sie nur in diesen über längere Zeit stabil sind. Als Farbstoffe in der Kunst werden sie wegen ihrer fehlenden Stabilität nicht eingesetzt.
Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 163 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen. Eine Verwendung ist bei einigen Lebensmitteln jedoch nicht erlaubt, wenn eine Täuschungsgefahr besteht, wie etwa bei Brot, verschiedenen Milchprodukten, Nudeln und Honig.
Physiologie
Die Anthocyane aus rotem Traubensaft und schwarzem Johannisbeersaft werden nur in geringem Umfang vom Körper aufgenommen und/oder schnell metabolisiert, wie aus geringen Anthocyan-Konzentrationen sowohl im Blutplasma als auch im Urin geschlossen wurde. Die tägliche Aufnahmemenge schwankt von Mensch zu Mensch stark, sodass Durchschnittswerte kaum Aussagekraft besitzen. Die Bioverfügbarkeit der Anthocyane liegt bei Aufnahme mit normaler Nahrung nur bei etwa 1 Prozent.
Anthocyane haben antioxidative Wirkung, die die von Vitamin C und Vitamin E, zumindest in vitro, um ein Vielfaches übersteigen kann. Es wird jedoch bezweifelt, dass die Anthocyane auch in vivo diese starke antioxidative Wirkung entfalten können, da die Bioverfügbarkeit schlecht ist. Im menschlichen Körper binden sie freie Radikale und schützen somit die DNA sowie Lipide und Kohlenhydrate vor Schädigung. Den Anthocyanen werden noch andere Wirkungen zugeschrieben: Sie sollen die Sehvorgänge verbessern, entzündungshemmend und gefäßschützend wirken.
Anthocyane sind nur in sehr geringem Maße toxisch, aus Pflanzen aufgenommene Anthocyane stellen keine Gefahr dar.
Analytik
Anthocyane lassen sich am leichtesten mittels chromatographischer Methoden wie zum Beispiel HPLC, meist mit gekoppeltem Massenspektrometer (LCMS), quantifizieren. Bei der HPLC bietet sich eine Reversed-Phase-C18-Phase (siehe HPLC) an. Kleinere Mengen sind mit einem elektrochemischen, größere mit einem photometrischen Detektor nachweisbar.
Bei der Analyse ist es vorteilhaft, den pH-Wert mit Säuren wie zum Beispiel Ameisensäure auf unter 3 zu erniedrigen, da die Anthocyane unter diesen Bedingungen am stabilsten sind. Da Pflanzen ein ganz spezifisches Anthocyanmuster aufweisen, wird zum Beispiel häufig über die Anthocyane nachgewiesen, ob ein Wein aus einem bestimmten Anbaugebiet kommt oder nicht und um welche Rebsorte es sich handelt. Die Bestimmung von Pflanzen kann anhand ihres Anthocyanmusters durchgeführt werden.
Geschichte
1835 gab Ludwig Clamor Marquart den Namen Anthocyan erstmals einer chemischen Verbindung, die Blüten eine blaue Färbung verleiht. Später wurde dieser Begriff zur Bezeichnung einer ganzen Gruppe von Verbindungen eingeführt, die chemisch dem ursprünglichen „Blumenblau“ ähneln.
Wesentliche Beiträge zur Strukturaufklärung der Anthocyane leistete Richard Willstätter, der für seine Pionierarbeit auf diesem Gebiet den Nobelpreis für Chemie im Jahre 1915 erhielt. Sir Robert Robinson kam 1921 aufgrund der Analyse der Substitutionsmuster der Flavonoide zu der Erkenntnis, dass die Flavonoide und damit die Anthocyane biogenetisch aus einer C6- und einer C6-C3-Einheit aufgebaut sein müssen. 1953 erweiterten Birch und Donovan diese Theorie: Die Biosynthese muss von einer p-Hydroxyzimtsäure und drei Acetateinheiten ausgehen, als Intermediat wird eine Polyketosäure gebildet.
Einzelnachweise
- ↑ Cyanidin-3-glucosid: ≈ 2g/L (siehe Aronia-Direktsaft 100% Kelterei Walther)
Literatur
- E. Bayer (1966): Komplexbildung und Blütenfarben. In: Angew. Chem. Bd. 78, Nr. 18-19, S. 834–841. doi:10.1002/ange.19660781803
- K. Herrmann (1986): Anthocyanin-Farbstoffe in Lebensmitteln. In: Ernährungs-Umschau. Bd. 33, Nr. 9, S. 275–278.
- K. Herrmann (1995): Hinweise auf eine antioxidative Wirkung von Anthocyaninen. In: Gordian. Bd. 95, Nr. 5, S. 84–86.
- M. N. Clifford (2000): Anthocyanins – nature, occurrence and dietary burden. In: Journal of the Science of Food and Agriculture. Bd. 80, Nr. 7, S. 1063–1072. doi:10.1002/(SICI)1097-0010(20000515)80:7<1063::AID-JSFA605>3.0.CO;2-Q
- G. Mazza, E. Miniati: Anthocyanins in fruits, vegetables, and grains. CRC Press, Boca Raton 1993. ISBN 0-8493-0172-6
Weblinks
Wikimedia Foundation.