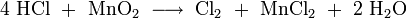- Hydrochlorsäure
-
Allgemeines Name Salzsäure Andere Namen - Chlorwasserstoffsäure
- Acidum hydrochloricum
Summenformel HCl(aq) CAS-Nummer 7647-01-0 ATC-Code Kurzbeschreibung farblose bis gelbliche, stechend riechende Flüssigkeit [1] Eigenschaften Molare Masse 36,46 g·mol-1 Aggregatzustand flüssig
Dichte 1,19 g·cm−3 (37-prozentige Lösung) [1]
Schmelzpunkt −35 °C (36-prozentige Lösung) [1]
Siedepunkt 57 °C (36-prozentige Lösung) [1]
Dampfdruck Löslichkeit Chlorwasserstoff lässt sich bis zu einer Konzentration von ca. 42,7 %[2] in Wasser lösen
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Ätzend (C) (Konz. ≥ 25 %)
R- und S-Sätze R: 34-37 S: (1/2)-26-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 2 ml·m−3 bzw. 3,0 mg·m−3 [1]
WGK 1 – schwach wassergefährdend [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Salzsäure (systematischer Name Chlorwasserstoffsäure) ist eine wässrige Lösung des Gases Chlorwasserstoff (Summenformel HCl), in der der Chlorwasserstoff in Oxonium- und Chloridionen dissoziiert ist. Sie ist eine starke, anorganische Säure und zählt zu den Mineralsäuren. Die Salze der Chlorwasserstoffsäure heißen Chloride. Das bekannteste Chlorid ist das Natriumchlorid (NaCl, Kochsalz).
Inhaltsverzeichnis
Geschichte
Salzsäure dürfte schon den ersten Alchemisten bekannt gewesen sein. Ihre Entdeckung wird Maria Prophetissa im 1. Jahrhundert und im 9. Jahrhundert Geber zugeschrieben.
In der ersten Hälfte des 15. Jahrhunderts gewann Basilius Valentinus Salzsäure durch Reaktion von Halit (Steinsalz) mit Eisenvitriol. Die Herstellung aus Speisesalz und Schwefelsäure gelang Johann Rudolph Glauber im 17. Jahrhundert. Lavoisier nannte Salzsäure acide muriatique (lat. muria = Salzlake). Kochsalzhaltige Quellen werden heute noch als muriatische Quellen bezeichnet. In Nordamerika wird Salzsäure auch muriatic acid genannt.
Vorkommen
In der Natur findet sich Salzsäure in Vulkangasen und in verdünnter Lösung in Kraterseen. In freier Form kommt sie im Magensaft der Wirbeltiere vor (0,1 bis 0,5 Massenprozent). Fast unerschöpflich sind die Vorkommen an Salzen der Salzsäure, als Steinsalz und gelöst im Meerwasser.
Gewinnung und Darstellung
Hergestellt wird Salzsäure im Labor aus konzentrierter Schwefelsäure und Kochsalz (daher der Name). Dabei entsteht Chlorwasserstoffgas, das anschließend in Wasser eingeleitet wird:
Die Schwefelsäure verdrängt den Chlorwasserstoff aus seinem Salz und da der Chlorwasserstoff gasförmig ist, verschwindet er ständig aus dem Gleichgewicht. Das entstandene Sulfat ist Natriumhydrogensulfat, ein saures Salz.
In der chemischen Industrie wird hochreiner Chlorwasserstoff durch die Verbrennung von Chlorknallgas (ein Gemisch aus Wasserstoff und Chlor) gewonnen.
Um die Säure darzustellen, lässt man das Chlorwasserstoffgas mit Wasser reagieren:
Technisch reine Salzsäure fällt hauptsächlich als Nebenprodukt bei der Chlorierung organischer Verbindungen an.
Eigenschaften
% HCl g HCl/l Molarität Dichte 10,5 110 3,06 1,050 15,5 166 4,61 1,075 20,4 224 6,22 1,100 22,3 248 6,89 1,110 24,3 272 7,56 1,120 26,2 296 8,22 1,130 28,2 321 8,92 1,140 30,1 347 9,64 1,150 32,1 372 10,23 1,160 34,2 400 11,11 1,170 36,2 428 11,89 1,180 38,3 456 12,67 1,190 40,4 485 13,47 1,200 HCl-Gas löst sich bei 0 °C sehr gut in Wasser (wenn Wasser noch als flüssige Phase vorliegt) (815 g beziehungsweise 507 l in einem Liter). Dabei entsteht Wärme. Bei 25 °C enthält ein Liter gesättigte Salzsäure 825 g HCl (42,7 %).[2] Die Dichte der Lösung beträgt 1,20 g·cm−3. Die Konzentrationsabhängigkeit der Dichte ist in der nebenstehenden Tabelle gezeigt. Zwischen der Dichte und dem prozentualen Gehalt an HCl besteht ein zufälliger mathematischer Zusammenhang: Die verdoppelten Nachkommastellen entsprechen der Konzentration, z. B. 1,10 g·cm−3 ist die Dichte von 20-prozentiger Salzsäure.
Salzsäure mit Gehalten von über 36 Gewichtsprozent HCl wird auch als rauchende Salzsäure bezeichnet, da sich über offenen Gefäßen ein weißer Nebel bildet.
Reine Salzsäure kann ohne Rückstände verdampfen. Wird Salzsäure mit einem HCl-Gehalt von über 20 Gewichtsprozent erhitzt, so entweicht mehr HCl als Wasser, bis ein Gemisch von 20 % HCl und 80 % Wasser übrig bleibt, das man als Azeotrop bezeichnet. Der genaue Gehalt an HCl im Azeotrop bei 1013 mbar ist 20,17 %, der Siedepunkt liegt bei 110 °C. Enthält die Salzsäure dagegen weniger als 20,17% HCl, dann verdampft zunächst bevorzugt Wasser, bis das Azeotrop übrigbleibt.
In Wasser dissoziiert HCl vollständig, konzentrierte Salzsäure (32 %) hat einen pH-Wert von −1. An feuchter Luft bildet HCl-Gas einen Nebel aus feinen Salzsäure-Tröpfchen. Verdünnte Salzsäure ist ein guter elektrischer Leiter.
Reaktionen
Salzsäure löst die meisten Metalle mit Ausnahme der Edelmetalle, ferner z. B. nicht Tantal und (Germanium) unter Bildung von Chloriden und Wasserstoff, sofern diese nicht durch Passivierung geschützt sind.
Sie ist sehr gut geeignet zum Entrosten von Stahl, da Metalloxide mit Salzsäure zu Chloriden und Wasser reagieren:
Eine Mischung von Salzsäure und Salpetersäure wird Königswasser genannt, weil sie auch Gold, den "König der Metalle", zu lösen vermag. Dazu trägt neben der oxidierenden Wirkung des Nitrosylchlorids und des nascierenden Chlors auch die Verringerung der effektiven Goldionenkonzentration durch Komplexbildung bei:
Verwendung
Salzsäure hat große Bedeutung in der chemischen Industrie als anorganische Säure. Sie wird beispielsweise bei der Aufarbeitung von Erzen und Rohphosphat eingesetzt. Sie wird zur Stimulation von Erdöl- und Erdgas-Sonden (im Speziellen in Karbonatlagerstätten, aber auch in Sandsteinlagerstätten um z.B. Scale (CaCO3-Fällungen) zu entfernen, Gravelpack-Reinigungen, Skin-Removal (geschädigter Formation in Bohrlochsnähe) verwendet sowie in der Metallverarbeitung beim Beizen, Ätzen und Löten.
Salzsäure ist ein wichtiges Reagenz in der chemischen Analyse. Sie vermag eine Gruppe von Metallen durch Fällung von anderen Metallen abzutrennen. Anschließend können diese getrennt weiter analysiert werden (siehe; Salzsäuregruppe). Die Alkalimetrie ist ein weiteres Verwendungsgebiet von Salzsäure.
Als Lebensmittelzusatzstoff trägt Salzsäure die Bezeichnung E 507.
In der Pharmaindustrie wird Salzsäure benutzt, um basische in Wasser schlecht- oder unlösliche Arzneistoffe (Beispiele: Ciprofloxacin, Citalopram, Clenbuterol, Clindamycin, Dibenzepin) in besser lösliche Hydrochloride zu überführen.[4]
Biologische Bedeutung
Bei Mensch und Tier ist die Salzsäure ein Bestandteil des Magensaftes, wo sie unter anderem die Denaturierung von Proteinen bewirkt, aber auch zum Abtöten von Mikroorganismen vor Eintritt in das weitere Verdauungssystem dient.
Sicherheitshinweise
Der Kontakt mit der Haut führt zu Verätzungen. Die Dämpfe sind reizend. Bei Berührung mit den Augen diese sofort gründlich mit Wasser abspülen und einen Arzt konsultieren. Bei einem Unfall oder Unwohlsein soll man sofort einen Arzt hinzuziehen.
Nachweis
Salzsäure wird zum einen durch ihren Säurecharakter nachgewiesen. Ergänzend dazu identifiziert man das Chlorid-Anion in stark verdünnter Lösung durch eine Fällung mit Silbernitrat in Form von Silberchlorid:
Der entstandene weiße Niederschlag löst sich in Ammoniakwasser oder in konzentrierter Salzsäure unter Komplexbildung auf:
Wird Salzsäure bei Anwesenheit von Braunstein erhitzt, so entsteht Chlorgas:
Der prozentuale Gehalt einer Salzsäure wird durch Titration mit Natronlauge ermittelt (→ Acidimitrie, Maßanalyse). Fotometrisch lässt sich diese Bestimmung sowie die von Chloriden mit Hilfe des Quecksilbersalzes der Chloranilsäure durchführen. Der Gehalt an Salzsäure im Magensaft bestimmt man mit Günzburgs Reagenz.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Salzsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 16. Dez. 2007 (JavaScript erforderlich)
- ↑ a b Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie, 101. Aufl., S.460f., Gruyter 1995, ISBN 978-3-11-012641-9
- ↑ Eintrag zu CAS-Nr. 7647-01-0 im European chemical Substances Information System ESIS
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dietmar Reichert: Pharmaceutical Substances, 4. Auflage (2000), 2 Bände erschienen im Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
Weblinks
Halogenwasserstoffe: Fluorwasserstoff | Chlorwasserstoff | Bromwasserstoff | Iodwasserstoff | Astatwasserstoff
Halogenwasserstoffsäuren: Fluorwasserstoffsäure | Salzsäure | Bromwasserstoffsäure | Iodwasserstoffsäure
Wikimedia Foundation.

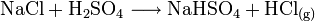
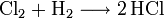
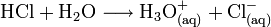
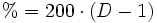
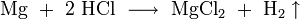
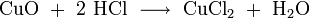
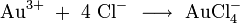
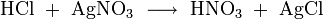
![\mathrm{AgCl\ + 2\ NH_3\ \longrightarrow\ [Ag(NH_3)_2]^+\ +\ Cl^-}](/pictures/dewiki/55/7163c7ebdc91881b7d123483943bdbc2.png)
![\mathrm{AgCl\ +\ HCl\ \longrightarrow\ [AgCl_2]^-\ +\ H^+}](/pictures/dewiki/51/3a6a2393236c8773a4f74556fd1e9134.png)