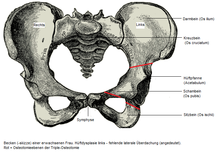
- Hüftgelenksarthrose
-
Klassifikation nach ICD-10 M16 Koxarthrose (Arthrose des Hüftgelenkes) M16.1 primäre Koxarthrose M16.3 dysplastische Koxarthrose ICD-10 online (WHO-Version 2011) Die Hüftgelenksarthrose (lat. Arthrosis deformans coxae; von altgriech. ἄρθρον arthron, „Gelenk“, lat. deformare, „verstümmeln“, und lat. coxa, „Hüfte“), auch Coxarthrose (dt. Koxarthrose), ist eine degenerative Erkrankung des Hüftgelenks, insbesondere im hohen Alter, der ein Verschleiß der Knorpeloberfläche von Hüftpfanne (Acetabulum) und Hüftkopf (Caput femoris) zu Grunde liegt. Sie ist die häufigste Form der Arthrose beim Menschen.
Ursachen für die Hüftgelenksarthrose können verschiedene (Vor-)Erkrankungen oder (Vor-)Verletzungen im Hüftgelenksbereich sein, bei circa einem Viertel aller Fälle kann jedoch keine genaue Ursache ausfindig gemacht werden. Charakterisierend für die Krankheit ist ein belastungsabhängiger Schmerz direkt im Hüftgelenk. Die Diagnose der Hüftgelenksarthrose erfolgt anhand von Röntgenbildern, die in der Regel sehr aussagekräftig sind und eine genaue Stadieneinteilung der Krankheit erlauben. In der Therapie dominiert der endoprothetische Hüftgelenksersatz, jährlich werden in der Bundesrepublik Deutschland über 150.000 Hüftgelenksoperationen durchgeführt. Eine begleitende konservative Schmerzbehandlung kann sowohl vor als auch nach der Operation hilfreich sein. Die Prognose nach erfolgtem operativen Eingriff ist sehr gut.
Für das Gesundheitssystem entstehen durch die Hüftgelenksarthrose erhebliche Kosten. Die Vergütung der Therapie erfolgt gemäß der geltenden Fallpauschalen und Sonderentgelte, welche die Gesamtkosten aber nicht gänzlich decken. International ist ein deutlicher Kostenunterschied zu beobachten, insbesondere der Implantate.
Inhaltsverzeichnis
Epidemiologie
Ungefähr 5 % der Erwachsenen in Deutschland im Alter von > 60 Jahren leiden an Beschwerden durch eine Hüftgelenksarthrose. Die Prävalenz für eine klinisch-symptomatische Coxarthrose beträgt 5 % für Männer und 5–6 % für Frauen.[1] Damit ist sie, noch vor der Kniegelenksarthrose, die häufigste Form der Arthrose beim Menschen. Jährlich werden in Deutschland ca. 100.000–150.000 Hüftprothesen wegen einer Coxarthrose implantiert.[2][3]
Risikofaktoren
Die Ergebnisse der Ulmer Osteoarthrose-Studie lassen vermuten, dass es einen unabhängigen Zusammenhang gibt zwischen zunehmendem Alter, Diabetes mellitus, einer Gelenkvorerkrankung oder -verletzung auf der Gegenseite (kontralateral) und der Prävalenz einer beidseitigen (bilateralen) Coxarthrose. Bei einer Coxarthrose auf einer Seite (unilateral) wurde ein deutlicher Zusammenhang mit Gelenkvorerkrankungen und -verletzungen festgestellt. Risikofaktoren für den Befall mehrerer Gelenke (polyartikulär) sind Gelenkvorerkrankungen bzw. -verletzungen, hohes Alter, weibliches Geschlecht sowie Gicht. Gelenkspezifische Risikofaktoren sind angeborene oder durch Verletzungen verursachte Veränderungen.[4]
Pathophysiologie
Arthrosen sind generell an den unteren Extremitäten häufiger vorzufinden als an den oberen, da diese beim Gehen und Stehen das ganze Körpergewicht tragen. Die Statik und Kinetik des aufrechten Ganges stellen dabei deutlich andere Anforderungen an das Gelenk als die Fortbewegung auf vier Beinen.
Im Vordergrund der pathophysiologischen Prozesse, die zum Krankheitsbild der Coxarthrose führen, steht zunächst der Knorpelschaden am Hüftgelenk. Die anschließende, großflächige Knorpelzerstörung, vor allem im Bereich der größten Druckbelastung, führt schließlich zur völligen Freilegung der Knochenfläche am Gelenk. Vereinfacht kann zusammengefasst werden:
- abhängig von der Nutzungsdauer (d. h. Lebensalter) kommt es früher oder später zu Verschleißvorgängen. Die Knorpelschicht des Gelenkes wird abgerieben und dadurch dünner.
- der unter dem Knorpel gelegene Knochen wird vermehrter mechanischer Beanspruchung ausgesetzt und reagiert mit einer Verdichtung seiner Binnenstruktur (subchondrale Sklerosierung).
- im weiteren Verlauf wird das Gelenk verformt (deformierenden Arthrose) und der unter dem Knorpel gelegene Knochen wird löcherig (Geröllzysten).
- um die Druckauffangzone zu verbreitern, baut der Körper Knochenmaterial an, mit dem die Hüftpfanne verbreitert wird (Osteophyten). Der Hüftkopf weist dann keine Kugelform mehr auf (präarthrotische Deformität), es kommt zu Gelenkschmerzen, Gelenksteifigkeit, sowie zu einer Einschränkung des Bewegungsumfangs.
Diese vereinfachte Vorstellung, die von einer reinen „Verschleißerscheinung“ ausgeht (sog. „wear and tear concept“), wird in der neuern Forschung differenzierter betrachtet. Heute wird die Coxarthrose – wie alle Arthrosen – als ein Krankheitsprozess verstanden, dem ein Ungleichgewicht zwischen gelenkschädigenden und heilenden (reparativen) Mechanismen zu Grunde liegt. Überwiegen Fehlbelastung, destruktive Mechanismen oder überschießende Reparationsvorgänge, entwickelt sich das Bild der Arthrose – in diesem Fall der Coxarthrose.[5]
Ursachen
Die Ursachen der Coxarthrose sind vielfältig und werden grundsätzlich in zwei Gruppen eingeteilt: die primäre Coxarthrose (ca. 20–25 % der Fälle) und die sekundären Coxarthrosen (ca. 75–80 % der Fälle).[3]
Primäre Ursachen
Bei den meisten Patienten im Alter von > 50 Jahren kann keine genaue Ursache für den Gelenkverschleiß festgestellt werden. Den Beschwerden liegt eine anlagebedingte Minderwertigkeit des Gelenkknorpels ohne jegliche Vorerkrankung zu Grunde,[6] die sich im hohen Alter aufgrund des oben beschriebenen natürlichen Abriebs bemerkbar macht. Man spricht dann von einer ideopathischen oder primären Coxarthrose.[7]
Sekundäre Ursachen
Gelenkschäden und -deformitäten, meist im Kindesalter, sind eine weitere Ursache für die Coxarthrose. Diese führen aufgrund der nicht normal ausgebildeten oder zerstörten Gelenkfächen zu einer Verkleinerung der Kontaktflächen des Gelenks und damit zu einem erhöhten Belastungsdruck.[7] Diese führt dazu, dass das Gelenk „wie ein defekter Motor unrund“ läuft und so die Verschleißbildung beschleunigt.[6] Dadurch bildet sich bei den betroffenen Patienten die Arthrose auch wesentlich früher aus als bei der primären Form. Zu diesen sekundären Ursachen der Coxarthrose gehören:
- beschleunigte Abnutzungserscheinungen (beispielsweise durch Übergewicht)
- anlagebedingte Fehlformen wie Hüftdysplasien („Dysplasiecoxarthrose“), Coxa vara bzw. -valga oder Durchblutungsstörungen des Hüftkopfes
- kindliche Hüfterkrankungen, zum Beispiel Morbus Perthes (→ Hüftkopfnekrose) oder Epiphyseolysis capitis femoris (jugendliche Hüftkopflösung)
- Trauma (posttraumatische Coxarthrose, meist Folge einer Azetabulumfraktur bei schweren Verkehrsunfällen, insbesondere bei Stufenbildung in der Gelenkfläche)[8]
Seltene Ursachen sind des Weiteren:[9]
- auf dem Blutweg übertragene Infektionen des Knochens (Hämatogene Osteomyelitis)
- entzündliche Gelenkerkrankungen oder rheumatische Erkrankungen im weiteren Sinne
Symptome
Typisches Symptom der Coxarthrose bei älteren Menschen ist ein belastungsabhängiger Schmerz, der hauptsächlich von der Begleitsynovitis verursacht wird, aber nicht obligat ist.[6] Differentialdiagnostisch kann das Schmerzgeschehen aber der Unterscheidung der Coxarthrose von den entzündlichen Gelenkerkrankungen dienen, die typischerweise belastungsunabhängige Schmerzen verursachen.[10]
Die Beschwerden werden direkt im Hüftgelenk empfunden. Typischerweise sind die meisten Patienten nach einem morgendlichen Einlaufschmerz zunächst beschwerdefrei, bis die Beschwerden, entsprechend der täglichen Gelenkbelastung, zum Abend hin wieder stark zunehmen. Die Schmerzcharakteristik wird von betroffenen Patienten als „bohrend“ oder „dumpf“ beschrieben. Im Laufe der Jahre nehmen die Beschwerden kontinuierlich zu. Zwischendurch können auch Phasen vorübergehender, schubartiger Verschlimmerungen vorkommen, die als aktive oder dekompensierte Arthrose bezeichnet werden. Eine gewisse Bewegungseinschränkung im Hüftgelenk kann mit der Krankheit assoziiert sein, ist aber nicht die Regel. Typischerweise kommen bei der Coxarthrose keine Gelenkschwellungen, Blockierungen oder Instabilität im Hüftgelenk vor.[11]
Diagnostik
Die Diagnose einer Coxarthrose wird, nach klinischer Untersuchung durch den behandelnden Arzt, vorrangig nach dem Befund der Röntgenuntersuchung gestellt.
Körperliche Untersuchung
Die Inspektion ist in der Regel wenig auffällig, besonders beim liegenden Patienten. Häufig fällt im Gangbild ein Entlastungshinken und eine Außenrotation des Fußes auf der betroffenen Seite (ca. 10–20°) auf. Die Standphase kann dadurch verkürzt sein. Bei der Palpation steht typischerweise ein direkt am Leistenband (Ligamentum inguinale) lokalisierter Druckschmerz im Vordergrund, seltener auch über dem großen Rollhügel (Trochanter major) an der Außenseite der Hüfte. Die Druckschmerzhaftigkeit an der Außenseite wird durch die Überlastung der Gesäßmuskulatur verursacht, der eine gestörte Gelenkmechanik zu Grunde liegt.[11]
Differenzialdiagnosen
Die oben genannten Beschwerden können allerdings auch durch andere Prozesse und Erkrankungen verursacht werden, die bei zweifelhaftem Befund differentialdiagnostisch ausgeschlossen werden müssen. Zu diesen gehören:[12][13]
- Erkrankungen der Lendenwirbelsäule: durch Nervenwurzelreizung oder pseudoradikuläre Symptomatik können Schmerzen verursacht werden, die in die Hüfte ausstrahlen. Wegweisend für die Coxarthrose ist hierbei der Druckschmerz in der Leiste (im Gegensatz zu einem Druck- oder Klopfschmerz an der Lendenwirbelsäule).
- Hüftkopfnekrose: kommt besonders bei Männern zwischen dem 40. und 60. Lebensjahr vor. Die Unterscheidung erfolgt vorrangig am Röntgenbild.
- Entzündliche systemische Erkrankungen: besonders die Rheumatoide Arthritis und der Morbus Bechterew befallen das Hüftgelenk. Im Gegensatz zur Coxarthrose beklagen die Patienten aber eine ausgeprägte Morgensteifigkeit. Für die weitere Diagnostik spielen hier Entzündungswerte im Blut sowie die Rheumaserologie eine wichtige Rolle.
- Beschwerden in der Leistenregion: können durch Leisten- und Schenkelhernien verursacht werden, sind aber schon in der klinischen Untersuchung leicht von der Coxarthrose zu unterscheiden.
Röntgendiagnostik
Die Domäne der Arthrose-Diagnostik ist das Röntgenbild. Gebräuchliche Aufnahmemethoden sind die Aufnahme im a.p.-Strahlengang, die sehr aussagekräftig ist, sowie die Lauenstein-Projektion, die vor allem der seitlichen Darstellung des proximalen Oberschenkelknochens dient. Letztere erfolgt im a.p.-Strahlengang, das Bein ist abgespreizt und 90° nach außen gedreht.[14]
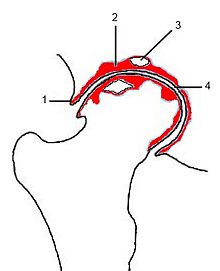
Durch die oben aufgeführten Aufnahmemethoden sind in der Regel alle radiologischen Zeichen der Coxarthrose darstellbar.[15][6] Diese sind:
- Gelenkspaltverschmälerung: anfänglich im Hauptbelastungsbereich, breitet sich in der Folge über den gesamten Gelenkspalt aus
- Geröllzysten: werden besonders kranial der Hüftpfanne sehr groß und verursachen die Inkongruenz der Gelenkfläche
- subchondrale Sklerosierung: besonders die Hüftpfanne ist betroffen
- Osteophyten: besonders lateral-kranial und medial-kaudal an der Hüftpfanne (Azetabulum); seltener am Oberschenkelknochenkopf („capital drop“)
Die radiologischen Zeichen der Coxarthrose sind zwar sehr zuverlässig (Sensitivität 89 %, die Spezifität 91 %),[16] müssen allerdings nicht mit dem Ausmaß der Hüftbeschwerden und mit dem klinischen Befund korrelieren.
Das Röntgenbild kann auch Auskunft über präarthrotische Deformitäten als Ursache der Coxarthrose geben.[17] Beispielsweise ist bei einer Hüftdysplasie (vgl. Abb.) der Hüftkopf nicht hinreichend überdacht und deswegen nach oben ausgewandert. Hieraus resultiert eine Beinverkürzung (in der Abb. ca. 6 cm). Im Laufe der Zeit kommt es zu einer massiven „Entrundung“ des Hüftkopfes, der Gelenkspalt ist fast ganz aufgehoben, das Hüftgelenk wird steif.
Zur Differentialdiagnostik und Therapieplanung empfiehlt die Deutsche Gesellschaft für Orthopädie und Orthopädische Chirurgie (DGOOC) zusätzlich eine Beckenübersichtsaufnahme sowie, falls erforderlich, weitere Röntgenaufnahmen.[15]
Weiterführende bildgebende Verfahren, wie etwa Magnetresonanztomographie, Computertomographie, Szintigraphie oder Sonographie, sind in der Regel nicht erforderlich. Die Sonographie kann aber im Falle einer „Kapseldistension“ (Kapsellockerung) im Hüftgelenk, die durch einen Erguss im Gelenk entsteht, als Untersuchungsmethode sehr hilfreich sein.[15]
Einteilung
Die Deutsche Gesellschaft für Orthopädie und Orthopädische Chirurgie (DGOOC) empfiehlt zwei Arten der Stadieneinteilung für die Coxarthrose – eine radiologische und eine klinische. Diese dienen in erster Linie der Beurteilung von Behandlungsergebnissen sowie Verlaufskontrollen im Rahmen klinischer Studien. Als primäre Schemata für die Therapieentscheidung sind sie nicht geeignet.[18]
Radiologische Stadieneinteilung
Für die radiologische Stadieneinteilung wird die Klassifikation nach Kellgren und Lawrence („K & L“-Score; 1963) empfohlen, die die Arthrose in vier Stadien einteilt:[18][19]
Grad Beurteilung Befund 0 normal keine radiologischen Zeichen der Coxarthrose 1 Verdacht auf Coxarthrose kleine Osteophyten, unklare Relevanz 2 geringfügige Coxarthrose Osteophyten, Gelenkspalt normal 3 mäßige Coxarthrose leichte Gelenkspaltverschmälerung, Geröllzysten 4 schwere Coxarthrose ausgeprägte Gelenkspaltverschmälerung, subchondrale Sklerosierung, knöcherne Deformierungen des Hüftgelenkes Bei Befunden größer als Grad 2 wird in der Regel die Diagnose einer Coxarthrose gestellt.[19] Weil der Nachweis von Osteophyten nicht zwangsweise mit dem klinischen Erscheinungsbild der Coxarthrose korreliert, ist die Klassifikation nach Kellgren und Lawrence nicht unumstritten.[20]
Klinische Stadieneinteilung
Für die klinische Stadieneinteilung der Coxarthrose werden folgende Scores empfohlen:[18]
- Western Ontario Mac Master Arthritis Center (WOMAC) Arthrose-Index nach Bellamy und Buchanan (1986)
- Harris Hip Score (1969)
- Score nach Merle d'Aubignè (umfasst 7 Schweregrade)
- Score nach Lequesne et al. (1987; umfasst den klinischen Schweregrad der Coxarthrose, die Aktivitäten des täglichen Lebens, die maximale Gehstrecke sowie den Schmerz in Dauer und Qualität)
- SF-36-Fragebogen (dient neben der Erhebung klinisch-anamnestischer und sozialmedizinischer Parameter auch der Analyse der Lebensqualität der betroffenen Patienten)
Therapie
Konservative Therapie
 Die Unterarmgehstütze ist eine leitlinienkonforme Maßnahme der Orthopädietechnik bei Coxarthrose.
Die Unterarmgehstütze ist eine leitlinienkonforme Maßnahme der Orthopädietechnik bei Coxarthrose.
Eine kausale konservative Therapie der Coxarthrose ist bisher nicht möglich.[21] Ziel der konservativen Therapie ist daher die Schmerzlinderung sowie die mechanische Entlastung des betroffenen Hüftgelenks.
Zur Entlastung des Gelenks kann ein Gehstock eingesetzt werden, welcher auf der gesunden Seite gehalten wird. Auch Orthesen, z. B. in Form von weichen Absätzen („Pufferabsatz“), können die Belastung erheblich senken. Bei Adipositas sollte eine Gewichtsabnahme angestrebt werden.[3]
Gleichzeitig sollten durch physiotherapeutische Maßnahmen die Mobilität des Patienten gefördert und Kontrakturen verhindert werden. Durch die physikalische Therapie – d. h. Hydrotherapie (z. B. Bäder), Wärmetherapie (z. B. Moorbad), Phototherapie, etc. – kann zusätzlich (und begleitend) ein Muskel entspannender und Schmerz lindernder Effekt erzielt werden.[22]
Die medikamentöse Schmerzlinderung erfolgt hauptsächlich durch den Einsatz oraler nichtsteroidaler Antiphlogistika (aus der Gruppe der COX-2-Inhibitoren). Diese sollte jedoch aufgrund der gastrointestinalen Nebenwirkungen nicht über einen langen Zeitraum regelmäßig eingenommen werden. Kortikosteroidale Salben sind eine Alternative, jedoch deutlich schwächer in der Wirkung. In seltenen Fällen kann auch eine intraartikuläre Injektion in Betracht gezogen werden.[3]
Operative Therapie
Die operative Therapie ist bei einer röntgenologisch nachgewiesenen Coxarthrose mit erheblicher funktioneller Beeinträchtung sowie Beschwerden im Alltag und Beruf indiziert, insbesondere wenn die konservative Therapie nicht mehr ausreicht. Mittel der Wahl ist heute der endoprothetische Ersatz.[3] In seltenen Fällen kann, vor allem bei Gelenkflächeninkongruenz, auch eine gelenkerhaltende, hüftgelenksnahe Korrekturosteotomie in Betracht gezogen werden.[23]
Endoprothese
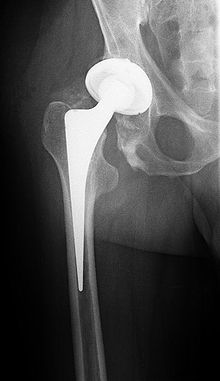
Der endoprothetische Ersatz des Hüftgelenks ist die mit Abstand häufigste operative Therapiemaßnahme. Dabei werden normalerweise sowohl der Femurkopf als auch die Hüftpfanne ersetzt, man spricht daher von einer Totalendoprothese (TEP). Die Prothese kann dabei im Knochen durch Knochenzement verankert oder durch eine spezielle poröse Oberfläche ohne Zement fixiert sein.[3][23]
Zementfreie Prothese
Bei der zementfreien Prothese wird die Prothese durch eine spezielle, poröse Oberfläche („Spongiosametall“) im Knochen verankert („pressfit“), in die der Knochen einwachsen kann. Der Vorteil ist vor allem die lange Haltbarkeit. Auch ist im Falle einer Lockerung die zementfreie Prothese in der Regel wesentlich einfacher zu entfernen als die zementierte. Nachteilig ist vor allem die langsame Mobilisierung der Patienten: anfänglich muss für 2–4 Wochen das Bein entlastet werden (20 kg), danach ist für weitere 2–8 Wochen eine Teilbelastung erforderlich, damit der Knochen einwachsen kann.[3] Daraus ergibt sich vorrangig eine Indikation für jüngere Patienten (< 65 J.).
Zementierte Prothese
Bei einer zementierten Prothese wird der Prothesenstiel durch eine selbsthärtende Plastikmasse – Polymethylmethacrylat (PMMA) – im Femurschaft befestigt. Die Pfanne besteht in der Regel aus Polyethylen und wird ebenfalls mit PMMA fixiert. Die − ebenfalls gebräuchliche − Kombination aus zementiertem Schaft und zementfrei implantierter Pfanne wird als Hybridsystem bezeichnet. Der große Vorteil der zementierten Endoporthese liegt in der sofortigen Belastbarkeit und der daraus resultierenden frühen Mobilisation der Patienten. Deswegen ist diese Methode vor allem bei älteren Menschen (> 65 J.) indiziert. Nachteile sind in allererster Linie eine eventuelle Allergie gegen den Knochenzement sowie die Gefahr der (aseptischen) Prothesenlockerung.[3] Des Weiteren kommt es in seltenen Fällen (0,6−10 %) beim Einbringen des Knochenzementes zu einer Fettembolie mit akutem Kreislaufkollaps bis hin zum Tod durch irreversiblen Herz-Kreislauf-Stillstand (0,2−0,6 %). Diese oft dramatische Komplikation konnte beim Einsetzen nicht zementierter Prothesen nur in Einzelfällen beobachtet werden.[24]
Hüftgelenksnahe Osteotomie
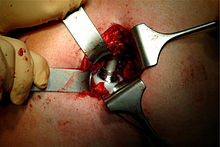 Minimal-invasive Hüftgelenk-Operation mit implantierter Endoprothese: Durch den etwa 7 cm großen sogenannten dorsolateralen Zugang zum Hüftgelenk sieht man das Hüftpfannen-Inlay aus Polyethylen (weiß) und darin den Endoprothesen-Kopf.
Minimal-invasive Hüftgelenk-Operation mit implantierter Endoprothese: Durch den etwa 7 cm großen sogenannten dorsolateralen Zugang zum Hüftgelenk sieht man das Hüftpfannen-Inlay aus Polyethylen (weiß) und darin den Endoprothesen-Kopf.
Die hüftgelenksnahe Osteotomie findet vor allem Verwendung bei der Therapie kindlicher Hüftgelenkserkrankungen. Die Operation findet in der Regel schon im Kindesalter oder in der frühen Jugend statt, um der Entwicklung einer Coxarthrose zuvorzukommen. Ziel dieser Methode ist sowohl die Beschwerdelinderung als auch die Verhinderung des weiteren Fortschreitens der Coxarthrose. Gängige Verfahren sind:[23]
- Triple-Osteotomie: Durchtrennung von Darmbein, Sitzbein und Schambein und anschließend die Drehung der Hüftpfanne
- Salter-Osteotomie: Durchtrennung des Darmbeins und „Herunterschwenken“ des Pfannendachs
- Chiari-Osteotomie: Durchtrennung des Darmbeins oberhalb der Pfanne und Schaffung eines künstlichen Pfannendachs durch Verschiebung des Azetabulums
Bei Deformitäten am proximalen Femur ist die sogenannte intertrochantäre Derotationsvarisierungsosteotomie (DVO) Mittel der Wahl.[23]
Risiken einer Operation
Die Implantation eines künstlichen Hüftgelenkes ist mit den generellen Risiken eines mittleren operativen Eingriffs verbunden.[3]
Tiefe Bein- oder Beckenvenenthrombosen sind auch bei Anwendung der üblichen Prophylaxe keine seltenen Komplikationen. Sie hinterlassen nicht nur teils erhebliche Folgeschäden am betroffenen Bein (postthrombotisches Syndrom), sondern können auch zu Lungenembolien führen, gelegentlich mit tödlichem Ausgang.
Bakterielle Infektionen können durch Kontamination während des Eingriffs oder auch durch Streuung von Bakterien über die Blutbahn („hämatogene Aussaat“) ausgelöst werden. Die Folgen reichen von der unkomplizierten oberflächlichen Wundinfektion, die durch lokale Maßnahmen rasch zum Abklingen gebracht werden kann, bis zur tiefen Protheseninfektion, die den Ausbau der Prothese und die vorübergehende Schaffung einer Girdlestone-Situation erforderlich macht.
Der intraoperative Blutverlust, aber auch eine postoperative Nachblutung oder Hämatombildung, kann die Gabe von Erythrozytenkonzentraten erforderlich machen. Abgekapselte Blutergüsse (Hämatome) zwingen gelegentlich zur operativen Ausräumung. Verletzungen von Nerven und Blutgefäßen (insbesondere des Nervus femoralis und des Nervus ischiadicus sowie der Arteria femoralis) können durch sachgerechte Operationstechnik in aller Regel, aber nicht immer, vermieden werden. Der Nervus femoralis ist beim Zugang von vorne, der Nervus ischiadicus beim Zugang von hinten gefährdet. Meist handelt es sich jedoch nicht um eine Durchtrennung des Nervs, sondern um eine Quetschung beispielsweise durch Hakendruck; in solchen Fällen bestehen gute Aussichten auf eine vollständige Erholung des Nervs.
Das operierte Hüftgelenk hat nicht selten eine Neigung zur Ausrenkung (Luxation). Oft hilft hier die Anlage eines sogenannten „Quengelgipses“, der das Bein unter Bettruhe in Innenrotation hält. Nach Stabilisierung der Gelenkkapsel im Zuge der Wundheilung und Narbenbildung wird damit weiteren Luxationen vorgebeugt. Durch die Operation kann es zudem zu einer Beinlängendifferenz kommen, die durch entsprechende Sohlenerhöhung ausgeglichen werden muss.
Eine Implantatallergie gegen Bestandteile der Endoprothese kann ähnlich wie bei einer Infektion einen Austausch des künstlichen Gelenkes erforderlich machen (Revisionsoperation).[3]
Ein für den Eingriff spezifisches Risiko ist eine selten auftretende Absprengung des Trochanter major (des körpernahen Höckers des Oberschenkels), an dem unter anderen der für die Führung des Gelenkes wichtige Musculus gluteus medius ansetzt. Diese bedarf dann einer zusätzlichen Stabilisierung durch Verdrahtung oder Schrauben.
Bei circa 3 % der Patienten kommt es im Laufe von 10 Jahren zu einer sogenannten (aseptischen) Endoprothesenlockerung, die mit Schmerzen und eventuell entzündlichen Veränderungen einhergeht und eine Revisionsoperation mit einem Wechsel der Endoprothese erforderlich machen kann. Ein Implantatbruch ist nur sehr selten der Fall. Prothesenlockerungen nach mehr als 10 Jahren werden in der Regel nicht als Komplikationen, sondern als physiologische Vorgänge aufgefasst.[3]
Bei einigen Patienten kommt es in den ersten Monaten nach der Operation zu heterotoper Knochenbildung, einer periartikulären Ossifikation. Ohne geeignete Gegenmaßnahmen kann durch sie die – durch die Operation gewonnene – Beweglichkeit wieder eingeschränkt werden. Durch vorbeugende Röntgen-Bestrahlung des umliegenden Gewebes unmittelbar vor der Operation (in der Regel mit 7 Gy mittels eines Linearbeschleunigers) wird bei bekannten Risikopatienten die Knochenneubildung reduziert. Die postoperative Gabe eines geeigneten Entzündungshemmers (in der Regel Indometacin) ist heute dagegen aus dem gleichen Grunde Standard für fast alle Patienten.[25]
Prognose
Besonders die endoprothetische Versorgung hat eine sehr gute Langzeitprognose, circa 95 % der implantierten Endoprothesen sind auch nach 10 Jahren noch funktionstüchtig. Gemäß dem Swedish Hip Arthroplasty Register müssen selbst nach 26 Jahren 75 % der Hüftendoprothesen nicht ausgetauscht werden. Der gleichen Studie zufolge ist auch eine erneute Wechseloperation (Re-Revision) kaum wahrscheinlicher als eine Revision, denn nach zehn Jahren sind – statistisch – immer noch mehr als 80 % der Zweitprothesen implantiert.[26]
Kosten
Arthrosen sind mit erheblichen Kosten für das Gesundheitssystem verbunden. Erkrankungen des Muskel-Skelett-Systems nahmen 2008 mit 28,55 Mrd Euro (= 11,2 %), nach den Erkrankungen des Kreislaufsystems (2008: 36,97 Mrd Euro = 14,5 %) und den Erkrankungen des Verdauungssystems (34,81 Mrd Euro = 13,7 %), den drittgrößten Kostenfaktor für Behandlungen von Erkrankungen in Deutschland ein. Von den Kosten für Erkrankungen des Muskel-Skelett-Systems wurden in 2004 7,62 Mrd Euro für die Behandlung von Arthrose aufgewandt. Über 96 % der Kosten entfielen auf die Personengruppe der Menschen ab 45 Jahren, etwa zwei Drittel (67,8 %) auf Personen ab 65 Jahren.[27]
Die Behandlungskosten für den endoprothetischen Hüftgelenksersatz werden gemäß der geltenden Fallpauschalen und Sonderentgelte vergütet. Diese werden in Punktwerten angegeben, wobei Fallpauschalen die gesamten Behandlungskosten (einschließlich Operation und Krankenhausaufenthalt) und Sonderentgelte lediglich die operative Leistung abdecken. Die Gesamtpunkte errechnen sich aus der Summe der Punkte für Personal und der Punkte für Sachmittel. Für diese werden bundesweit länderspezifische Multiplikationsfaktoren vereinbart, um die jeweilige Vergütung zu errechnen. Allerdings werden einer Studie (an der Medizinischen Hochschule Hannover, 1997)[28] zufolge die klinischen Kosten nicht durch die Fallpauschalen gedeckt. Sie übersteigen demnach die Fallpauschalen bei Verwendung zementierter Prothesen in 5 % der Fälle und bei Verwendung unzementierter Prothesen in 9 % der Fälle. Als Hauptursache für diesen Unterschied werden die Implantatkosten genannt, wobei die unzementierten wesentlich teurer sind. Der Anteil der Implantatkosten an den gesamten klinischen Kosten beträgt 13–16 %. Die Implantatkosten liegen in Deutschland damit dennoch wesentlich niedriger als z. B. in England (17 %), in den USA (24 %) oder in Australien (20–50 %).[29]
Weblinks
Literatur
- Deutsche Gesellschaft für Orthopädie und Orthopädische Chirurgie (DGOOC): aktualisierte Leitlinie zur Behandlung von Koxarthrose, Stand: 11/2009 (PDF)
- J. Duparc et al.: Chirurgische Techniken in Orthopädie und Traumatologie – Beckenring und Hüfte (entspricht: Band VI). Lehmanns Sonderausgabe, Urban & Fischer Verlag, München, 2005. ISBN 3-86541-286-6.
- J. Krämer, J. Grifka, et al.: Orthopädie, 6. Auflage. Springer Verlag, Berlin, 2001. ISBN 3-540-41788-5.
- D. Lühmann, B. Hauschild, H. Raspe: Hüftgelenkendoprothetik bei Ostheoarthrose – Eine Verfahrensbewertung, Institut für Sozialmedizin, Medizinische Universität zu Lübeck, Nomos Verlagsgesellschaft, Lübeck, 2000. ISBN 3-7890-7039-4.
- M. Müller et al.: Chirurgie für Studium und Praxis, 9. Auflage. Medizinische Verlags- und Informationsdienste, Breisach a. Rh., 2009. ISBN 3-929851-08-3. S. 380ff.
- H. I. Roach, S. Tilley: The Pathogenesis of Osteoarthritis. In: Bone and Osteoarthritis, Band 4, Hrsg.: F. Bronner, M. C. Farach-Carson. Springer Verlag, 2007. ISBN 1-846-28513-5. S. 1-19
- N. Wülker et al.: Taschenlehrbuch Orthopädie und Unfallchirurgie, 1. Auflage. Thieme Verlag, Stuttgart, 2005. ISBN 3-13-129971-1.
Einzelnachweise
- ↑ Lühmann et al., 2000, S. 10
- ↑ Lühmann et al., 2000, S. 3
- ↑ a b c d e f g h i j k Müller, 2009, S. 385-86
- ↑ Lühmann et al., 2000, S. 11-12; vgl. Günther et al.: Klinische Epidemiologie von Hüft- und Kniegelenkarthrosen: Eine Übersicht über Ergebnisse der Ulmer Osteoarthrose-Studie, Zeitschrift für Rheumatologie, 2002, Vol. 61, Nr. 3, S. 244-249 (24 ref.)
- ↑ Lühmann et al., 2000, S. 8
- ↑ a b c d Krämer et al., 2001, S. 234
- ↑ a b Wülker, 2005, S. 13
- ↑ Müller, 2009, S. 382
- ↑ Wülker, 2005, S. 14
- ↑ Wülker, 2005, S. 1
- ↑ a b Wülker, 2005, S. 15
- ↑ Wülker, 2005, S. 18ff
- ↑ Wülker, 2005, S. 223
- ↑ Wülker, 2005, S. 16
- ↑ a b c DGOOC Leitlinie, Kap. 6
- ↑ vgl. R. Altman et al.: The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hip, Arthritis Rheum., 2001, 44(10):2449–2450
- ↑ Wülker, 2005, S. 17
- ↑ a b c DGOOC Leitlinie, Kap. 9
- ↑ a b Lühmann et al., 2000, S. 13-14; vgl. Sun et. al.: Inzidenz und Prävalenz der Cox- und Gonarthrose in der Allgemeinbevölkerung, Zeitschrift für Orthopädie, 1997, 135:184-192
- ↑ Croft et al.: Defining osteoarthritis of the hip for epidemiologic studies, American Journal of Epidemiology, 1990, 132(3):514-22
- ↑ Lühmann et al., 2000, S. 19
- ↑ Wülker, 2005, S. 19
- ↑ a b c d Wülker, 2005, S. 19-22; vgl. Millis et al.: Osteotomies about the hip in the prevention and treatment of osteoarthritis, Instructional Course Lectures, 1992, 41:145-54
- ↑ N. Aebli, R. Pitto, J. Krebs: Fettembolie – eine potentiell tödliche Komplikation während orthopädischen Eingriffen. In: Schweiz Med Forum. Nr. 5, 2005, S. 512–518 (hier online, PDF, 295 KB, abgerufen am 26. Juni 2011).
- ↑ J. Seufert: Präoperative Bestrahlung zur Prävention heterotoper Ossifikation nach Hüftgelenksendoprothese, Dissertation, Medizinische Fakultät der Universität Würzburg, Würzburg, 2004, S. 83ff (hier online, PDF, 292 KB, abgerufen am 28. Juni 2011)
- ↑ vgl. The Swedish Hip Arthroplasty Register: Annual Report 2005. Online publiziert.
- ↑ Statistisches Bundesamt (Hrsg.): Gesundheit. Krankheitskosten. 2002, 2004, 2006 und 2008. Statistische Bundesamt, Wiesbaden, 2010. (hier online, PDF, 534 KB, abgerufen am 5. Juli 2011)
- ↑ vgl. Könning et al.: Perioperative Kostenanalyse zementierter versus unzementierter Hüfttotalendoprothesen zum klinischen und ökonomischen Management, Z. Orthop. 135, 1997, 479 – 485
- ↑ Lühmann et al., 2000, S. 30-31

Bitte den Hinweis zu Gesundheitsthemen beachten! 
Dieser Artikel wurde am 14. Juli 2011 in dieser Version in die Liste der lesenswerten Artikel aufgenommen. Kategorien:- Krankheitsbild in Orthopädie und Unfallchirurgie
- Wikipedia:Lesenswert
Wikimedia Foundation.