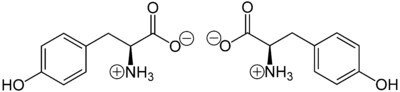
- L-Tyrosin
-
Strukturformel 

L-Tyrosin (links) und D-Tyrosin (rechts)Allgemeines Name Tyrosin Andere Namen - L-(−)-Tyrosin
- (S)-(−)-Tyrosin
- D-(+)-Tyrosin
- (R)-( +)-Tyrosin
- p-Hydroxyphenylalanin
- 2-Amino-3-(4-hydroxy- phenyl)-propionsäure
- Abkürzung:
- Tyr (Dreibuchstabencode)
- Y (Einbuchstabencode)
Summenformel C9H11NO3 CAS-Nummer - 60-18-4 (L-Tyrosin)
- 556-02-5 (D-Tyrosin)
PubChem 6057 DrugBank NUTR00059 Kurzbeschreibung farblose, seidig glänzende Nadeln [1] Eigenschaften Molare Masse 181,19 g·mol−1 Dichte 1,46 g·cm−3 (25 °C) [2]
Schmelzpunkt pKs-Wert Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tyrosin (Abk. Tyr oder Y) ist in seiner natürlichen L-Form eine nichtessentielle proteinogene α-Aminosäure, die in den meisten Proteinen vorkommt, in großen Mengen im Casein. Tyrosin ist Ausgangssubstanz für die Biosynthese von Catecholaminen, Melanin und Thyroxin.
Inhaltsverzeichnis
Vorkommen
L-Tyrosin wurde erstmalig aus Käse (gr. τυςόζ: Käse) isoliert, daher leitet sich auch der Name ab. L-Tyrosin kommt im Körper peptidisch gebunden in vielen Proteinen vor. Säugetiere können L-Tyrosin aus der essentiellen Aminosäure L-Phenylalanin biosynthetisch durch 4-Hydroxylierung am Phenylring erzeugen. Das Vorprodukt L-Phenylalanin wird mit der Nahrung aufgenommen.
Eigenschaften
Tyrosin kann – abhängig vom pH-Wert – als „inneres Salz“ bzw. Zwitterion vorliegen. Das Proton der Carboxylgruppe lagert sich hierbei an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe an:
Im elektrischen Feld wandern Zwitterionen nicht, da sie nach außen hin ungeladen sind. Es ist der isoelektrischen Punkt, der stets pH-Wert abhängig ist (bei Tyrosin ist es pH = 5,66; bei diesem pH-Wert ist Tyrosin in Wasser am geringsten löslich).
Herstellung und Gewinnung
Die saure Hydrolyse keratinhaltiger Proteine ergibt nach der Neutralisation ein Proteinhydrolysat, das aus den etwa 20 proteinogenen α-Aminosäuren besteht. Daraus lässt sich eine L-Cystein- und L-Tyrosin-reiche Fraktion einfach durch Abtrennung der gut wasserlöslichen Aminosäuren gewinnen, da L-Cystein- und L-Tyrosin sich nur wenig in Wasser lösen. Bis heute wird L-Tyrosin nach dieser einfachen Trennmethode kommerziell gewonnen[5].
Biogenese
Tyrosin entsteht durch Biopterin-abhängige Hydroxylierung von Phenylalanin. Das diese Reaktion katalysierende Enzym ist die Phenylalaninhydroxylase [6], eine Monooxygenase. Dabei wird ein Sauerstoffmolekül (O2) benötigt und bei dieser Reaktion entsteht ein Wassermolekül (H2O).
Funktionen
Im Nebennierenmark werden aus L-Tyrosin die Hormone Adrenalin und Noradrenalin gebildet und bei Bedarf direkt an das Blut abgegeben.
Die Bildung der Schilddrüsenhormone L-Triiodthyronin (T3) und L-Thyroxin (T4) im Colloid der Schilddrüse beruht ebenfalls auf Tyrosin-Untereinheiten.
Eine besondere Bedeutung hat das L-Tyrosin in Proteinen, die an Signaltransduktionsprozessen beteiligt sind. Es fungiert als Empfänger von Phosphat-Gruppen, die durch Proteinkinasen (sog. Rezeptor-Tyrosinkinasen) übertragen werden und das Zielprotein in seiner Aktivität verändern.
Außerdem spielt L-Tyrosin als im Protein gebundene Aminosäure eine wichtige Rolle in der Photosynthese, indem es im Photosystem II als Elektronendonor das oxidierte Chlorophyll reduziert. Es verliert hierbei zunächst das Proton seiner phenolischen OH-Gruppe, wird zu einem neutralen Radikal und wird dann vom im Photosystem II befindlichen vierkernigen Mangancluster wieder reduziert.
Abbau
Der Abbau von L-Tyrosin (para-Hydroxyphenylalanin) beginnt mit einer α-Ketoglutarat-abhängigen Transaminierung durch die L-Tyrosin-Transaminase [7] zu p-Hydroxyphenylpyruvat.
Den nächsten Schritt katalysiert die p-Hydroxylphenylpyruvat-Dioxygenase [8] unter Einbau von Sauerstoff und Abspaltung von CO2 zum Homogentisat (2,5-Dihydroxyphenyl-1-acetat). Um den aromatischen Ring des Homogentisats zu spalten, wird eine weitere Dioxygenase, die Homogentistat-Oxigenase [9], benötigt. Dabei entsteht durch Einlagerung eines weiteren O2-Moleküls das Maleylacetacetat.
Mit der Maleylacetacetat-cis-trans-Isomerase [10] entsteht in diesem Fall Fumarylacetat durch Rotation der durch Oxidation (aus der Hydroxylgruppe) entstanden Carboxylgruppe. Diese cis-trans-Isomerase enthält Glutathion als Koenzym. Fumarylacetacetat kann schließlich durch die Fumarylacetacetat-Hydrolase durch Wassereinlagerung gespalten werden.
Dabei werden Fumarat (auch ein Metabolit des Citrat-Zyklus) und Acetacetat (Butan-(3)-on-Säure) frei. Acetacetat ist ein Ketonkörper, welcher mit Succinyl-CoA aktiviert wird, und danach in zwei Moleküle Acetyl-CoA (für Citratzyklus und Fettsäuresynthese) umgesetzt werden kann.
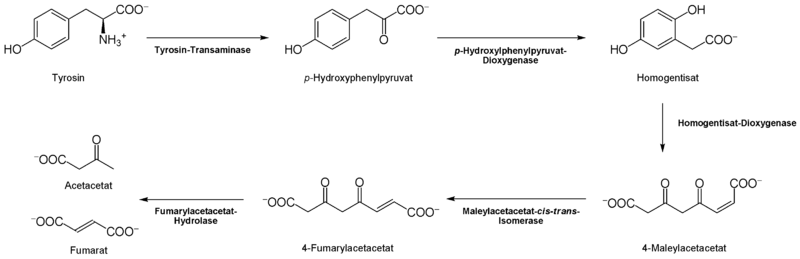 Der Abbau des L-Tryrosins in Acetacetat und Fumarat. Für den Abbauweg werden zwei Dioxygenasen benötigt. Die Endprodukte können in den Citratzyklus einfließen.
Der Abbau des L-Tryrosins in Acetacetat und Fumarat. Für den Abbauweg werden zwei Dioxygenasen benötigt. Die Endprodukte können in den Citratzyklus einfließen.Wirkungsweise im menschlichen Körper
L-Tyrosin hat als Ausgangsstoff für Neurotransmitter eine relativ stark aufhellende (stimmungssteigernde) Wirkung. Daher wird L-Tyrosin wie L-Phenylalanin auch, z. B. in der orthomolekularen Medizin als mildes Antidepressivum eingesetzt bzw. empfohlen. Zur Behandlung schwerer Depressionen ist L-Tyrosin allein nicht geeignet.
Tyrosin wird in einigen Fällen auch als unterstützender Bestandteil eines Alkoholentzuges eingesetzt. Durch die stimulierende Wirkung fühlt sich der Patient weniger niedergeschlagen und es vermindert das Verlangen nach Alkohol. Während es tagsüber stimmungsaufhellend wirkt, sorgt es während der Nacht für einen geregelten, ruhigen Schlaf. Allerdings ist die richtige Dosierung schwierig und sollte daher unter ärztlicher Aufsicht erfolgen. L-Tyrosin wird oftmals auch als Nahrungszusatz bei intensivem Muskeleinsatz vor allem bei Sportlern, in Form von Gelatine-Kapseln dem Körper zugeführt.
Krankheiten
Auch in Folge einer Phenylketonurie (PKU) kann es zu einem Mangel an L-Tyrosin kommen. Über Nahrung aufgenommenes L-Phenylalanin kann dabei nicht korrekt in der para-Stellung hydroxyliert werden, wobei L-Tyrosin entsteht. In diesem Fall muss L-Tyrosin dem Körper zugeführt werden, da es ansonsten zu einer Unterproduktion von Melanin (Albinismus) und L-Thyroxin (Kretinismus) kommt. Ebenso kommt andernfalls zu Problemen bei der Herstellung von Katecholaminen.
Weitere Eigenschaften
Isoliertes L-Tyrosin fluoresziert – wie viele andere aromatische Verbindungen – bei Anregung mit UV-Licht.
- van-der-Waals-Volumen: 141
- Hydrophobizitätsgrad: -1,3
Einzelnachweise
- ↑ a b c d Hermann Römpp, Jürgen Falbe und Manfred Regitz: Römpp Lexikon Chemie. 9. Auflage, Georg Thieme Verlag, Stuttgart, 1992.
- ↑ a b c Sicherheitsdatenblatt des Herstellers Merck
- ↑ a b Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1982, ISBN 3-527-25892-2, dort Seite 40.
- ↑ Tyrosin bei DrugBank
- ↑ Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Herstellung und Verwendung von Aminosäuren, Angewandte Chemie 90 (1978) 187-194.
- ↑ Eintrag im ExPASy Proteomics Server: EC 1.14.16.1
- ↑ Eintrag im ExPASy Proteomics Server: EC 2.6.1.5
- ↑ Eintrag im ExPASy Proteomics Server: EC 1.13.11.27
- ↑ Eintrag im ExPASy Proteomics Server: EC 1.13.11.5
- ↑ Eintrag im ExPASy Proteomics Server: EC 5.2.1.2
Literatur
- Berg/Tymoczko/Stryer: Biochemie, 5. Auflage, Spektrum Akademischer Verlag GmbH Heidelberg 2003, ISBN 3-8274-1303-6.
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.