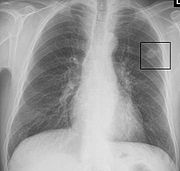
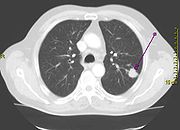
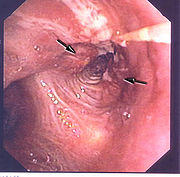
- Lungentumor
-
Klassifikation nach ICD-10 C34 Bösartige Neubildung der Bronchien und der Lunge C34.0 Hauptbronchus, Carina tracheae, Hilus C34.1 Oberlappen C34.2 Mittellappen C34.3 Unterlappen C34.8 Bronchus und Lunge, mehrere Teilbereiche überlappend C34.9 Lokalisation nicht näher bezeichnet ICD-10 online (WHO-Version 2006) Unter einem Bronchialkarzinom (auch: Lungenkarzinom, bronchogenes Karzinom, Lungenkrebs; engl.: bronchial carcinoma, lung cancer) versteht man eine bösartige Neubildung entarteter Zellen der Bronchien oder Bronchiolen. Das Bronchialkarzinom ist eine der häufigsten bösartigen Erkrankungen des Menschen.
Hauptursache ist das inhalative Tabakrauchen. Daneben gibt es einige Stoffe, die den Tumor auslösen können (beispielsweise Asbest oder Chrom), denen man beruflich bedingt ausgesetzt sein kann. Alle anderen Ursachen (wie zum Beispiel die Belastung durch die Umwelt) treten weit in den Hintergrund. Selbst das Lungenkrebsrisiko durch das natürlich vorkommende Edelgas Radon ist im Vergleich zum Tabakrauchen gering. Die Heilungsrate des Bronchialkarzinoms ist immer noch sehr schlecht und liegt bei einer Fünfjahresüberlebensrate unter zehn Prozent.
Lungenkrebs fordert mehr Opfer als Brustkrebs, Prostatakrebs und Dickdarmkrebs zusammen. Dies liegt vor allem am asymptomatischen Wachstum dieser Krebsform. Entwickelt der Patient die ersten Symptome (z.B. chronische Heiserkeit oder Bluthusten), ist es meist zu spät für eine erfolgreiche Therapie. Wenn aber Lungenkrebs frühzeitig (also meist per Zufall) entdeckt wird, ergibt sich laut American Cancer Society eine Überlebensrate von 47% [1]. Gleichzeitig ist die Röntgenaufnahme der Lunge mit 50% Anteil die am häufigsten durchgeführte Röntgenuntersuchung. Die zufällige Erkennung von Lungenkrebs im Frühstadium (Stage 1) im Röntgenbild ist allerdings schwierig. Es ist bekannt, dass Rundherde zwischen 5-10 mm leicht übersehen [2] werden können. Der Routineeinsatz von CAD-Systemen kann helfen, kleine Veränderungen ohne Anfangsverdacht zufällig und frühzeitig zu erkennen.
Allgemeines
25 Prozent aller bösartigen Tumore (Malignome) sind Bronchialkarzinome. Beim Mann ist es weltweit die häufigste Krebsart, in Deutschland die dritthäufigste nach dem Prostatakarzinom und dem kolorektalen Karzinom, jedoch liegt es als Ursache von Krebssterbefällen auf Platz eins[3]. Die Inzidenz in Mitteleuropa beträgt etwa 60 pro 100.000 Einwohner. Die Zahl der Neuerkrankungen (in Deutschland etwa 50.000 pro Jahr) weist eine steigende Tendenz auf. Unter den Todesursachen in Deutschland nimmt es mit rund 40.000 Todesfällen im Jahr die vierte Position ein, bei Männern gar die dritte.[4] Das Verhältnis von erkrankten Männern zu Frauen liegt bei etwa 3:1, wobei es wahrscheinlich auf Grund der Änderung im weiblichen Tabakkonsumverhalten immer mehr zu einer Angleichung kommen wird. Der Altersgipfel der Erkrankungen liegt um das 60. Lebensjahr. Die durchschnittliche 5-Jahres-Überlebensrate (d.h., wieviele Erkrankte nach 5 Jahren noch leben) beträgt lediglich 5 %. Die Lebenserwartung des einzelnen Patienten ist aber sehr stark vom Stadium der Erkrankung (TNM-Klassifikation) und dem Subtypus (siehe unten) abhängig.
Ursachen
Die Hauptursache bei der Entstehung des Tumorleidens ist der Tabakrauch. Er enthält etwa 2.000 Stoffe, von denen mindestens 100 krebserregend (karzinogen) sind (beispielsweise Teer und eine Vielzahl anderer Kohlenwasserstoffverbindungen). Es wurde nachgewiesen[5], dass das im Tabakrauch enthaltene Benzo(a)pyren das als Tumorsuppressor bekannte p53 schädigen kann. Auch die durch die Verbrennung entstehenden Sauerstoffradikale sind wahrscheinlich an der Entstehung von Lungenkarzinomen beteiligt. 95 Prozent aller Patienten mit Bronchialkarzinom sind Raucher. Passivrauchen erhöht nachgewiesenermaßen ebenfalls das Erkrankungsrisiko. 30 bis 40 Jahre nach Beginn des Rauchens ist das Erkrankungsrisiko bis 60-fach höher als beim Nichtraucher. Die sogenannte British Doctors Study belegte schon in den 1950er Jahren den Zusammenhang zwischen Lungenkrebs und Rauchen.
Genetische Untersuchungen von Lungengewebe zeigten, dass die Aktivität von Genen, die für die Reparatur der DNA zuständig sind und die Entwicklung von Lungenkrebs aufhalten sollen, selbst bei ehemaligen Rauchern dauerhaft herabgesetzt ist.[6]
Die zweithäufigste Ursache für ein Bronchialkarzinom ist das radioaktive Gas Radon. In Deutschland gibt es jährlich ca. 1.900 Lungenkrebstodesfälle, die auf die Belastung durch Radon zurückzuführen sind. Seine ebenfalls radioaktiven Radon-Zerfallsprodukte scheiden sich während der Inhalation in den Bronchien ab und reichern sich dort an. Sie bestrahlen das Gewebe mit biologisch sehr wirksamen Alphateilchen. In einigen Gegenden Deutschlands, u.a. im östlichen Bayern, in Sachsen und Thüringen sowie im Breisgau, wird empfohlen, den Keller gasdicht zu versiegeln, da durch das Gestein Radon aufsteigt. Die Weltgesundheitsorganisation WHO hat einen Zielwert von 100 Becquerel pro Kubikmeter Raumluft festgelegt. In der Schweiz gilt Radon als Verursacher von zehn Prozent aller Bronchialkarzinomfälle. Bei Uran-Bergarbeitern ist Lungenkrebs eine anerkannte Berufskrankheit.
Andere Giftstoffe wie Asbest, Uran, Chrom-Verbindungen, Senfgas, polyzyklische aromatische Kohlenwasserstoffe und Nickel gelten ebenfalls als karzinogen. Hierbei erhöht sich das Risiko einer Erkrankung um ein Vielfaches, wenn der Patient gleichzeitig Raucher ist. Bei Asbestexposition zum Beispiel erhöht sich das Erkrankungsrisiko von Nichtrauchern um das Fünffache, bei Rauchern um das Neunzigfache. Eine familiäre Häufung spricht für eine genetische Komponente. Chronisch-entzündliche Reizungen haben ebenfalls einen Einfluss auf die Entstehung von Bronchialkarzinomen. Sie können auch im Bereich alter Lungennarben entstehen, wie sie nach Tuberkulose, Silikose oder Lungeninfarkt auftreten.
Wie Ernährung und Lungenkrebs / Bronchialkarzinom zusammenhängen könnten: Im Rahmen der EPIC-Studie [7] wird seit 1992 bei über 500.000 anfangs gesunden Teilnehmern aus zehn europäischen Ländern das Essverhalten protokolliert. Außerdem werden Gewicht, Größe und Körperfettverteilung der Teilnehmer registriert und Blutuntersuchungen durchgeführt. Seit 15 Jahren werden alle neu aufgetretenen Krebsfälle und anderen chronischen Krankheiten erfasst und mit den Ernährungsgewohnheiten und dem Lebensstil assoziiert. Im Laufe der Jahre konnten so immer mehr Erkenntnisse über die Zusammensetzung einer „gesunden“ Ernährung gewonnen werden, die einen potenziellen Schutz vor Krebs und anderen Erkrankungen bieten könnte. Im April 2007 zogen Wissenschaftler der Studienzentren am Deutschen Krebsforschungszentrum[8] in Heidelberg und am Deutschen Institut für Ernährungsforschung (DIFE)[9] in Potsdam-Rehbrücke Bilanz: Ein hoher Obst- und Gemüseverzehr schützt vor Lungenkrebs und Krebs des oberen Verdauungstraktes. Vor allem Männer mit geringerem Konsum profitieren von einer Erhöhung auf 300 g Obst und Gemüse am Tag.[10]
Entstehung
Die Entstehung der Bronchialkarzinome ist sehr komplex und nicht ganz entschlüsselt. Hier eine Vereinfachung des gängigsten Entstehungsmodells: Die Reservezellen des Bronchialsystems sind pluripotent, das heißt, sie sind fähig, sich zu verschiedenen Zellen der Bronchialschleimhaut auszudifferenzieren, zum Beispiel zu Plattenepithelien, Becherzellen, CLARA-Zellen (schleimproduzierende Zellen der Bronchiolen) und neuroendokrinen Zellen. Nach chronisch-entzündlicher Reizung und Einwirkung von karzinogenen Noxen kann das Epithel mit einer Plattenepithelmetaplasie, einer Becherzellhyperplasie oder einer Entartung neuroendokriner Zellen reagieren, die die verschiedenen Subtypen von Bronchialkarzinomen bilden.
Pathologie der Subtypen
Histologische Klassifikation des Bronchialkarzinoms nach der Weltgesundheitsorganisation (WHO)
- Kleinzelliges Karzinom (SCLC): Oat-cell-Karzinom, Intermediärer Typ, Kombinierter Oat-cell-Typ
- Nichtkleinzelliges Karzinom (NSCLC)
- Plattenepithelkarzinom: spindelzellig
- Adenokarzinom: azinär, papillär, bronchiolo-alveolär, solide mit Schleimbildung
- großzelliges Karzinom: Riesenzellkarzinom, klarzelliges Karzinom
- Andere Karzinomarten: adenosquamöses Karzinom, Bronchialdrüsenkarzinom, Karzinoid
Kleinzelliges Bronchialkarzinom
Dieser auch Haferzellkarzinom oder oat cell carcinoma, im Klinikjargon auch Kleinzeller genannte Tumor macht 20 bis 25 Prozent der Bronchialkarzinome aus. Er geht von den neuroendokrinen APUD-Zellen (Zellen vom Kultschitzky-Typ) aus und siedelt sich meist zentral in der Lunge an. Frühe lymphogene (über Lymphabflussbahnen) und hämatogene (über Blutgefäße) Metastasierung führt dazu, dass sich in der Regel schon vor seiner Entdeckung Metastasen gebildet haben (vorzugsweise in Gehirn, Knochen, Leber und Nebennierenrinde). Ein bestehendes Lambert-Eaton-Rooke-Syndrom kann ein erster Hinweis auf den Tumor sein. Aufgrund ihres neuroendokrinen Ursprungs können die Zellen des kleinzelligen Bronchialkarzinoms Hormone bilden, die normalerweise nicht in der Lunge gebildet werden(Paraneoplasie) und Auswirkungen auf den ganzen Körper haben können (beispielsweise führt die Produktion von ACTH zum Morbus Cushing). Das kleinzellige Bronchialkarzinom hat eine sehr schlechte Prognose und ist praktisch inoperabel, palliative Therapie der Wahl ist die Chemotherapie. Die Einteilung des kleinzelligen Bronchialkarzinoms erfolgt in der Regel nicht nach der TNM-Klassifikation. Man unterscheidet stattdessen extensive und limited disease (nur auf den Thorax begrenzt) bzw. very limited disease (nur auf eine Thoraxhälfte begrenzt).
Plattenepithelkarzinom
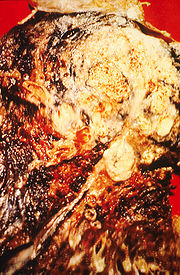
Das Plattenepithelkarzinom ist mit 25 bis 40 Prozent der häufigste Bronchialtumor. Er entsteht nach chronischer Schleimhautreizung aus einer Plattenepitheldysplasie. Häufig ist er an den Aufzweigungen der Subsegmentbronchien lokalisiert. Charakteristisch sind sein langsames Wachstum und seine frühe Metastasierung in die regionären Lymphknoten. Aussehen: Ulzerationen, Nekrosen, Blutungen und Zysten sind bei diesem grauweißlichen Tumor häufig. Histologisch unterscheidet man in einen verhornenden Typ und in einen nichtverhornenden Typ. Letzterer bringt auf Grund seiner geringeren Differenzierung eine schlechtere Prognose mit sich. Die 5-Jahres-Überlebenszeit beträgt je nach Stadium (TNM; AJCC)zwischen 20% und 1%.
Adenokarzinom
25 bis 40 Prozent der Lungenkarzinome sind Adenokarzinome. Sie entstehen aus schleimproduzierenden Zellen und entwickeln sich bevorzugt in Narbengewebe (z. B. alter Tuberkulose). Der Tumor liegt meist in der peripheren Lunge. Auch hier ist eine frühe Metastasierung typisch, die sowohl über die Lymphbahnen als auch über die Blutbahn erfolgt und zwar bevorzugt in das Gehirn, die Leber und die Nebennierenrinde. Histologisch sieht man vor allem Drüsenformationen. Eine besondere Rolle spielt das vergleichsweise seltene bronchioloalveoläre Karzinom. Diese Sonderform, die ungefähr ein bis neun Prozent der untersuchten Bronchialkarzinome ausmacht, wächst langsam und innerhalb der anatomischen Strukturen. Radiologisch wird er deshalb häufig mit einer Pneumonie verwechselt. Im Gegensatz zu anderen Bronchialkarzinomen besteht anscheinend kein ursächlicher Zusammenhang zu inhalativen Noxen.
Großzelliges Bronchialkarzinom
Sie machen 10 bis 15 Prozent der Bronchialkarzinome aus und sind immer eine Ausschlussdiagnose. Auch sie metastasieren hämatogen in Leber, Gehirn und Knochen. Großzellige Bronchialkarzinome sind wahrscheinlich entdifferenzierte Adeno- oder Plattenepithelkarzinome, die lichtmikroskopisch nicht mehr als solche erkannt werden können. Sie zeigen histologisch große Zellen mit großen Kernen, viel Zytoplasma und reichlich Nukleoli. Immunhistochemisch und elektronenmikroskopisch zeigen sie aber noch minimale Diffenzierungszeichen von Drüsen- oder Plattenepithel. Eine histologische Variante leitet sich wie das kleinzellige Bronchialkarzinom aus den neuroendokrinen Zellen ab und zeigt rosetten-, trabekel- oder nestförmiges Wachstum.
Sonstige
Die weiteren Karzinomarten sind selten und machen zusammen weniger als zehn Prozent der Bronchialkarzinome aus. Häufig gibt es auch Mischtypen. Außerdem gibt es sekundäre Metastasen anderer Tumoren in der Lunge.
Diagnostik
- Röntgen Thorax in zwei Ebenen
- CT-Thorax
- Bronchoskopie zur Histologiegewinnung
- Mediastinoskopie
- Positronen-Emissions-Tomographie (PET)
- Tumormarker: NSE, CYFRA 21-1
- beim kleinzelligen BC zusätzlich:
- CCT oder MRT-Kopf
- Sono-Abdomen zum Ausschluss von Leberfiliae
- CT-Abdomen zum Ausschluss von Leber- und Nebennierenmetastasen
- Knochenszintigraphie
Bei Verdacht auf ein Bronchialkarzinom werden Untersuchungen durchgeführt, die folgende Fragen beantworten sollen:
- Um welche Art von Tumor handelt es sich? Wie gut ist der Tumor differenziert (Grading)? (Artdiagnostik)
- Wie weit ist der Tumor fortgeschritten? (Ausbreitungsdiagnostik, Staging, TNM-Klassifikation)
- Welche Möglichkeiten der Operabilität im Hinblick auf die Erhaltung der Lungenfunktion bestehen? (Bestimmung der funktionellen Operabilität)
Trotz modernster Technologie der bildgebenden Verfahren ist die Vorhersagekraft der Computertomografie (CT) alleine zur Beurteilung mediastinaler Lymphknoten zur Stadieneinteilung nicht ausreichend, so dass hier der Mediastinoskopie eine große Bedeutung zukommt, falls im CT Lymphknoten von mehr als einem Zentimeter Durchmesser auffallen. Inwieweit die Positronen-Emissions-Tomographie (PET) die Mediastinoskopie ersetzen kann, ist gegenwärtig Ziel verschiedener Untersuchungen. Von besonderer Bedeutung ist die PET, wenn nach einer Induktionstherapie oder Voroperation im Bereich des Mediastinums tumorfreie (negative) mediastinale Lymphknoten über die Indikation zur Operation entscheiden, da die Mediastinoskopie in diesen Fällen eine eingeschränkte Treffsicherheit aufweist. Die Kombination der Aussagen zur Morphologie und Funktion der Lymphknoten mittels Fusion von CT und PET könnte hier weitere Fortschritte ermöglichen.
Kleinzelliges Bronchialkarzinom (SCLC)– Therapie
Die Abkürzung SCLC steht für Small Cell Lung Cancer (kleinzelliges Lungenkarzinom). Das kleinzellige Bronchialkarzinom ist bei Diagnosestellung in der Regel inoperabel (70%). Es spricht jedoch häufig gut auf eine Chemotherapie oder auch eine Strahlentherapie an (palliativ). Allerdings müssen sehr hohe Bestrahlungsdosen appliziert werden, um den Tumor nachhaltig zu zerstören (Tumorvernichtungsdosis 48-63 Gy). Bei kurativer Zielsetzung sollte zudem eine kraniale Bestrahlung erfolgen, um zerebrale Rezidive zu reduzieren. Durch die thorakale Bestrahlung > 40 Gy besteht ein kalkuliertes Risiko von 1/20, dass der Patient eine Lungenfibrose entwickelt, die mitunter tödlich enden kann. Weitere seltene Strahlenfolgen sind sowohl Myo-/Perikarditis als auch Myelitis, die mit einer Latenz von neun Monaten bis zu einem Jahr auftreten können. Damit kann eine Lebensverlängerung um einige Monate bis zu einem Jahr erreicht werden.
- Polychemotherapie
- ACO-Schema (Adriamycin + Cylophosphamid + Vincristin)
- CEV-Schema (Carboplatin + Etoposid + Vincristin)
- PE-Schema (Cisplatin + Etoposid)
- Cisplatin + Irinotecan
- Cisplatin + Etoposid
- Carboplatin + Etoposid
- bei Rezidiv Topotecan
- Bestrahlung Kombination der Bestrahlung und Chemotherapie
- Lungenbefund
- Schädel (prophylaktisch oder lokal bei Metastasen)
Nicht-kleinzelliges Bronchialkarzinom (NSCLC) - Therapieoptionen
Im Folgenden werden die Therapieoptionen für die einzelnen Tumorstadien aufgezeigt. Die Darstellung orientiert sich an den detaillierten Leitlinien der amerikanischen und europäischen Fachgesellschaften. Die Abkürzung NSCLC steht für Non Small Cell Lung Cancer (nicht-kleinzelliges Lungenkarzinom) und meint damit alle Lungentumore außer dem kleinzelligen Bronchialkarzinom (SCLC). Die Therapie des NSCLC ist aufgrund ständig zunehmender Erkenntnisse erheblichen Veränderungen ausgesetzt. Der folgende Überblick gibt deshalb nur einen ungefähren Eindruck der therapeutischen Möglichkeiten.
Das okkulte nicht-kleinzellige Lungenkarzinom
Das okkulte nicht-kleinzellige Lungenkarzinom ist durch die folgende klinische Stadieneinteilung definiert:
- TX, N1-3, M0
- TX, N0, M1 oder
- TX, N1-3, M1
„Okkult“ ist ein Bronchialkarzinom, wenn der Ursprungstumor nicht gefunden wurde und die Diagnose nur z. B. durch einen zytologischen Befund gestellt wurde. Die Diagnostik wird sich dann meist auf eine Röntgenaufnahme des Thorax und eine Bronchoskopie beschränken. Kurzfristige Nachuntersuchungen (z. B. mittels CT) sind erforderlich, da sich der Primärtumor im Verlauf der Erkrankung doch noch zeigen kann.
Tumoren, die auf diese Weise entdeckt worden sind, befinden sich meist noch in einem frühen Stadium. Durch eine rechtzeitige Operation und vollständige chirurgische Entfernung sind diese Tumoren heilbar. Falls der Primärtumor gefunden werden kann, gestaltet sich die weitere Behandlung abhängig vom genauen Tumorstadium des Patienten.
Patienten mit einem okkulten Bronchialkarzinom tragen ein erhöhtes Risiko für Karzinome an anderen Orten in der Lunge, so dass eine regelmäßige Nachsorge erforderlich ist.
NSCLC Stadium 0
Das Stadium 0 ist in der folgenden Staging-Gruppe beschrieben:
- Tis, N0, M0
Das NSCLC Stadium 0 entspricht dem Carcinoma in situ der Lunge. Diese Tumoren sind definiert durch ihr nicht-invasives Wachstum: Sie sind noch nicht in das umgebende Gewebe eingedrungen (Invasion) und haben noch nicht metastasiert. Deshalb sind die Chancen groß, dass ein solcher Tumor durch die chirurgische Entfernung geheilt werden kann.
Nicht selten finden sich aber in der Lunge von Patienten mit einem in-situ-Karzinom weitere, unabhängige (primäre) Karzinome, von denen viele nicht mehr zu operieren (»resektabel«) sind.
Bei wenigen als geeignet angesehenen Patienten wurde eine endoskopische Phototherapie mit einem Hämatoporphyrin-Derivat als mögliche Alternative zur chirurgischen Entfernung vorgeschlagen. Diese Behandlung, die derzeit in klinischer Erprobung ist, scheint am wirksamsten für sehr früh entdeckte zentral sitzende Tumoren zu sein, die sich weniger als einen Zentimeter in den Bronchus hinein erstrecken. Ob diese Behandlungsform wirklich geeignet ist, Lungenkrebs im frühen Stadium zu heilen, muss aber noch besser erforscht werden.
Standardbehandlung
Chirurgische Entfernung (Segment- oder Keilresektion) mit dem Ziel, möglichst viel Lungengewebe zu sparen. Patienten mit einem Carcinoma in situ der Lunge haben ein sehr hohes Risiko für weitere Lungentumoren, so dass weitere Operationen notwendig werden können.
Als experimentelle Behandlung kann man eine endoskopische photodynamische Therapie diskutieren.
NSCLC Stadium I
Das nicht-kleinzellige Bronchialkarzinom im Stadium I umfasst die folgenden klinischen Stadieneinteilungen:
- T1, N0, M0 -> IA
- T2, N0, M0 -> IB
Standard-Behandlung
Die übliche Behandlung im Stadium I ist die vollständige chirurgische Entfernung des Tumors. Wie vor jeder Operation muss der medizinische Allgemeinzustand des Patienten sorgfältig überprüft werden. Der Arzt muss dabei besonders auf die funktionelle Reserve der Lungen achten, um abzuschätzen, ob die chirurgische Behandlung einen Nutzen erwarten lässt. Der Tumorherd kann nur mit dem umgebenden Lungengewebe entfernt werden, so dass sich infolge der Operation auch die Vitalkapazität der Lunge verringert. Wenn die Lungenfunktion schon vor der Operation eingeschränkt ist, kann eine Operation schwierig oder unmöglich werden.
Behandlungsmöglichkeiten
- Lobektomie oder segmentale, Keil-, oder Manschettenresektion, wie angemessen.
- Strahlentherapie in kurativer Intention (für potentiell resektable Patienten mit medizinischen Kontraindikationen für eine Resektion).
- Klinische Studien zur adjuvanten Chemotherapie nach Resektion.
- Studien zur adjuvanten Chemoprävention.
- Endoskopische photodynamische Therapie (derzeit in klinischer Prüfung; besonders geeignet für ausgewählte Patienten im Stadium T1, N0, M0, keine Standardtherapie).
Operationsrisiko
Die unmittelbare postoperative Sterblichkeit hängt vom Alter ab, man muss aber mit einer Mortalität von drei bis fünf Prozent nach Lobektomie (Entfernung eines Lungenlappens) rechnen. Patienten mit eingeschränkter Lungenfunktion wird der Arzt eher eine Segment- oder Keilresektion des Tumors vorschlagen.
Belastungstests können helfen, Patienten mit eingeschränkter Lungenfunktion zu erkennen, die doch eine Lungenresektion tolerieren können. Die Verfügbarkeit der video-assistierten thorakalen Keilresektion erlaubt begrenzte Resektionen bei Patienten mit eingeschränkter Lungenfunktion, bei denen normalerweise keine Lobektomie durchgeführt werden kann.
Heilungschancen, Rezidivrisiko
Bei Patienten mit Lungenkrebs im Stadium I, die eine Lobektomie (Entfernung eines ganzen Lungenlappens) erhalten hatten, traten weniger oft Lokalrezidive (Wiederauftreten des Tumors an der Stelle des Ursprungstumors) auf als bei Patienten, bei denen nur eine begrenzte Resektion (Segment- oder Keilresektion) durchgeführt worden war. Bezüglich des Gesamtüberlebens konnten aber keine statistisch signifikanten Unterschiede festgestellt werden. Anderen wissenschaftlichen Untersuchungen zufolge besteht möglicherweise ein Überlebensvorteil für die Lobektomie bei Patienten, deren Tumor-Durchmesser größer als drei Zentimeter ist, nicht aber bei Tumoren, deren Durchmesser kleiner als drei Zentimeter ist. In jedem Fall war aber die Rate an Lokalrezidiven nach Lobektomie signifikant geringer, unabhängig von der Größe des Primärtumors.
Behandlungsmöglichkeiten bei inoperablen Patienten
Patienten mit inoperabler Erkrankung im Stadium I, die eine ausreichende Lungenreserve haben, können palliativ mit einer Strahlentherapie behandelt werden.
Bei Patienten, die älter als 70 Jahre waren und an einem prinzipiell operablen Tumor (< 4 cm) litten, jedoch aus medizinischen Gründen nicht operiert werden konnten oder nicht operiert werden wollten, war das 5-Jahres-Überleben nach Strahlentherapie vergleichbar mit der operativen Tumorentfernung.
In den zwei größten zu diesem Problem retrospektiv (erst nach Abschluss der Behandlung) dokumentierten Fallserien erreichten Patienten mit inoperabler Erkrankung, die eine Strahlentherapie erhalten hatten, 5-Jahres-Überlebensraten von 10 und 27 Prozent. In beiden Fallserien zeigte sich, dass Patienten mit T1, N0-Tumoren bessere Behandlungsergebnisse aufwiesen; in dieser Untergruppe wurden 5-Jahres-Überlebensraten von 60 und 32 Prozent dokumentiert.
Die Operation ergänzende (adjuvante) Therapie
Viele Patienten, die chirurgisch behandelt worden sind, entwickeln im Verlauf dennoch erneute Tumoren am Ort des Ursprungstumors oder Fernmetastasen. Diesen Patienten wäre vielleicht mit einer ergänzenden Strahlen- oder Chemotherapie unmittelbar nach der Operation besser zu helfen.
Eine zusammenfassende Analyse (Metaanalyse) der bislang zu diesem Thema vorliegenden wissenschaftlichen Studien verglich die postoperative Strahlentherapie mit der alleinigen Operation. Es zeigte bei Patienten mit Bronchialkarzinom im Stadium I oder II ein um sieben Prozent geringeres (!) Gesamtüberleben bei adjuvanter Strahlentherapie. Einschränkend muss man zu diesen Daten sagen, dass unklar ist, ob die Ergebnisse mit moderner Strahlentherapie vielleicht besser ausgefallen wären. In den letzten Jahren hat sich die Technik der Strahlentherapie sehr verbessert. Es gelingt heute besser als mit den älteren Geräten, das Zielvolumen der Bestrahlung auf den Tumor zu fokussieren und den Anteil des gesunden Gewebes im Strahlenfeld möglichst klein zu halten.
NSCLC Stadium II
Das NSCLC im Stadium II ist definiert durch die folgenden klinischen Stadiengruppen:
- T1, N1, M0
- T2, N1, M0
- T3, N0, M0
Behandlung der Wahl für Patienten mit NSCLC im Stadium II ist die Operation. Vor der Operation ist es erforderlich, den medizinischen Allgemeinzustand des Patienten sorgfältig zu überprüfen. Besonders wichtig ist das Abschätzen der funktionellen Reserve der Lungen. Hiervon hängt ab, ob die chirurgische Behandlung einen Nutzen bringen kann. Die unmittelbare postoperative Sterblichkeit (das Risiko, an Komplikationen der Operation zu versterben) hängt vom Alter ab. Man muss mit einer Mortalität von fünf bis acht Prozent nach Pneumonektomie und von drei bis fünf Prozent nach Lobektomie rechnen.
Patienten mit inoperablem Stadium II und ausreichender Lungenreserve können mit einer Strahlentherapie behandelt und hierdurch auch geheilt werden. Patienten in exzellentem Allgemeinzustand können mit einer 3-Jahres-Überlebensrate von bis zu 20 Prozent rechnen, wenn die Strahlentherapie wie geplant und mit dem Ziel, eine Heilung zu erreichen, durchgeführt werden konnte. In der bislang größten retrospektiven Fallserie wurden 152 Patienten mit aus medizinischen Gründen inoperablen NSCLC dokumentiert, die eine definitive Radiotherapie erhalten hatten. Die 5-Jahres-Gesamtüberlebensrate dieser Patienten erreichte 10%; die Patienten mit T1-Tumoren (44 von 152 Patienten) erreichten ein krankheitsfreies Überleben von 60%.
Standard–Behandlungsoptionen
- Lobektomie; Pneumonektomie oder segmentale, Keil-, oder Manschettenresektion je nach Einschätzung der Chirurgen.
- Strahlentherapie in kurativer Absicht (für potentiell operable Patienten die medizinische Kontraindikationen gegen eine Operation aufweisen).
- Klinische Studien zur adjuvanten Chemotherapie mit oder ohne andere Behandlungsarten (Chemo-, Strahlentherapie) nach kurativer Operation.
- Klinische Studien zur Strahlentherapie nach vollständiger Entfernung des sichtbaren Tumors.
NSCLC Stadium IIIA
Das NSCLC IIIA wird durch die folgenden klinischen Stadiengruppen definiert:
- T1, N2, M0
- T2, N2, M0
- T3, N1, M0
- T3, N2, M0
Patienten im klinischen Stadium IIIA (N2) haben eine 5-Jahres-Gesamtüberlebensrate von 10 bis 15 %. Patienten mit großem Mediastinaltumor (= Tumor auf dem Röntgenbild sichtbar) haben demgegenüber eine Überlebensrate von zwei bis fünf Prozent. Abhängig von den klinischen Begleitumständen werden Patienten mit nicht-kleinzelligem Bronchialkarzinom (NSCLC) im Stadium IIIA mit Strahlentherapie, Chemotherapie, Operation und Kombinationen dieser Modalitäten behandelt. Obgleich bei den meisten Patienten mit einer Strahlentherapie kein vollständiges Tumoransprechen erreicht werden kann, gibt es doch einen reproduzierbaren Langzeitüberlebens-Vorteil bei fünf bis zehn Prozent der Patienten, die mit einer Standardtherapie (fraktionierte Bestrahlung bis 6.000 cGy) behandelt worden sind. Oft kommt es darüber hinaus zu einer guten Symptomkontrolle.
Patienten in exzellentem Allgemeinzustand und solche, bei denen sich erst während der Operation zeigt, dass der Tumor nicht operativ entfernt werden kann, werden mit hoher Wahrscheinlichkeit von der Strahlentherapie profitieren.
Die Langzeitergebnisse bei Patienten mit NSCLC im Stadium IIIA sind leider nach wie vor nicht günstig. Um einen Erkenntnisfortschritt zu ermöglichen, sollten diese Patienten, wann immer möglich, in klinischen Studien behandelt werden.
Die zusätzliche Gabe von moderner Chemotherapie auf der Basis von Cisplatin zur Strahlentherapie kann das Überleben, verglichen mit der alleinigen Strahlentherapie, um bis zu zehn Prozent verbessern. Die optimale Reihenfolge von Chemo- und Strahlentherapie und die Durchführung der Chemotherapiegabe muss noch festgelegt werden; sie wird derzeit in klinischen Studien erforscht.
Deren Ergebnisse sind bislang ermutigend. Eine kombinierte Therapie mit Chemotherapie und Operation und/oder Strahlentherapie sollte Patienten in gutem Allgemeinzustand mit NSCLC Stadium IIIA immer angeboten werden.
In der Behandlung des Bronchialkarzinoms konnte bislang kein Vorteil für eine Immuntherapie gezeigt werden.
Standard-Behandlungsoptionen
- alleinige Operation bei operablen Patienten ohne große Tumormasse („bulky disease“)
- alleinige Strahlentherapie bei Patienten, die keine neoadjuvante Chemotherapie plus Bestrahlung erhalten können
- Chemotherapie in Kombination mit anderen Modalitäten
Sonderfall: Pancoast-/Sulcus superior-Tumoren (T3, N0 oder N1, M0)
Tumoren des Sulcus superior stellen eine eigene Krankheitsgruppe innerhalb der Bronchialkarzinome dar. Sie müssen gesondert behandelt werden. Tumoren des oberen Brustkorbs wachsen eher invasiv an Ort und Stelle und neigen weniger zur Fernmetastasierung. Entsprechend kann eine lokal begrenzte Erkrankung besonders im Erkrankungsstadium T3, N0 noch heilbar sein. Strahlentherapie alleine oder gefolgt von der Operation oder die alleinige Operation in ausgewählten Fällen können mit 5-Jahres-Überlebensraten von 20 Prozent oder mehr für manche Patienten eine Heilung bedeuten. Patienten mit stärker invasiven Tumoren in diesem Gebiet oder echten Pancoast-Tumoren haben eine schlechtere Prognose und profitieren im Allgemeinen nicht von einer primär chirurgischen Therapie. Eine Operation kann aber im Verlauf durchgeführt werden, um das vollständige Ansprechen des bestrahlten Tumors zu dokumentieren und das nekrotische Gewebe zu entfernen. Besonders bei Patienten im Stadium T4, N0 oder N1 kann die gleichzeitige Chemo- und Strahlentherapie, gefolgt von der Operation, gute Ergebnisse zeigen.
Standard-Behandlungsoptionen
- Strahlentherapie und Operation.
- Alleinige Strahlentherapie.
- Alleinige Operation (in ausgewählten Fällen).
- Chemotherapie in Kombination mit anderen Modalitäten.
- Klinische Studien mit Behandlungen mit kombinierten Modalitäten.
Sonderfall: Tumoren der Brustwand (T3, N0 oder N1, M0)
Patienten mit großen Primärtumoren, die direkt die Brustwand infiltrieren, können mit einer alleinigen Operation ein Langzeit-Überleben erreichen, vorausgesetzt, der Tumor wurde vollständig reseziert.
Standard-Behandlungsoptionen
- Operation.
- Operation und Strahlentherapie.
- alleinige Strahlentherapie.
- Chemotherapie in Kombination mit anderen Modalitäten.
NSCLC Stadium IIIB
NSCLC IIIB umfasst die folgenden klinischen Tumorstadien:
- jedes T, N3, M0
- T4, jedes N, M0
Patienten mit NSCLC im Stadium IIIB sind mit einer alleinigen Operation nicht ausreichend therapiert. Sie werden am besten mit initialer Chemotherapie, Chemotherapie plus Strahlentherapie oder alleiniger Strahlentherapie behandelt. Die Behandlung wird abhängig von der genauen Lokalisation des Tumors und dem Allgemeinzustand des Patienten festgelegt. Die meisten Patienten in sehr gutem Allgemeinzustand kommen für eine Therapie mit kombinierten Modalitäten in Frage. Patienten mit einem malignen Pleuraerguss können nur selten mit Strahlentherapie, sondern sollten eher wie Patienten im Tumorstadium IV behandelt werden. Viele randomisierte Studien mit Patienten mit nicht-operablem NSCLC im Stadium III zeigen, dass die präoperative (neoadjuvante) oder gleichzeitige Behandlung mit einer Chemotherapie auf der Basis von Cisplatin und die Bestrahlung des Thorax mit einer Verbesserung der Überlebensrate einhergeht.
Patienten mit einem Tumor im Stadium IIIB kommen darüber hinaus auch für eine thorakale Bestrahlung in Frage, um gegebenenfalls Symptome (Husten, Luftnot, Hämoptysen, Schmerzen) besser beherrschen zu können.
- T4 oder N3, M0
Ein Patient mit Befall der supraklavikulären Lymphknoten, der sonst gut für die kurative Strahlentherapie geeignet ist, wird wahrscheinlich drei Jahre überleben. Obwohl die meisten dieser Patienten nicht vollständig auf die Strahlentherapie ansprechen, führt diese Behandlung doch oft zu einer Besserung der Tumorsymptome (Palliation). Patienten in sehr gutem Allgemeinzustand und diejenigen, bei denen erst während der Operation festgestellt wird, dass die Erkrankung doch inoperabel ist, werden sehr wahrscheinlich von der Strahlentherapie profitieren. Manche Patienten haben mit einer adjuvanten Chemotherapie einen bescheidenen Überlebensvorteil. Die Zugabe von Chemotherapie zur Strahlentherapie ging in einigen prospektiven klinischen Studien mit einer Verbesserung des langfristigen Überlebens einher, aber nicht in allen. Eine zusammenfassende Analyse (Metaanalyse) des bisherigen Wissensstandes zeigte einen absoluten Überlebensvorteil von vier Prozent nach zwei Jahren, wenn die Strahlentherapie um eine Chemotherapie auf der Grundlage von Cisplatin erweitert wurde. Die optimale Abfolge der einzelnen Therapiemodalitäten muss noch festgelegt werden und wird derzeit in klinischen Studien untersucht.
Standard-Behandlungsoptionen
- Alleinige Strahlentherapie
- Chemotherapie in Kombination mit Strahlentherapie
- Chemotherapie und gleichzeitige Strahlentherapie
- Alleinige Chemotherapie.
NSCLC Stadium IV
Das Stadium IV des nicht-kleinzelligen Bronchialkarzinoms ist definiert durch das folgende klinische Stadium:
- Jedes T, jedes N, M1
Patienten mit metastasiertem NSCLC sprechen subjektiv und objektiv auf eine palliative Chemotherapie auf der Grundlage von Cisplatin oder Carboplatin an. Wissenschaftliche Studien haben gezeigt, dass bei Patienten im Stadium IIIB oder IV die Cisplatin-basierte Chemotherapie gegenüber der bestmöglichen unterstützenden Therapie einen geringen Vorteil hinsichtlich des Kurzzeit-Überlebens bewirkt. Obgleich die toxischen Nebenwirkungen unterschiedlich ausgeprägt sein können, sind die Ergebnisse der meisten Studien auf der Basis einer platinhaltigen Kombinationstherapie ähnlich. Die Therapieregime, die Cisplatin mit anderen Substanzen kombinieren, zeigen keine signifikanten Unterschiede im Ansprechen, der Ansprechdauer oder im Überleben. Patienten in gutem Allgemeinzustand und einer begrenzten Anzahl von Fernmetastasen haben ein besseres Ansprechen und Überleben, wenn sie eine Chemotherapie erhalten, verglichen mit anderen Patienten, die nur unterstützend (supportiv) behandelt werden.
In einer groß angelegten wissenschaftlichen Untersuchung lag die Ansprechrate für alle Patienten bei 19 %, die mediane Überlebenszeit war 7,9 Monate, unabhängig von der verwendeten Medikamentenkombination, vorausgesetzt, die Behandlung enthielt ein Platinmedikament. Patienten mit einem reduzierten Allgemeinzustand erfuhren mehr toxische Nebenwirkungen und überlebten kürzer als Patienten in gutem Allgemeinzustand.
Nach aktuellem Wissensstand kann kein spezielles Therapieprotokoll (auf der Basis eines Platin-Medikaments) als Standardtherapie empfohlen werden. Außerhalb klinischer Studien sollten nur Patienten in gutem Allgemeinzustand mit messbaren/evaluierbaren Tumorläsionen behandelt werden, die nach vollständiger Aufklärung über die zu erwartenden Risiken und den begrenzten Nutzen eine solche Therapie wünschen.
Die Strahlentherapie kann effizient sein, um Symptome eines lokalen Befalls gezielt zu lindern, wie z. B. tracheale, ösophageale oder bronchiale Kompression; Knochen- oder Hirnmetastasen; Schmerzen; Stimmbandlähmung; Hämoptyse oder obere Einflussstauung. In einigen Fällen wurde eine endobronchiale Laser- und/oder Brachytherapie eingesetzt, um eine Verlegung der großen Atemwege (Luftröhre, Bronchien) zu behandeln. Diese therapeutische Option kann es einem Patienten in sonst gutem Allgemeinzustand ermöglichen, ein akzeptables Leben weiterzuführen.
Im seltenen Fall, dass ein Patient gleichzeitig einen resektablen Lungentumor und eine solitäre Hirnmetastase hat, ist die Resektion der Metastase gleichzeitig mit dem Tumor indiziert. Eine geeignete postoperative Chemotherapie und/oder Strahlentherapie der Primärtumor-Stelle (und mit postoperativer Ganzhirnbestrahlung in täglichen Fraktionen von 180 bis 200 cGy) wird angewendet, um die langfristigen toxischen Auswirkungen auf das normale Hirngewebe zu vermeiden.
Bei engmaschig beobachteten asymptomatischen Patienten kann die Therapie oft so lange verzögert werden, bis Symptome oder Zeichen der Tumorprogression auftreten.
Standard–Behandlungsoptionen
- Strahlentherapie, primär in palliativer Intention bei lokalem Tumorwachstum
- Chemotherapie. Die folgenden Therapieprotokolle sind mit ähnlichen Überlebensraten assoziiert:
- Cisplatin plus Vinblastin plus Mitomycin
- Cisplatin plus Vinorelbin
- Cisplatin plus Paclitaxel
- Cisplatin plus Docetaxel (Taxotere®)
- Cisplatin plus Gemcitabin (Gemzar®)
- Carboplatin plus Paclitaxel
Das deutlich besser verträgliche Carboplatin (Dosierung nach AUC) ist vermutlich dem Cisplatin in der Wirkung nicht unterlegen.
Neue Substanzen zur Therapie des fortgeschrittenen Bronchialkarzinoms
In den letzten Monaten sind mehrere neue Substanzen zur Therapie des Bronchialkarzinoms zugelassen worden. Es handelt sich um
- Pemetrexed (Alimta®)
- Erlotinib (Tarceva®)
Während Pemetrexed aufgrund seines Wirkmechanismus eher einem modernen Chemotherapie-Medikament entspricht, gehört Erlotinib zur Gruppe der Tyrosinkinase-Inhibitoren. Diese sind kleine Moleküle, die gezielt an die an der Entstehung und am Wachstum von Tumorzellen beteiligten Zelleiweiße wie z. B. den EGF-Rezeptor binden können. Auf diese Weise hemmen sie das Wachstum der Tumorzellen.
Eine Vielzahl weiterer Medikamente zur zielgerichteten Therapie von Tumoren wie dem Bronchialkarzinom befindet sich in klinischer Erprobung. Der Stellenwert dieser modernen Therapeutika kann noch nicht abschließend beurteilt werden. Generell gilt für die meisten Medikamente, dass sie erheblich weniger Nebenwirkungen haben als die bislang bekannten Chemotherapeutika. Nicht alle Patienten scheinen nach den bislang bekannten Daten von einer zielgerichteten molekularen Therapie zu profitieren. Im Rahmen laufender wissenschaftlicher Studienprogramme versucht man, vorab z. B. anhand einer Gewebeprobe diejenigen Patienten zu identifizieren, die voraussichtlich den meisten Nutzen von der Behandlung haben könnten.
Nutzen der Chemotherapie im fortgeschrittenen Stadium
Nutzen einer palliativen Chemotherapie
Die systemische Behandlung des NSCLC begann in den 1970er Jahren, im Wesentlichen mit Doxorubicin- und Cyclophosphamid-haltigen Therapien. Meist war das objektive Ansprechen des Tumors nur von kurzer Dauer und ein Einfluss auf die Überlebenszeit nicht nachweisbar. Die Entdeckung des Cisplatin und seiner Wirksamkeit beim NSCLC führte zu dessen Einbeziehung in verschiedene Kombinations-Chemotherapien. Während die Ansprechraten höher waren als bei älteren Protokollen ohne Cisplatin, war auch die Toxizität stärker. Darüber hinaus gelang es in randomisierten Studien in dieser Zeit, die verschiedene Chemotherapieregimes verglichen, nicht, einen Überlebensvorteil zu dokumentieren, so dass der Nutzen der Chemotherapie für diese Erkrankung insgesamt in Frage gestellt war.
Chemotherapie verglichen mit bestmöglicher supportiver Therapie
Mehrere wissenschaftliche Studien haben Kombinationstherapien oder Behandlungen mit einzelnen Substanzen mit der bestmöglich unterstützenden Fürsorge (»best supportive care«) verglichen.
Nicht alle Untersuchungen zeigten einen Überlebensvorteil für die Chemotherapie und wenn dieser nachweisbar war, war er eher klein, aber statistisch signifikant. Das häufige Auftreten behandlungsbedingter toxischer Nebenwirkungen in vielen Studien ließ die Frage aufkommen, ob die bescheidenen Überlebensvorteile überhaupt zu rechtfertigen seien. In vielen Studien wurde deutlich, dass sich die Symptome des Lungenkrebses unter der Therapie verbesserten.
Optimale Dauer der palliativen Therapie
Es ist nicht eindeutig geklärt, wie lange die Therapie optimaler Weise durchgeführt werden sollte, um einerseits den maximalen Überlebensvorteil und bestmögliche Kontrolle der Tumorsymptome zu erreichen. Andererseits sollte, da die Chemotherapie in palliativer Absicht durchgeführt wird, d.h. um Symptome zu lindern und bei unheilbarer Erkrankung die Lebenszeit zu verlängern, eine kürzere Behandlungsdauer mit weniger toxischen Nebenwirkungen einhergehen. Diese Frage ist nur in wenigen Studien untersucht worden. Auf der Basis dieser Studien und der Leitlinien für die Behandlung des nicht-resektablen NSCLC der Amerikanischen Gesellschaft für klinische Onkologie wird empfohlen, die Erstlinien-Therapie bei Patienten mit NSCLC im Stadium IV auf vier bis sechs Zyklen zu beschränken.
Quellen
- ↑ American Cancer Society: http://www.cancer.org/downloads/CRI/6976.00.pdf
- ↑ http://www.ncbi.nlm.nih.gov/sites/entrez?cmd=Retrieve&db=PubMed&list_uids=16538152&dopt=Citation
- ↑ RKI - Robert Koch Institut
- ↑ Statistisches Bundesamt
- ↑ http://www.ncbi.nlm.nih.gov/entrez/utils/fref.fcgi?PrId=3494&itool=AbstractPlus-nondef&uid=7737063&db=pubmed&url=http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=7737063 P Vineis and N Caporaso Tobacco and cancer: epidemiology and the laboratory. Environ Health Perspect. 1995 February; 103(2): 156–160
- ↑ http://www.wissenschaft.de/wissenschaft/news/282341.html Dauerhafte genetische Veränderungen auch bei Ex-Rauchern
- ↑ EPIC
- ↑ DKFZ
- ↑ DIFE
- ↑ Abgewandelt zitiert nach "Was schützt vor Krebs und Diabetes?", MMW-Fortschr. Med., Nr. 24 / 2007 (149. Jg.), S. 16, dort zitiert nach "EPIC-Symposium", Berlin, 25. April 2007
Literatur
- Kumar, Abbas, Fausto: Robbins and Cotrane Pathologic Basis of Disease. 7th Ed. Elsevier Saunders, 2005, Chapter 15 Lung, S. 757-766, ISBN 0-7216-0187-1
- Classen, Diehl, Kochsiek: Innere Medizin. 4. Auflage. Urban & Schwarzenberg, 1998, Kapitel 23.9, S. 1459-1463, ISBN 3-541-11674-9
Weblinks
Leitlinien/Empfehlungen zu Diagnostik, Therapie und Nachsorge
Ratgeber für Patienten und Ärzte
- Informationsnetz für Krebspatienten und Angehörige (INKA)
- Deutsche Gesellschaft für Pneumologie
- Deutsche Atemwegsliga
- Patienteninformation zur operativen Behandlung bei Bronchialkarzinom (Charité Berlin)
Aktuelle Informationen, Therapiestudien, neue Medikamente
- Dt. Krebsforschungszentrum Heidelberg
- Centrum für Integrierte Onkologie Köln
- Cancernet/Uniklinik Bonn: Grundlagen »nicht-kleinzelliges und kleinzelliges Bronchialkarzinom«
- National Cancer Institute (englisch)
- Pressemitteilung des Bundesumweltministeriums vom 19.06.2007 zum radonbedingten Lungenkrebsrisiko (jährlich ca. 1.800 Tote in Deutschland)
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.


_by_core_needle_biopsy.jpg)