- Carbaldehyd
-
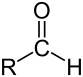
Aldehyde sind chemische Verbindungen, die als funktionelle Gruppe eine endständige Carbonylgruppe (genauer Aldehydgruppe, CHO) enthalten. Die von den Alkanen abgeleitete Reihe der Aldehyde bildet die homologe Reihe der Alkanale.
Die Bezeichnung „Aldehyd“ ist ein Kurzwort aus den jeweils ersten Wortteilen der lateinischen Benennung alcohol(us) dehydrogenatus, was so viel wie „dehydrierter Alkohol“ oder „Alkohol, dem Wasserstoff entzogen wurde“ bedeutet.
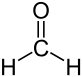
Die Carbonylgruppe (R-C=O) der Aldehyde trägt im Unterschied zu den Ketonen einen Wasserstoff- und einen Kohlenstoffsubstituenten. Eine Ausnahme bildet der einfachste Aldehyd Methanal (Formaldehyd), welcher zwei Wasserstoffsubstituenten trägt. Aldehyde lassen sich im Vergleich zu Ketonen relativ leicht zur Carbonsäure oxidieren.
Aldehyde sind reaktive Verbindungen.
- Die C=O-Bindung der Carbonylgruppe ist stark polar mit der positiven Partialladung (δ+) am Kohlenstoffatom, an dem nukleophil angegriffen werden kann.
- Aldehyde können in der Keto- und der Enolform vorliegen – siehe dazu Keto-Enol-Tautomerie.
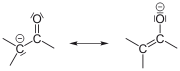
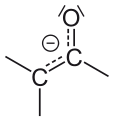
- Bei Aldehyden beobachtet man, dass Wasserstoffatome am zur Carbonylgruppe benachbarten C-Atom deutlich acider sind als Wasserstoffatome an „normalen“ C-Atomen. Dies liegt zum einen daran, dass der Carbonylkohlenstoff sehr elektronenarm ist und einen -I-Effekt auf benachbarte Bindungen ausübt, zum anderen kann nach Deprotonierung die negative Ladung auf den Sauerstoff der Carbonylgruppe delokalisiert werden (–M-Effekt).
Inhaltsverzeichnis
Nomenklatur
Alkanale erhalten nach der IUPAC-Nomenklatur den Namen des Alkans mit derselben Anzahl an Kohlenstoff-Atomen mit dem Suffix -al oder -carbaldehyd. Dementsprechend heißt der vom Methan abgeleitete Aldehyd Methanal, das vom Ethan abgeleitete Ethanal. Falls eine andere funktionelle Gruppe eine höhere Priorität aufweist, wird das Präfix "Formyl-" verwendet. Ist die Verbindung hingegen ein Naturstoff oder eine Carbonsäure wird in diesem Fall das Präfix "Oxo-" gewählt.
Der Trivialname leitet sich von der lateinischen Bezeichnung für die bei Hinzufügen eines Sauerstoffatoms jeweils entstehende Carbonsäure her. Für Methanal (H–CHO) ist das die Methansäure (lat. acidum formicum, H–COOH), daher Formaldehyd. Für Ethanal die Ethansäure (lat. acidum aceticum, CH3–COOH), daher Acetaldehyd. Entsprechend leiten sich die anderen Trivialnamen ab.
Analog wird bei Aldehyden mit Alkenresten (also mit C-C-Doppelbindungen) oder Alkin-Resten (also C-C-Dreifachbindungen) vorgegangen. Weiter existieren Mehrfachaldehyde, wie beispielsweise das Glyoxal - der einfachste Dialdehyd.
Dicarbonsäuren, bei denen eine Carboxylgruppe reduziert wurde, werden Semialdehyde genannt.
Homologe Reihe der Alkanale
Anzahl (C-Atome) IUPAC-Bezeichnung Trivialnamen Summenformel 1 Methanal Formaldehyd HCHO 2 Ethanal Acetaldehyd CH3CHO 3 Propanal Propionaldehyd
PropylaldehydC2H5CHO 4 Butanal n-Butyraldehyd C3H7CHO 5 Pentanal n-Valeraldehyd
Amylaldehyd
n-PentaldehydC4H9CHO 6 Hexanal Capronaldehyd
n-HexaldehydC5H11CHO 7 Heptanal Önanthaldehyd
Heptylaldehyd
n-HeptaldehydC6H13CHO 8 Octanal Caprylaldehyd
n-OctylaldehydC7H15CHO 9 Nonanal Pelargonaldehyd
n-NonylaldehydC8H17CHO 10 Decanal Caprinaldehyd
n-DecylaldehydC9H19CHO Allgemeine Summenformel: CnH2n+1CHO (n = 0, 1, 2, 3, 4, ...)
Reaktionen
Nukleophile Addition
Nach Angriff des Nukleophils geht das π-Elektronenpaar gänzlich zum inzwischen negativ geladenen Sauerstoff. Im protischen Lösungsmittel wird dies durch Protonenaufnahme ausgeglichen, wodurch eine OH-Gruppe anstelle der Carbonylgruppe entsteht.
Addition von Wasser
Wasser + Aldehyd => Aldehydhydrate (geminale Diole)
Aldehyde stehen in wässriger Lösung mit dem entsprechenden gem-Diol, das heißt einem Kohlenwasserstoff mit zwei OH-Gruppen an einem Kohlenstoffatom, im Gleichgewicht.
Addition von Alkoholen
Alkohol + Aldehyd => Halbacetal
Halbacetal + Alkohol => Acetal + Wasser
Beispiel: Ringschluss von Traubenzucker (Glucose)
Siehe auch: Acetalbildung
Addition von Stickstoff-Nukleophilen
Prim. Amin + Aldehyd => Imin (Schiffsche Base) + Wasser
Sec. Amin + Aldehyd => Enamin + Wasser
Oxidation zur Carbonsäure (wichtig für Nachweise)
Aldolreaktion
Das CH-acide H-Atom in der α-Position kann durch Basen abgespalten werden. Das entstandene Enolatanion addiert an den Carbonylkohlenstoff eines weiteren Aldehyd-Moleküls. Es entsteht ein Aldol, ein Additionsprodukt aus Alkohol (OH-Gruppe) und Aldehyd. Auf diese Weise können C-C-Bindungen geknüpft werden. Wird das gebildete Aldol anschließend dehydratisiert, spricht man von Aldolkondensation, dabei entstehen α,β-ungesättigte Aldehyde.
Gemischte Aldolreaktion
Gemischte Aldolreaktionen sind in der Regel nicht in einer Eintopfreaktion durchführbar, da sich vier mögliche Produkte bilden können und auch bilden. Eine Ausnahme ist, wenn eines der beiden Aldehyde nicht enolisierbar ist, das heißt kein CH-acides H-Atom besitzt. In diesem Fall ist nur ein gemischtes Aldol möglich. Ein Beispiel für nicht enolisierbare Aldehyde sind aromatische Aldehyde (siehe: Benzaldehyd). Auf diese Weise wird in einer Knoevenagel-Kondensation Zimtaldehyd, ein wichtiger Duftstoff, gewonnen.
Pinakol-Kupplung
Setzt man Aldehyde mit einem Alkalimetall (Beispiel: Natrium) um, so bildet sich ein Radikalanion, das schnell dimerisiert. Die Hydrolyse liefert ein Pinakol (traditionelle Bezeichnung für ein 1,2-Diol, also ein Diol mit geminalen Hydroxygruppen). Ausgehend von einen α,ω-Dialdehyd erhält man analog durch eine intramolekulare Reaktion cyclische 1,2-Diole.
Nachweise
Spektroskopie von Aldehyden
In IR-Spektren von Aldehyden und Ketonen findet man die intensive, charakteristische Bande der C=O-Valenzschwingung im Bereich von 1690–1750 cm−1. In 13C-NMR Spektren findet man das Signal des Carbonylkohlenstoffatoms von Aldehyden und Ketonen in einem Bereich von 195 und 210 ppm. Das dazugehörige Proton der Aldehydgruppe ist in 1H-NMR Spektren als scharfes Signal bei etwa 10 ppm zu finden. Diese Eigenschaft macht die Identifikation mittels NMR-Spektroskopie besonders einfach, da bei diesem hohen Bereich nur wenige Protonen eine Resonanz aufweisen.
Eigenschaften
Zwischen den Aldehyd-Molekülen kommt es zu Dipol-Dipol-Kräften, weil die C-O-Bindung sehr polar ist. Es kommt nicht zu Wasserstoffbrücken, weil kein sauerstoffgebundenes Wasserstoffatom vorhanden ist. Deswegen liegen die Siedepunkte der Aldehyde zwischen denen der Alkohole und Alkane. Mit Wasser können Aldehyde Wasserstoffbrücken eingehen, weil das Sauerstoffatom zwei freie Elektronenpaare hat und negativ polarisiert ist. Deswegen sind kurzkettige Aldehyde gut wasserlöslich. Bei längerkettigen Aldehyden überwiegt der Anteil der unpolaren Gruppen.
Herstellung
Durch milde Oxidation von primären Alkoholen in nichtwässrigem Medium entstehen Aldehyde. Der Aldehyd kann weiter zur Carbonsäure oxidiert werden.
Verwendung
Mengenmäßig ist der Formaldehyd (Methanal) der weitaus bedeutendste Aldehyd. Er wird als Desinfektionsmittel (Formalinlösung) und zur Herstellung organischer Präparate verwendet. Formaldehyd ist ein wichtiger Grundstoff. In Deutschland werden pro Jahr 500.000 Tonnen hergestellt. Der größte Teil davon wird in der Kunststoffindustrie zu Aminoplasten und Phenoplasten weiterverarbeitet. Formaldehyd selbst wird nur in geringem Maße, und zwar als Konservierungsmittel für verderbliche Güter wie Kosmetika genutzt. Aldehyde und Ketone werden außerdem zur Herstellung von Kunststoffen, Lösungsmitteln, Farbstoffen, Parfums und Medikamenten verwendet.
Physiologische Bedeutung
Im Stoffwechsel der Zellen finden sich eine Reihe von Aldehyden. Eine besondere Rolle spielt das Ethanal (Trivialname Acetaldehyd), das im Verlauf des Alkoholabbaus entsteht und für den so genannten Alkohol-Kater verantwortlich ist.
Wikimedia Foundation.