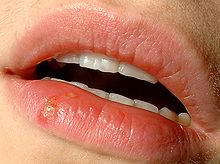
- Herpes simplex
-
Klassifikation nach ICD-10 B00 Infektionen durch Herpesviren [Herpes simplex] ICD-10 online (WHO-Version 2011) Unter Herpes simplex (lat. simplex: einfach) versteht man Virusinfektionen, die durch Herpes-simplex-Viren hervorgerufen werden. Umgangssprachlich verwendet man für diese, speziell den Lippen- oder Genitalherpes (Herpes labialis und Herpes genitalis), auch die Kurzform Herpes. Der Begriff stammt vom altgriechischen ἕρπειν (herpein) für „kriechen“ ab, was an die kriechende Ausbreitung der Hautläsionen bei einer Herpes-simplex-Infektion angelehnt ist.
Die Erreger der verschiedenen Herpes-Simplex-Infektionen sind zwei verschiedene Virusspezies, das Herpes-Simplex-Virus 1 (HSV-1) und das Herpes-Simplex-Virus 2 (HSV-2). Sie unterscheiden sich hinsichtlich ihrer Krankheitsbilder und der Krankheitslokalisation geringfügig. Nach dem Auftreten und der Lokalisation der Krankheitssymptome unterscheidet man klinisch verschiedene HSV-Infektionen, deren wichtigste der Herpes simplex labialis (Lippenherpes) und der Herpes simplex genitalis darstellen. Neben diesen Formen gibt es auch seltene, schwer verlaufende HSV-Infektionen wie die generalisierte HSV-Sepsis bei Patienten mit Immundefizienz und die generalisierte HSV-Infektion des Neugeborenen (Herpes neonatorum).
Nach einer (auch symptomlosen) Erstinfektion verbleibt das Virus in einem Ruhezustand (Latenz) stets lebenslang im Organismus, was man als persistierende Infektion bezeichnet. Diese Eigenschaft der Persistenz ist bei allen Mitgliedern der Familie Herpesviridae zu finden. Die Therapie von HSV-Infektionen vermag diese Persistenz nicht zu beenden, sondern sie versucht die Vermehrung des Virus nach einer erfolgten Reaktivierung aus dem Ruhestadium zu verhindern. Für die HSV-Therapie stehen mehrere Virostatika zur Verfügung, die im Gegensatz zur Therapie der meisten Virusinfektionen hoch spezifisch sind.
Inhaltsverzeichnis
Geschichte
Die genitale Manifestation des Herpes simplex wurde bereits von Hippokrates als Symptom einer sich ausbreitenden Bläschenkrankheit beschrieben.[1] Dass die Erkrankung auch übertragbar ist, war spätestens in der römischen Antike bekannt, da Kaiser Tiberius das Küssen bei öffentlichen Zeremonien verbot, da die Ausbreitung einer Bläschenerkrankung an den Lippen beobachtet wurde. Dies wurde von Aulus Cornelius Celsus als erste Epidemie einer möglichen Herpeserkrankung dokumentiert. Im Europa des 16. und 17. Jahrhunderts war der Herpes labialis ebenfalls weit verbreitet und seine Übertragung durch Küssen allgemein bekannt. So schreibt William Shakespeare in seiner bekannten Tragödie Romeo und Julia: „O’er ladies’ lips, who straight on kisses dream, Which oft the angry Mab with blisters plagues, because their breaths with sweetmeats tainted are.“ (Übersetzung: „Der Schönen Lippen, die von Küssen träumen, Oft plagt die böse Mab mit Bläschen diese, Weil ihren Odem Näscherei verdarb“; erg. Erläuterung: Der im Zitat vorkommende Name Mab meint die Fee "Queen Mab", die in dem Werk in einer Rede Mercutios vorkommt). [2]
Jean Astruc erkannte 1736 den Herpes genitalis als eigene Krankheit, und nicht wie zuvor angenommen als Variante der Gonorrhoe oder der Syphilis.[3] Der deutsche Dermatologe Paul Gerson Unna beschrieb 1883 die Häufigkeit der Erkrankung und ihr gemeinsames Auftreten zusammen mit weiteren Geschlechtskrankheiten.[4] Er führte auch die ersten histologischen Untersuchungen über den Herpes simplex durch. Nachdem 1913 Wilhelm Gürtler den Erreger der Herpes-Keratitis (Herpes corneae) experimentell auf ein Kaninchenauge übertragen konnte, fand Ernst Löwenstein mit der Übertragung von Bläscheninhalt des Herpes labialis auf ein Kaninchenauge die Identität des Erregers beider Erkrankungen. Das HSV wurde schließlich erstmalig von Slavin und Gavett 1946 aus Bläscheninhalt eines Patienten isoliert und charakterisiert,[5] die erste elektronenmikroskopische Darstellung von Herpes-Simplex-Viren gelang Coriell 1950.[6] Erst in den 1960er Jahren wurde durch Andre Nahmias und besonders Karl Eduard Schneweis entdeckt, dass die Herpes-Simplex-Infektionen von zwei verschiedenen Virusspezies verursacht werden, die sie aufgrund ihrer verschiedenen Antigenität unterscheiden konnten.[7] [8]
Erreger
Herpes-simplex-Viren
Die beiden Erreger von Herpes-simplex-Infektionen, die Herpes-simplex-Viren 1 und 2, die man taxonomisch korrekter auch als Humanes Herpesvirus 1 und 2 (HHV-1/2) bezeichnet, gehören zur Gattung Simplexvirus der Familie Herpesviridae. Den Herpes-simplex-Viren verwandte Mitglieder dieser Gattung findet man auch bei Tieren, wo diese beispielsweise bei Rindern oder Klammeraffen, Makaken und anderen Meerkatzenverwandten ähnliche Erkrankungen hervorrufen. Obwohl Herpesviren im allgemeinen streng auf ihren jeweiligen Wirt spezialisiert sind, kann sehr selten das dem HSV-1 sehr ähnliche Cercopithecine Herpesvirus 1 (Herpesvirus simiae) der Makaken auf den Menschen übertragen werden, wo es schwere, generalisierte Infektionen hervorrufen kann.
Die Herpes-simplex-Viren gehören mit einem Durchmesser von 140 bis 180 nm zu den großen Viren.[9] In einem ikosaedrischen Kapsid befindet sich eine lineare, doppelsträngige DNA als Genom. Das Kapsid wiederum ist von einer Virushülle umgeben, was zu einer Empfindlichkeit der Viren gegenüber Seifen, Detergenzien oder bereits milden Desinfektionsmittel führt. Zwischen Kapsid und Virushülle befindet sich eine Vielzahl von Virusproteinen, die sogenannten Tegumentproteine, die unter anderem für die Regulation der Genexpression in der Wirtszelle und den Übergang des Virus in ein ruhendes Latenzstadium verantwortlich sind. Als doppelsträngiges DNA-Virus sind die Herpes-simplex-Viren genetisch sehr stabil, Mutationen und die Entstehung von natürlichen Varianten sind sehr selten.
Übertragung und Verbreitung
Herpes-simplex-Viren sind weltweit verbreitet, der Mensch ist für sie als Reservoir der einzige natürliche Wirt. Da das HSV-1 bereits durch Speichelkontakt und Schmierinfektion ab dem Säuglingsalter im normalen familiären Umgang erworben wird, ist es in der Bevölkerung sehr häufig. Das Virus zeigt eine altersabhängige Seroprävalenz, die etwa am Ende der Pubertät bereits hohe Prozentzahlen erreicht und dann nur noch gering weiter ansteigt. In Deutschland konnten bei 84 bis 92 % der Personen einer altersnormalisierten Stichprobenuntersuchung Antikörper gegen HSV-1 nachgewiesen werden.[10]
Das HSV-2 wird durch engen Schleimhautkontakt übertragen, wenn beim Virusträger das Virus gerade reaktiviert und sich in Epithelzellen erneut vermehrt; die Virusausscheidung kann auch ohne sichtbare Läsionen geschehen. Die Prävalenz von Antikörpern gegen das HSV-2 ist sehr unterschiedlich verteilt. Sie wird besonders vom Alter und der sexuellen Aktivität beeinflusst. Ebenfalls ist die geographische Verbreitung sehr unterschiedlich. Bei gesunden Blutspendern oder Gesundheitsüberwachungen fand man Häufigkeiten von 3 bis 23 Prozent in den USA. Diese Zahl ist signifikant höher bei Patienten, die wegen einer anderen sexuell übertragbaren Krankheit einen Arzt konsultierten (bis 55 %) oder gewerbliche Prostitution betrieben (bis 75 %).[11]
Infektionsmechanismen
Die HS-Viren dringen bei einer Primärinfektion über die Schleimhautzellen des Mund-Rachen-Raumes (überwiegend im Falle des HSV-1) und des Genitaltraktes (überwiegend das HSV-2) ein und vermehren sich in den Epithelzellen. Bereiche am Übergang von Schleimhaut zu normaler Haut werden bevorzugt infiziert. Die Ausbreitung der Herpes-simplex-Viren innerhalb des Epithels geschieht durch Zerstörung der Wirtszellen und Freisetzung neuer Virionen oder durch Verschmelzen benachbarter Zellen, wobei die unbehüllten Viruskapside bereits die neue Zelle infizieren. Die Zerstörung der Epithelzellen äußert sich klinisch in einer Entzündungsreaktion, oft bildet sich durch Gewebszerstörung ein Ulcus oder bereits ein entzündliches Hautbläschen. Die Bläschenflüssigkeit ist ein Exsudat, in dem sich Herpes-simplex-Viren in sehr hoher Konzentration (>100.000 PFU/µl[12]) anreichern.
Durch direkten Zell-Zell-Kontakt oder durch Virionen in der Zwischenzellflüssigkeit gelangt das HSV zu den Nervenenden sensibler Neurone, von denen es spezifisch aufgenommen und entlang den Mikrotubuli und Intermediärfilamenten des Axons zum Zellkörper des Nervs transportiert wird. Dieser retrograde axonale Transport geschieht durch Bindung des Virus (als nacktes Viruskapsid, eventuell mit Restanteilen von Tegumentproteinen und Hüllproteinen) an Kinesin-ähnliche Proteine und Dynein. Die Wanderungsgeschwindigkeit in Richtung Zellkörper beträgt etwa 0,7 µm pro Sekunde.[13]
Erkrankungsformen
Herpes labialis
Die häufigste Manifestationsform einer Herpes-simplex-Infektion ist der Herpes labialis (Lippenherpes, Herpes simplex labialis) als Reaktivierung einer bestehenden HSV-Infektion; das HSV-1 ist mit 80 bis 90 % der Fälle deutlich häufiger als HSV-2. Etwa 40 % der erwachsenen Bevölkerung erleben mindestens einmal im Leben eine als Bläschen sichtbare Reaktivierung;[14] etwa 10–20 % vor allem der jüngeren Erwachsenen berichten mehrfache oder gelegentliche Rezidive (Rückfälle). Eine bevorzugte Stelle des Rezidivs ist der Übergangsbereich zwischen Haut und Lippenrot bzw. die Mundwinkel. Die Gründe dafür sind die hohe Dichte an sensorischen Nervenenden an der Lippe und das Offenliegen jener Epithelschichten, die für die Vermehrung des Virus besonders günstig sind.
Eine Erkrankung mit weiteren, meist fiebrigen Infektionskrankheiten steht häufig im Zusammenhang mit der Reaktivierung eines Herpes labialis. Da die Bläschen schon im Prodromalstadium oder frühen, akuten Stadium einer solchen zusätzlich auftretenden Infektionskrankheit sichtbar werden und diese Stadien meist mit hohem Fieber einhergehen, wird das Herpes-labialis-Rezidiv in diesen Fällen auch als Herpes febrilis („Fieberbläschen“) bezeichnet. Eine oft beobachtete Reaktivierung des Herpes labialis kurz vor oder während der Menstruation wird gelegentlich auch Herpes menstrualis genannt.
Der Herpes labialis kann als Erstinfektion nur mit milden oder fehlenden Symptomen verlaufen. Bilden sich Bläschen, so stehen diese über ein größeres Hautareal weiter verstreut auseinander, als man es bei einem Rezidiv beobachtet. Eine HSV-Erstinfektion als Herpes labialis kann auch besonders bei Kindern klinisch schwerer verlaufen und mit einem allgemeinen Krankheitsgefühl, Fieber und Kopfschmerzen einhergehen. Die Bläschen können zu größeren Ulzerationen konfluieren und zusätzlich mit Bakterien (häufig Staphylococcus aureus) superinfiziert sein. Gelegentlich sind zusätzlich die Mundschleimhaut und das Zahnfleisch in die Infektion einbezogen, wo sich sehr schmerzhafte Bläschen (Aphthen) und Ulzera bilden. Diese typische Erstmanifestation wird auch als Gingivostomatitis herpetica, Stomatitis herpetica oder Mundfäule bezeichnet.
Andere Lokalisationen
Die Herpes-simplex-Infektion kann durch Verschleppung der Viren auch in weiteren Hautarealen auftreten, in denen primär keine Erstinfektion zu erwarten ist. Dies geschieht häufig dadurch, dass nach Kontakt der Hände mit den offenen Bläschen eines Herpes labialis oder genitalis die Erreger in verletzte oder empfängliche Hautpartien eingerieben werden (Autoinokulation). Dies kann zu Bläschenbildung an der Nase (Herpes nasalis), der Wange (Herpes buccalis, Herpes facialis), dem Augenlid oder anderen Körperstellen (Herpes corporis) führen. Eine Sonderform ist die Infektion sonst wenig empfänglicher Hautpartien durch Gewalteinwirkung, wie sie verschiedenen Sportarten zu Eigen ist. Dieses Phänomen des Herpes gladiatorum wurde zuerst bei Ringern beobachtet,[15] bei welchen es auch als Erstinfektion bei jugendlichen Sportlern zu größeren Ausbrüchen kommen kann, z. B. in Trainingslagern.[16] Bei Rugby-Spielern wurde ähnliches beobachtet.[17]
Auf Grund der typischen Bläschen kann das Auftreten von Herpes-simplex-Infektionen auf verschiedenen Hautpartien klinisch einem Herpes zoster (Gürtelrose), also einer Reaktivierung des Varizella-Zoster-Virus, sehr ähnlich sein. Dies ist besonders dann der Fall, wenn die HSV-Läsionen der Haut zufällig in den für Herpes zoster typischen Hautdermatom auftreten. Man spricht dann von einem „Zosteriformen Herpes simplex“. Umgekehrt kann eine atypisch lokalisierte Gürtelrose als HSV-Infektion missgedeutet werden, dies ist der sogenannte „Herpetiforme Zoster“.
Sonderformen und generalisierte Erkrankungen
Ekzema herpeticatum
Auf dem Boden einer chronischen Hauterkrankung wie beispielsweise dem atopischen Ekzem, der Schuppenflechte oder dem Morbus Darier kann es zu einer zusätzlichen Herpes-simplex-Infektion größerer Hautareale kommen. Dieses sogenannte Ekzema herpeticatum (oder auch Ekzema herpeticum) ist im Rahmen einer Primärinfektion oder einer Reaktivierung der Herpes-Simplex-Viren möglich; häufiger Erreger ist das HSV-1. Das klinische Bild erscheint als verteilte, teils in Gruppen angeordnete Bläschen, die konfluieren und rasch platzen. Das Ekzema herpeticatum geht oft mit einem schweren Krankheitsgefühl einher, und birgt als generalisierte Herpes-Simplex-Infektion die Gefahr einer Herpes-Simplex-Enzephalitis oder bei immundefizienten Patienten einer Herpes-Sepsis. Ein Ekzema herpeticatum bei Kindern kann ebenfalls zu einer sehr ernsten Sepsis führen und ist dringend medikamentös zu behandeln.[18]
Herpes-Simplex-Retinitis
Eine besondere Form der Infektion in Nervengewebe ist die Infektion der Netzhaut des Auges (Retina), die sogenannte Herpes-Simplex-Retinitis.[19] Sie gehört zu den endogenen, intraokulären Infektionen, das bedeutet dass die Infektion immer durch eine Reaktivierung des Virus und nicht durch fortschreitende Infektion über eine andere, äußere HSV-Infektion des Auges (Herpes corneae) erfolgt. Bei der HSV-Retinitis findet man Exsudate in der Retina sowie lokale Entzündungsherde, die sich rasch zu einem Untergang von Netzhautgewebe (Retinanekrose) entwickeln können und damit zur Erblindung führen. Eine HSV-Retinitis wird auch unmittelbar oder Jahre nach einer Herpes-simplex-Enzephalitis beobachtet.[20][21] In diesen Fällen gelangt das Virus über den Sehnerv in die Netzhaut, die beide anatomisch als Hirnbestandteile gelten.
Bell-Lähmung
Eine Infektion mit HSV-1 wird als häufige Ursache einer besonderen Form einer Lähmung des Gesichtsnerven (Nervus facialis) diskutiert.[22] Diese sogenannte Bell-Lähmung, eine idiopathische periphere Fazialislähmung, ist ursächlich noch nicht vollständig geklärt. Möglicherweise findet eine Demyelinisierung der HSV-infizierten Nervenscheiden statt, die nicht durch die Vermehrung des Virus selbst hervorgerufen wird, sondern auf einer viral induzierten Immunantwort beruht.[23] Dies würde auch die Unwirksamkeit von Virostatika trotz nachgewiesener HSV-1-Infektion erklären, da diese nur die Virusvermehrung, nicht aber die fehlgeleitete Immunantwort unterdrücken.
Herpes-Simplex-Ösophagitis
Eine HSV-Infektion der Schleimhaut der Speiseröhre (Ösophagitis) kann im Rahmen einer Reaktivierung aus den Neuronen des Mund-Rachen-Raumes auftreten.[24] Typischerweise findet man bei dieser Form keine zusätzlichen Lippenbläschen als Zeichen der Reaktivierung, in 2/3 der Fälle ist der untere Ösophagusabschnitt betroffen. Charakteristisch bei der endoskopischen Untersuchung sind scharf begrenzte, kleine, flache Ulzera der Schleimhaut. Die Auslöser für die HSV-Ösophagitis sind meist schwere Grunderkrankungen oder eine immunsupprimierende Therapie mit Corticosteroiden oder Zytostatika. Begünstigt wird diese Lokalisation durch eine Schädigung der Speiseröhre, beispielsweise bei einer Strahlentherapie, einer schweren Refluxösophagitis, dem Liegen einer Magensonde oder nach chemischen Schädigungen (Verätzung). Liegen keine erkennbaren Ursachen vor, ist der Immunstatus des Patienten zu überprüfen. Eine HSV-Ösophagitis im Rahmen einer HIV-Infektion gilt als AIDS-definierende Erkrankung.
Sehr selten kann eine HSV-Ösophagitis auch als Begleiterkrankung einer klinisch stark ausgeprägten HSV-Erstinfektion auftreten. Diese Form ist auch bei immunkompetenten, nicht-vorerkrankten Patienten möglich, häufiger bei Männern als Frauen. Bei diesen Fällen der Erstinfektion liegt immer gleichzeitig eine Stomatitis herpetica vor.[25] Die HSV-Ösophagitis beim Immunkompetenten ist meist selbstlimitierend, neben einer symptomatischen Behandlung der Beschwerden ist eine antivirale Therapie meist nicht notwendig.
Generalisierter Herpes simplex
Die Herpes-Simplex-Viren können auch Erkrankungen hervorrufen, die nicht primär über eine neuronale Ausbreitung entstehen, sondern über die Blutbahn als vorübergehende oder dauerhafte Virämie. Eine Abgrenzung zu zusätzlichen Symptomen einer Erstinfektion oder einer Reaktivierung ist nicht immer streng möglich. Die schwerste Form der generalisierten Infektion ist die „Herpes-Simplex-Sepsis“, oder – da die Bezeichnung Sepsis strenggenommen nicht für Viren verwendet wird – die disseminierte Herpes-Simplex-Infektion.
Herpes-Simplex-Infektionen in der Schwangerschaft
Die generalisierte Herpes-simplex-Infektion des Neugeborenen, der Herpes neonatorum, ist eine sehr schwere und dringend behandlungsbedürftige Erkrankung. Ursache ist meist eine Übertragung des HSV-2 (weniger HSV-1) von der Mutter auf das Kind während des Geburtsvorganges. Bei Gebärenden mit einer Erstinfektion mit HSV-2 und einer Manifestation des genitalen Herpes in der zweiten Schwangerschaftshälfte, ist das Risiko eines Herpes neonatorum besonders hoch. Eine Entbindung durch Kaiserschnitt kann die Infektion des Kindes jedoch vermeiden. Der Herpes neonatorum betrifft beim Neugeborenen die Haut (lokal begrenzt oder großflächig verteilt), den Mund-Rachen-Raum, innere Organe und in der gravierendsten Form auch das Zentralnervensystem als Herpes-simplex-Enzephalitis.
Diagnostik
Bei der Mehrzahl der einfachen HSV-Infektionen wird die Diagnose durch das klinische Bild gestellt, ein kostenintensiver Erregernachweis oder eine wenig aussagekräftige Untersuchung auf anti-HSV-Antikörper ist dann nicht anzustreben. Neben neurologischen und internistischen Diagnoseverfahren, die jeweils für eine spezielle HSV-Erkrankung von Nutzen sind (Bildgebende Verfahren, Magnetresonanztomographie bei Enzephalitis, Spiegelung des Augenhintergrundes bei Retinitis, Endoskopie bei Ösophagitis u. a.), ist der Nachweis des spezifischen Erregers nur bei schweren Erkrankungen von Bedeutung. Bei Immundefizienz beispielsweise im Rahmen einer Chemotherapie oder einer Immunsuppression nach Organtransplantation hat die HSV-Diagnostik einen hohen Stellenwert, da gerade diese Patienten von gefährlichen, generalisierten Infektionen bedroht sind.
Serologie und Erregernachweis
Der serologische Nachweis von Antikörpern gegen HSV-1 und HSV-2 ist klinisch nur sehr eingeschränkt von Bedeutung.[26] Lediglich für epidemiologische Untersuchungen ist der Antikörpernachweis sinnvoll. Die Problematik des HSV-Antikörpernachweises beruht zum einen auf der sehr hohen Prävalenz der Antikörper bei klinisch Gesunden, einer unzuverlässigen Unterscheidung zwischen HSV-1 und HSV-2 in den meisten verfügbaren Testsystemen und einer späten oder ausbleibenden Antikörperproduktion bei schweren HSV-Erkrankungen. Selbst bei einer generalisierten, disseminierten HSV-Infektion können anti-HSV-IgG und -IgM Antikörper nicht oder nur sehr spät nachweisbar sein.[27]
Der Nachweis von anti-HSV-IgM-Antikörpern hat klinisch keine Bedeutung, da eine Erstinfektion bei nicht nachgewiesenen IgM-Antikörpern nicht ausgeschlossen werden kann, andererseits der erfolgte Nachweis nicht zwingend eine Erstinfektion beweist. IgM-Antikörper gegen HSV können für Monate und Jahre persistieren, bei einer Reaktivierung erneut auftreten, bei einer Erstinfektion nicht nachweisbar sein oder auf einer relativ häufigen Unspezifität der kommerziellen Testverfahren beruhen. Eine nacheinander erfolgende Infektion mit den beiden HSV-Spezies erschwert zusätzlich die Interpretation des Befundes. [28] Die nicht ausreichende Spezifität der Antikörper-Suchtests bedarf einer Bestätigung mittels Western Blot oder eines indirekten Immunfluoreszenztests.
Eine Erstinfektion mit HSV kann serologisch nur durch eine Serokonversion des anti-HSV-IgG nachgewiesen werden, wenn eine zeitlich ausreichend nahe abgenommene Vorprobe negativ ist und im Verlauf eine Folgeprobe nach 1 bis 2 Wochen eindeutig positiv wird. Es muss sichergestellt sein, dass die Antikörper nicht passiv erworben wurden, d. h. die Positivität beruht nicht auf der Gabe anti-HSV-positiver Blutprodukte (Hyperimmunglobulin, Thrombozytenkonzentrat etc.) oder mütterlicher Antikörper bei Neugeborenen und Säuglingen. Schwankende Mengen von HSV-IgG oder sich ändernde positive anti-HSV-Titer besitzen klinisch keine Aussagekraft. Bei immundefizienten Personen ist zudem die Aussagekraft der Antikörperbestimmung eingeschränkt, da bei diesen Patienten nicht ausreichend oder nur verzögert Antikörper gebildet werden können.
Die höchste Aussagekraft bei HSV-Infektionen bietet der direkte Erregernachweis in betroffenem Gewebe oder Gewebsflüssigkeiten (Liquor, Augenkammerwasser, Bläscheninhalt etc.). Dieser wird meist durch Nachweis der viralen DNA mittels Polymerase-Kettenreaktion (PCR) oder seltener durch Nachweis virusspezifischer Antigene im Immunfluoreszenztest durchgeführt. Als hoch spezifische, direkte Nachweismethode ist auch die Virusisolierung in Zellkulturen möglich, die durch eine nachfolgende Differenzierung der produzierten Viren jedoch mehrere Tage in Anspruch nimmt. Ein Nachweis von Viren bei elektronenoptischer Untersuchung von infiziertem Material ist möglich, jedoch kann morphologisch nicht zwischen verschiedenen Spezies der Virusfamilie Herpesviridae differenziert werden.
Resistenztestung
Bei schweren HSV-Infektionen, die nicht signifikant innerhalb weniger Tage auf eine korrekt durchgeführte antivirale Therapie mit Aciclovir ansprechen, besteht der Verdacht einer Resistenzentwicklung. Diagnostisch ist es möglich, die Resistenz der isolierten Virusstämme zu testen. Dazu wird das Virus auf Zellkulturen vermehrt und eine Bestimmung der noch wirksamen Aciclovirkonzentration (Minimale Hemm-Konzentration) durchgeführt. Die wirksame Hemmung der Virusvermehrung in der Zellkultur kann über einen Plaque-Reduktionstest oder einer Bestimmung der Bearbeiten] Behandlung
Außer den Virustatika Aciclovir und Penciclovir wird u. a. und seltener auch noch Tromantadin eingesetzt. Es ist ein antiviraler Wirkstoff aus der Gruppe der Nukleosid-Analoga zur Behandlung von Herpes-simplex-Infektionen. Zu seinen häufigsten Nebenwirkungen zählen Allergien der Haut.[29] Eine Alternative zu Virustatika sind wirkstofffreie Herpespflaster, die mittels Hydrokolloiden (Hydrokolloid-075 Partikeln) ein Feuchtigkeitspolster über den Herpesbläschen erzeugen.[30]
Meldepflicht
In Deutschland und der Schweiz besteht keine gesetzliche Meldepflicht von Herpes-simplex-Infektionen. In Österreich ist ausschließlich der Verdacht, die Erkrankung und der Tod bei einer HSV-assoziierten Meningoenzephalitis meldepflichtig.
Literatur
- S. Dreyer: Herpes Nein danke - Handreichungen für Lippenherpes-Betroffene. Böhl-Iggelheim Verlag Dr. Scriptor OHG, 2010. ISBN 978-3-9809578-7-8
- D. C. Hutfield: History of herpes genitalis. Br. J. Vener. Dis. (1966) 42(4): S. 263-268 PMID 5333786 (pdf)
- R. Marre, T. Mertens, M. Trautmann, E. Vanek: Klinische Infektiologie. München Jena 2000 ISBN 3-437-21740-2 S. 578ff, 596ff, 189f
- H. Hahn, D. Falke, S. H. E. Kaufmann, U. Ullmann: Medizinische Mikrobiologie und Infektiologie. 5. Aufl., Heidelberg 2005 ISBN 3-540-21971-4, S. 610ff
- C. Mims, H. M. Dockrell et al.: Medizinische Mikrobiologie / Infektiologie. München (Elsevier) 2006 ISBN 3-437-41272-8
Einzelnachweise
- ↑ R. H. Kampmeier: Herpes genitalis: a clinical puzzle for two centuries. Sex. Trans. Dis. (1984) 11: S. 41
- ↑ Mercutio zu Romeo im 1. Akt, 4. Szene (Text auf Wikisource)
- ↑ Jean Astruc: De morbis venereis. Paris 1736 und A Treatise of Venereal Diseases. London 1754, Band 1, 3. Buch, S. 365
- ↑ P. G. Unna, J. cutan. vener. Dis. (1883) 1: S. 321, zugänglich in: J. K. Oates: Venereal disease genital herpes. J. Hosp. Med. (1983) 6: S. 13-19
- ↑ H. B. Slavin, E. Gavett: Primary herpetic vulvovaginitis. Proc. Soc. Exp. Biol. Med. (1946) 63: S. 343
- ↑ L. L. Coriell, G. Rake et al.: Electron microscopy of herpes simplex. J. Bacteriol. (1950) 59(1): S. 61–68 PMID 15400321
- ↑ Karl Eduard Schneweis: Untersuchungen zur antigenen Analyse und zur Typendifferenzierung beim Herpesvirus hominis. Göttingen 1962
- ↑ K. E. Schneweis, A. J. Nahmias: Antigens of Herpes simplex virus type 1 and 2-immunodiffusion and inhibition passive hemagglutination studies. Z. Immunitätsforsch. Exp. Klin. Immunol. (1971) 141(5): S. 471-487 PMID 4326538
- ↑ J. F. Szilágyi, J. Berriman: Herpes simplex virus L particles contain spherical membrane-enclosed inclusion vesicles. J. Gen. Virol. (1994) 75 (7): S. 1749–1753 PMID 8021604
- ↑ W. Hellenbrand, W. Thierfelder et al.: Seroprevalence of herpes simplex virus type 1 (HSV-1) and type 2 (HSV-2) in former East and West Germany, 1997–1998. Eur. J. Clin. Microbiol. Infect. Dis. (2005) 24(2): S. 131-135 PMID 15692814
- ↑ Eine Übersicht verschiedener epidemiologischer Studien in B. Halioua, J. E. Malkin: Epidemiology of genital herpes - recent advances. Eur J Dermatology (1999) 9(3): S. 177-184. PMID 10210781 (Tabelle 2)
- ↑ C. A. Daniels, S. G. LeGoff: Shedding of infectious virus/antibody complexes from vesicular lesions of patients with recurrent herpes labialis. Lancet (1975) 20;2(7934): S. 524-528 PMID 51344
- ↑ W. W. Liu, J. Goodhouse, N. L. Jeon, L. W. Enquist: A microfluidic chamber for analysis of neuron-to-cell spread and axonal transport of an alpha-herpesvirus. PLoS ONE (2008) 18;3(6):e2382 PMID 18560518 Volltext
- ↑ D. Malvy et al.: Epidemiology of orofacial herpes simplex virus infections in the general population in France: results of the HERPIMAX study. J. Eur. Acad. Dermatol. Venereol. (2007) 21(10): S. 1398–1403 PMID 17958848
- ↑ B. Selling, S. Kibrick: An outbreak of Herpes simplex among wrestlers (Herpes gladiatorum). New England J. Med. (1964) 7;270: S. 979-982 PMID 14122793
- ↑ B. J. Anderson: The epidemiology and clinical analysis of several outbreaks of herpes gladiatorum. Med. Sci. Sports Exerc. (2003) 35(11): S. 1809–1814 PMID 14600542
- ↑ W. B. White, J. M. Grant-Kels: Transmission of herpes simplex virus type 1 infection in rugby players. JAMA (1984) 27;252(4): S. 533-535 PMID 6737650
- ↑ I. R. Sanderson et al.: Eczema herpeticum: a potentially fatal disease. Br. Med. J. (1987) 294(6573): S. 693-694 PMID 3105692 pdf
- ↑ Übersicht in: M. Cordero-Coma et al.: Herpetic retinitis. Herpes (2007) 14(1): S. 4-10 (Review) PMID 17848212
- ↑ J. Maertzdorf et al.: Herpes simplex virus type 1 (HSV-1)-induced retinitis following herpes simplex encephalitis: indications for brain-to-eye transmission of HSV-1. Ann. Neurol. (2001) 49(1): S. 104-106 PMID 11198277
- ↑ A. Klein, P. Lefebvre: Three consecutive episodes of acute retinal necrosis due to herpes simplex-1 over twelve years following herpetic encephalitis. Ocul. Immunol. Inflamm. (2007) 15(5): S. 411-413 (Review) PMID 17972228
- ↑ S. Murakami et al.: Bell’s palsy and herpes simplex virus: Identification of viral DNA in endoneurial fluid and muscle. Ann Intern Med (1996) 124 (1): S. 27–30 PMID 7503474
- ↑ H. Wakisaka et al.: Demyelination associated with HSV-1-induced facial paralysis. Exp. Neurol. (2002) 178(1): S. 68-79 PMID 12460609
- ↑ Eine Übersicht der HSV-Ösophagitiden in: K. Becker, H. J. Lübke, F. Borchard, D. Häussinger: Entzündliche Speiseröhrenerkrankungen durch Herpes-simplex-Virusinfektionen - Übersicht und Bericht über 15 eigene Fälle. Z. Gastroenterol. (1996) 34(5): S. 286-295 PMID 8686361
- ↑ J. Ramanathan et al.: Herpes simplex virus esophagitis in the immunocompetent host: an overview. Am. J. Gastroenterol. (2000) 95(9): S. 2171–2176 PMID 11007213
- ↑ Übersicht der diagnostischen Problematik in: Th. Mertens, O. Haller, H.-D. Klenk (Hg.): Diagnostik und Therapie von Viruskrankheiten - Leitlinien der Gesellschaft für Virologie. 2. Aufl. München 2004 ISBN 3-437-21971-5 S. 126-130
- ↑ G. Biancofiore et al.: Liver transplantation due to Herpes Simplex virus-related sepsis causing massive hepatic necrosis after thoracoscopic thymectomy. Minerva Anestesiol. (2007) 73(5): S. 319-322 PMID 17529922
- ↑ N. J. Schmidt, B. Forghani, E. H. Lennette: Type specificity of complement-requiring and immunoglobulin M neutralizing antibody in initial herpes simplex virus infections of humans. Infect Immun. (1975) 12(4): S. 728-732 PMID 1193713 pdf
- ↑ ch.oddb.org
- ↑ [1]:Herpes:Selbstbehandlung, aufgerufen am 30. Oktober 2011
Weblinks
- Herpes-Infektionen – Informationen des Robert Koch-Instituts
- Bilder von Herpes bei DermIS
- Bild einer Herpes-simplex-Keratitis

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.