- Polyglutamin
-
Strukturformel 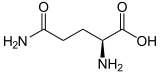
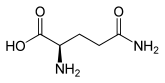
L-Glutamin (links) bzw. D-Glutamin (rechts)Allgemeines Name Glutamin Andere Namen - Gln (Dreibuchstabencode)
- Q (Einbuchstabencode)
- 2-Amino-4-carbamoylbutansäure
- Glutaminsäure-5-amid
Summenformel C5H10N2O3 CAS-Nummer - 56-85-9 (L-Enantiomer)
- 5959-95-5 (D-Enantiomer)
PubChem 5961 DrugBank NUTR00026 Kurzbeschreibung farb- und geruchloser Feststoff [1] Eigenschaften Molare Masse 146,15 g·mol−1 Aggregatzustand fest
Schmelzpunkt pKs-Wert - pKCOOH: 2,17
- pKNH2: 9,13 (jeweils bei 25 °C)[2]
Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 7500 mg·kg−1 (Ratte, oral) [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. L-Glutamin ist eine proteinogene α-Aminosäure und stellt das γ-Mono-Amid der L-Glutaminsäure dar. Im Stoffwechsel ist L-Glutamin ein universeller NH2-Donor.
Inhaltsverzeichnis
Stereoisomerie
In den Proteinen kommt, neben anderen Aminosäuren, ausschließlich L-Glutamin [Synonym: (S)-Glutamin] peptidisch gebunden vor. Enantiomer dazu ist das spiegelbildliche D-Glutamin [Synonym: (R)-Glutamin], das in Proteinen nicht vorkommt. Racemisches DL-Glutamin [Synonyme: (RS)-Glutamin und (±)-Glutamin] besitzt geringe Bedeutung.
Vorkommen
Quark ist das Nahrungsmittel mit dem höchsten Glutamingehalt, in geringerem Maß kommt es noch in Milch und Joghurt vor. Außerdem kommt Glutamin in rohem oder geräuchertem Fleisch vor. Weitere natürliche Quellen mit hohem Glutamingehalt sind Soja und Weizen.[4]
Eigenschaften
Das farblose, kristalline Glutamin ist unlöslich in Alkoholen, Benzol und Chloroform. Mäßig löslich ist es hingegen in Wasser (100 g/l bei 40 °C).
- van-der-Waals-Volumen: 114
- Lipidlöslichkeit: LogP = −3,5
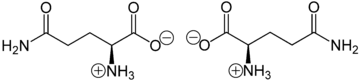
Glutamin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxylgruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:
Zwitterionen von L-Glutamin (links) bzw. D-Glutamin (rechts)
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Zwitterion auch seine geringste Löslichkeit in Wasser hat. Sein isoelektrischer Punkt liegt bei 5,65. [5]Herstellung
Großtechnisch wird L-Glutamin fermentativ hergestellt.[6]
Biochemie
Für die Biosynthese inklusive Strukturformeln siehe Abschnitt Weblinks L-Glutamin wird aus der L-Glutaminsäure durch die Glutamin-Synthetase hergestellt. Dabei wird Adenosintriphosphat (ATP) verbraucht. Im Körper kann L-Glutamin zu Succinat in drei Reaktionsschritten abgebaut werden.
Funktionen
Glutamin kommt in der höchsten Konzentration in den Muskelzellen vor. Es ist vor allem für die Wassereinlagerung in die Zelle verantwortlich und bewirkt bei körperlicher Belastung eine Vergrößerung des Zellvolumens. Die Vergrößerung des Zellvolumens wertet der Körper als anaboles Signal, wodurch die Protein- und Glykogenbildung gefördert wird.
Als Praxistipp insbesondere im Bereich der kraftorientierten Hobbysportler gilt, dass Glutamin nicht nur anabol sondern zusätzlich antikatabol wirke, indem es bei körperlicher Anstrengung einem Abbau von Muskelgewebe entgegen wirke. Ebenso verbessere sich die körperliche Regenerationsfähigkeit während des Schlafes. Einen stringenten wissenschaftlichen Nachweis für diese Wirkungsweise gibt es noch nicht.
Funktion im Nervensystem
Glutamin ist chemisch eng verwandt mit der exzitatorischen Aminosäure Glutaminsäure (häufig wird nur von der ionisierten Form, dem Glutamat, gesprochen), die als Neurotransmitter bei glutamatergen Synapsen im zentralen Nervensystem vorkommt. An diesen Synapsen wird ein Teil des Glutamats nach der Ausschüttung in den synaptischen Spalt in benachbarte Gliazellen aufgenommen. Um das aufgenommene Glutamat zurück in die präsynaptischen Neuronen zu transportieren, wird es in den Gliazellen in Glutamin umgewandelt, da Glutamin keine exzitatorische Auswirkung auf die postsynaptische Membran aufweist. In den Neuronen wird Glutamin dann wieder in Glutamat umgewandelt.
Polyglutamin
Eine Reihe wichtiger Proteine beinhalten Polyglutamin-Einheiten, das heißt längere sich wiederholende Glutamin–Glutamin-Verknüpfungen. Beispiel dafür sind das FOXP2-Protein oder das die Chorea Huntington auslösende Huntingtin. Im Huntingtin bewirkt eine durch eine autosomal-dominante Mutation bedingte Verlängerung der Polyglutamin-Einheit das Ausbrechen der Krankheit.[7][8]
Einzelnachweise
- ↑ a b c d e Herstellerangaben der Firma Merck, 13. Jan. 2008
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart, 1991, ISBN 3-7776-0485-2, dort Seite 823.
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.1. Georg Thieme Verlag KG, Stuttgart 2008.
- ↑ K. Lösche: Enzyme in der Lebensmitteltechnologie. Behr's Verlag, 2000, ISBN 9783860226407
- ↑ P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- ↑ Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Herstellung und Verwendung von Aminosäuren, Angewandte Chemie 90 (1978) 187-194; Angewandte Chemie International Edition in English 17, 176–183.
- ↑ J. Rutishauser: Morbus Huntington: disrupt the fatal attraction. In: Schweiz Med Forum, 24/2002, S.586–587.
- ↑ E. Cattaneo u. a: Das Rätsel der Chorea Huntington In: Spektrum der Wissenschaft, JANUAR 2004, S. 60–66.
Weblinks
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.