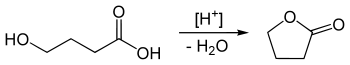- Γ-Butyrolacton
-
Strukturformel 
Allgemeines Name Butyro-1,4-lacton Andere Namen - γ-Butyrolacton
- Dihydrofuran-2-on
- 1-Oxa-cyclopentan-2-on
Summenformel C4H6O2 CAS-Nummer 96-48-0 PubChem 7302 DrugBank DB04699 Kurzbeschreibung klare Flüssigkeit [1] Eigenschaften Molare Masse 86,09 g·mol−1 Aggregatzustand flüssig
Dichte 1,128 g·cm−3 [1]
Schmelzpunkt −44 °C [1]
Siedepunkt 204–206 °C [1]
Dampfdruck 0,4 hPa [1] (20 °C)
Löslichkeit vollständig mischbar mit Wasser und Ethanol [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36 S: 26-36 LD50 WGK 1 (schwach wassergefährdend) [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Butyro-1,4-lacton, veraltet auch γ-Butyrolacton (GBL) genannt, ist das Lacton der γ-Hydroxybuttersäure (GHB) und wird hauptsächlich als Lösungsmittel in der Industrie und als Ausgangsstoff zur Herstellung von Pharmazeutika und Chemikalien eingesetzt. Daneben dient es als Vorläuferstoff des Betäubungsmittels GHB; in Europa und den USA wird die Abgabe von GBL daher durch das sogenannte Monitoring (Name für freiwillige Selbstkontrolle der Händler und Hersteller) überwacht.
Inhaltsverzeichnis
Vorkommen
In der Natur kommt GBL in Spuren z.B. als Umbauprodukt des natürlichen GHB und auch in Wein vor.[4] Es wird industriell aus Bernsteinsäure oder BDO synthetisiert.
Gewinnung
Bei der Synthese von GBL wird zuerst Maleinsäure zu Bernsteinsäure umgesetzt, aus der GBL synthetisiert werden kann.[5] Die jährlich in Deutschland verbrauchte Menge GBL beträgt über 1000 Tonnen, da GBL als Ausgangsstoff für viele andere Dinge dient (siehe Verwendung).
Darüber hinaus kann GBL auch durch eine innere Veresterung von γ-Hydroxybuttersäure im sauren Milieu synthetisiert werden. Umgekehrt wird γ-Hydroxybuttersäure durch die Verseifung von GBL in basischem Milieu hergestellt.
Eigenschaften
Physikalische Eigenschaften
GBL ist eine bei Raumtemperatur farblose Flüssigkeit mit schwachem Eigengeruch.
Die Schmelztemperatur von γ-Butyrolacton liegt bei −43,5 °C, der Siedepunkt bei 206 °C. Zusammen mit Wasserdampf ist GBL flüchtig bei Temperaturen, die unter dem eigentlichen Siedepunkt von GBL liegen. Der Flammpunkt und die Zündtemperatur liegen bei 100 beziehungsweise 455 °C. Die Dichte von GBL beträgt 1,128 g/cm³.
Löslich ist γ-Butyrolacton in jedem Verhältnis mit Wasser, Methanol, Ethanol, Aceton, Ether, Dichlormethan, Toluol und Propylenglykol. Allerdings ist die Löslichkeit von GBL in aliphatischen Kohlenwasserstoffen stark begrenzt.
Die Viskosität von GBL ist relativ gering und mit Wasser vergleichbar.
Chemische Eigenschaften
GBL reagiert durch partielle Hydrolyse zu 4-Hydroxybuttersäure in Wasser leicht sauer. Die Substanz wird durch wässrige Alkalien quantitativ hydrolysiert. Wasserfreie Basen können ein Proton am C2-Atom abstrahieren (C-H-acide Verbindung, Bildung des Enolats), das dadurch einem nukleophilen Angriff zugänglich wird.
GBL ist wie Ethylacetat oder Aceton ein polar aprotisches Lösungsmittel und löst viele Kunststoffe wie Polyester oder PMMA.
Verwendung
Industrie
GBL ist ein weit verbreitetes Lösungsmittel in der Industrie und wird auch als Farbentferner, Graffitientferner, Reinigungsmittel und Nagellackentferner verwendet. Es ist als Weichmacher in Weich-PVC-Folien enthalten.
Im November 2007 machte GBL Schlagzeilen als Bestandteil einer Knetmasse für Kinder. Durch Verschlucken der Knetmasse sind einzelne Kinder angeblich "in ein Koma" gefallen, d.h. sie bekamen die Wirkung von GBL als Schlafmittel zu spüren.
Darüber hinaus dient GBL auch als Ausgangsstoff zur Herstellung von Pharmazeutika und Chemikalien für die Landwirtschaft.
Für die chemische Industrie ist GBL unersetzlich, was der wesentliche Grund dafür ist, dass es im Gegensatz zu GHB nicht als illegales Betäubungsmittel eingestuft wird. GBL findet seit dem Verbot von GHB auch als Droge Verwendung und dient zudem als Grundstoff für die Herstellung von GHB.
Droge
GBL induziert bei oraler Aufnahme geringer Mengen einen Rausch, der partiell dem Alkoholrausch ähnelt. Weitere mögliche Wirkungen sind Euphorie, Schwindel, Übelkeit, Somnolenz, Mydriasis, starke Entspannung der Muskeln und manchmal auch Kopfschmerzen. Auch Herz-Kreislaufprobleme können sich ergeben, da GBL auf die Katecholamin-Rezeptoren im Gehirn wirkt [6]. Höhere Dosen führen zu einem narkotischen Zustandsbild. Das zu GHB metabolisierte GBL wirkt also als Schlafmittel oder Narkotikum.
GBL kann bei chronischem Abusus zu einer körperlichen und psychischen Abhängigkeit führen. Todesfälle durch Monokonsum von GBL sind bisher nur vereinzelt bei extremen Überdosierungen und bei Behandlungsfehlern vorgekommen. Besonders gefährlich ist jedoch der Mischkonsum mit zentral dämpfend wirkenden Drogen, z. B. Alkohol oder Heroin.
In Kombination mit Alkohol oder atemdepressiv wirkenden Medikamenten (z.B. Benzodiazepinen) kann es zu Übelkeit und Erbrechen kommen, was durch die narkotisierende Eigenschaft der Droge zum Erstickungstod führen kann.[7] Außerdem kann eine lebensbedrohliche Atemdepression und Bradykardie auftreten.[6]
Wegen der einschläfernden Wirkung wird der Zustand der betroffenen Person von Sanitätern und Helfern oft falsch eingeschätzt. Meist wird eine Überdosierung von Benzodiazepinen vermutet, so dass oft eine intensivmedizinische symptomatische Behandlung (unter Umständen auch die zusätzliche Gabe von Flumazenil) vorgenommen wird.
Pharmakokinetik
GBL wird im Blut durch die 1,4-Lactonase zu GHB hydrolysiert. GBL wird nach oraler Einnahme schneller resorbiert als GHB, so dass der Plasmaspiegel von GHB bei der Einnahme von GBL schneller ansteigt als bei Einnahme von GHB selbst. Die Plasmahalbwertszeit von GBL beträgt auf Grund rascher Metabolisierung zu GHB weniger als 60 Sekunden, das heißt fünf Minuten nach der Einnahme von GBL sind im Körper noch etwa 3 % des Gamma-Butyrolactons vorhanden.
GBL wird komplett zu GHB umgewandelt, letzteres ist maximal zwölf Stunden via GC-MS (Kopplung eines Gaschromatographen (GC) mit einem Massenspektrometer (MS)) im Urin nachweisbar und wird primär durch Alkoholdehydrogenase (ADH)/Aldehyddehydrogenasen (ALDH) im Körper zu Bernsteinsäure metabolisiert, welche ihrerseits in den Citratzyklus übergeht. Als Abbauprodukte bleiben letztlich nur Kohlenstoffdioxid und Wasser. Zu geringen Teilen entstehen auch Metabolite durch β-Oxidation, welche renal ausgeschieden werden.
Schäden durch Dauerkonsum
Bei unverdünntem Konsum werden die Magenschleimhaut, die Speiseröhre und Dick- und Dünndarmzellen angegriffen und die Wundheilung ist verzögert. Unverdünntes GBL löst Calcium aus dem Zahnschmelz.
Eine weitere Gefahr stellen Verunreinigungen dar, die in dem zumeist konsumierten nicht analysenreinen Industrie-GBL enthalten sein können.
Beim Absetzen von GBL nach langfristigem Gebrauch (zwei bis drei Wochen) stellen sich Entzugsbeschwerden ein, welche qualitativ denen bei Benzodiazepinen gleichen, jedoch in Intensität und Dauer (zwölf bis 96 Stunden) nicht das Ausmaß erreichen. Charakteristisch sind Schlaflosigkeit, enormes Schwitzen, Muskelzittern und psychomotorische Unruhe, Aggressivität, Angstzustände, epileptische Anfälle bis hin zu Halluzinationen und andere körperliche Beschwerden wie zum Beispiel Durchfall oder Übelkeit. Es kann bei entsprechender Prädisposition von akuten psychotischen Symptomen (Wahnvorstellungen, Wahrnehmungsstörungen, Halluzinationen, Depersonalisierung, Derealisation, teils auch Dissoziation und epileptische Krampfanfälle) begleitet werden, die je nach Intensität klinischer Hilfe bedürfen.
Toxizität
Die Toxizität von GBL wurde auf Grund seiner vielfältigen Verwendung in der chemischen Industrie, unter anderem auch bei der Produktion von Lebensmitteln, recht eingehend erforscht. Tierversuche haben ergeben, dass GBL innerhalb weniger Minuten zu GHB metabolisiert wird und binnen zwei bis drei Stunden als CO2 mit der Atemluft wieder ausgeschieden wird. LD50-Werte bei einmaliger Verabreichung von GBL für Mäuse liegen im Bereich zwischen 0,5 und 1,8 g pro Kilogramm Körpergewicht. Mehrmonatige Verabreichungen an Tiere in kleineren Dosierungen sind schadlos überstanden worden. Männliche Ratten, denen über Monate GBL verabreicht wurde, hatten interessanterweise eine höhere Lebenserwartung im Vergleich zur Kontrollgruppe.[8] GBL ist weder gentoxisch noch krebserregend.
Sicherheitshinweise
GBL ist eine schleimhautreizende, gesundheitsschädliche Substanz. Daher müssen beim Arbeiten mit GBL eine Schutzbrille und Schutzhandschuhe getragen werden. Mit GBL verunreinigte Kleidung muss sofort entfernt werden. Des Weiteren muss beim Arbeiten mit GBL für eine gute Belüftung gesorgt werden. Nach Hautkontakt müssen betroffene Stellen mit Seife und Wasser gründlich abgewaschen werden. Nach Augenkontakt muss das betroffene Auge mindestens 15 Minuten mit fließendem Wasser gespült werden und anschließend ein Augenarzt aufgesucht werden. Wird GBL versehentlich verschluckt, muss der Mund sofort mit Wasser gespült und reichlich Wasser nachgetrunken werden.
Brennendes GBL kann mit Wasser, Trockenlöschmitteln, Schaum und Kohlenstoffdioxid gelöscht werden, wobei Chemikalienschutzkleidung getragen werden muss. Kontaminiertes Löschwasser muss getrennt gesammelt werden und darf nicht in die Kanalisation gelangen.
GBL muss an einem gut belüfteten Ort und getrennt von Alkalien und basenbildenden Substanzen gelagert werden.
Rechtliche Situation
GBL ist nicht im Betäubungsmittelgesetz aufgeführt, doch wird die Abgabe in Europa größtenteils durch die Vertreiber überwacht (Monitoring). Der Besitz ist nicht strafbar, ist aber durch das Chemikaliengesetz und die GefStoffV geregelt. Strafbar ist der Missbrauch von GBL zur Synthese von GHB sowie die zweckentfremdete Abgabe / Verkauf zum Konsum (Arzneimittelgesetz). In den letzten Jahren war ein Anstieg des GBL-Konsums zu beobachten auf Grund des Verbots von GHB.
Quellen
- ↑ a b c d e f g Sicherheitsdatenblatt (Merck)
- ↑ Eintrag zu γ-Butyrolacton in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. Mai 2008 (JavaScript erforderlich)
- ↑ a b Butyro-1,4-lacton bei ChemIDplus
- ↑ PMID 11569560
- ↑ Patent WO9935113
- ↑ a b BG Chemie Toxikologische Bewertung Nr. 7 γ-Butyrolacton Ausgabe 11/00, redaktionelle Überarbeitung 01/05, ISSN 0937-4248
- ↑ Hansjörg Lammers, Gammahydroxybuttersäure (GHB) in COmed 2004, 7, 1-3
- ↑ NTP Study Reports TR-406 Toxicology and Carcinogenesis Studies of γ-Butyrolactone (CAS No. 96-48-0) in F344/N Rats and B6C3F1 Mice (Gavage Studies) oder Cognitive Enhancement Research Institute Discussion
Weblinks
- The Emergence of GHB Alternatives(GBL als GHB Alternative-engl.)
- The Commercial Chemistry of GHB (Zusammenhang GHB/GBL chemisch-engl.)
- Toxikologische Bewertung der BG Chemie
- Anfragen über GBL- u. GHB-Vergiftungen an das Toxzentrum der Schweiz
- Datenblatt der BASF
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.