- Hydroxylysin
-
Strukturformel 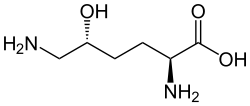
Allgemeines Name Hydroxylysin Andere Namen - 5-Hydroxylysin
- (2S,5R)-2,6-Diamino-5-hydroxyhexansäure
Summenformel C6H14N2O3 CAS-Nummer - 28902-93-4
- 13204-98-3 (Hydrochlorid)
PubChem 3032849 Kurzbeschreibung beiges Pulver (Hydrochlorid)[1]
Eigenschaften Molare Masse 162,187 g·mol−1 Aggregatzustand fest
Schmelzpunkt Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze [1] EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Hydroxylysin (genauer 5-Hydroxy-L-lysin, Abk. Hyl) ist eine proteinogene aber nicht-kanonische Aminosäure.
Inhaltsverzeichnis
Biosynthese
Obgleich in Proteinen vorkommend, kann diese Aminosäure während der Translation nicht direkt in Polypeptide eingebaut werden. Erst nach Einbau von Lysin kann dessen Oxidation zum Hydroxylysin durch das Enzym Lysylhydroxylase erfolgen (posttranslationale Modifikation).
Vorkommen
5-Hydroxylysin kommt im Kollagen (nur bei Tieren und Menschen) und in einigen anderen Glykoproteinen wie Adiponektin vor.
Hydroxylysin wurde auch in Bakterien nachgewiesen, so in Staphylococcus aureus.[2]
Innerhalb eines Kollagenpolypeptids ist das Verteilungsmuster der hydroxylierten Lysine weder starr noch völlig flexibel, d. h. in bestimmten Positionen wird nie eine Hydroxylierung gefunden, an manchen immer (außer bei bestimmten Bindegewebserkrankungen) und an anderen sehr oft bis sehr selten. Innerhalb der Kollagen-Tripelhelix kommt hydroxyliertes Lysin fast nur in Y-Position der Gly-X-Y-Sequenz vor, also: Gly-X-Hyl (zur näheren Erläuterung der Tripelhelixsequenz siehe Kollagen). Innerhalb der kurzen nicht tripelhelikalen Bereiche des Kollagens kann es auch an anderen Stellen gefunden werden (z. B. X-Hyl-Ala oder X-Hyl-Ser).
Eigenschaften
Wie Lysin besitzt Hydroxylysin eine freie Aminogruppe in der Seitenkette. Es gehört damit zur Gruppe der basischen Aminosäuren oder Hexonbasen, neben Arginin und Histidin. Diese besitzen eine basische Gruppe, durch die sie alkalisch reagieren. Die Ladung des Hydroxylysins ist pH-abhängig (pK-Wert: ≈10).
Funktionen
5-Hydroxylysin dient bei manchen Glykosylierungen als Ansatzpunkt für den jeweils ersten Zuckerrest. Im Kollagen erfüllt es zum Einen ebenfalls diese Funktion, an anderen Stellen dient es als Ansatzpunkt für kovalente Quervernetzungen zwischen einzelnen Kollagenmolekülen und zwischen ganzen Kollagenfibrillen.
Ein Mangel von Hydroxylysin innerhalb der Kollagenmoleküle verursacht eine Bindegewebeschwäche und ist in der Regel auf inaktive Lysylhydroxylase zurückzuführen. Grund dafür kann eine genetische Anomalie sein (Ehlers-Danlos-Syndrom VI) oder eine Vergiftung (etwa durch den spezifischen Inhibitor BAPN = β-Aminopropionitril, Begleitvergiftung beim Lathyrismus). Ein vollständiger Hydroxylysinmangel ist lethal, bei Säugetieren ist dann wahrscheinlich nicht einmal eine Lebendgeburt möglich.
Eine Mangel an Hydroxylysin innerhalb von Proteinen lässt sich durch Aufnahme von Hydroxylysin nicht direkt ausgleichen, da zumindest ein Direkteinbau in Polypeptide während der Translation physiologisch nicht möglich ist. Hydroxylysin wird jedoch als wertvolle Nahrungsergänzung angeboten. Eine besonderer Nutzen ist jedoch fraglich.
Die Verhinderung der Oxidierung von Lysin zum Hydroxylysin durch den Inhibitor BAPN zu therapeutischen Zwecken wird erwogen.[3]
Bestimmung
Der Hydroxylysin-Nachweis im Urin wird zur Quantifizierung des Kollagenmetabolismus der Knochen genommen.[4]
Einzelnachweise
- ↑ a b c d e Datenblatt DL-5-Hydroxylysine hydrochloride bei Sigma-Aldrich, abgerufen am 4. April 2011.
- ↑ W. Grady Smith, Daniel P. Gilboe, and L. M. Henderson: Incorporation of Hydroxylysine into the Cell Wall and a Cell-Wall Precursor in Staphylococcus aureus, in: J. Bacteriol. 1965, 1, 89, S. 136–140; PMC 315560.
- ↑ United States Patent 4444787
- ↑ K. Yoshihara et. al.: Urinary excretion levels of hydroxylysine glycosides in osteoporotic patients, in: Biol. Pharm. Bull. 1994, 6, 17, S. 836–839; PMID 7951149.
Weblinks
 Proteinogene Aminosäuren
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Hydroxylysin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.
