- L-Arginin
-
Strukturformel 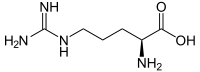
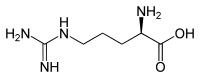
L-Arginin (oben) bzw. D-Arginin (unten)Allgemeines Name Arginin Andere Namen - L-Arginin, Arg, R
- α-Amino-δ-guanidinvaleriansäure
Summenformel C6H14N4O2 CAS-Nummer - 74-79-3 (L-Enantiomer)
- 157-06-2 (D-Enantiomer)
PubChem 6322 ATC-Code V06[1]
DrugBank DB00125 Kurzbeschreibung weißer Feststoff Eigenschaften Molare Masse 174,20 g·mol−1 Aggregatzustand fest
Dichte 0,7 g·cm−3[1]
Schmelzpunkt 238 °C[1]
Löslichkeit gut in Wasser (150 g·l−1 bei 20 °C[1])
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36 S: 26 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 oral 5110 mg·kg−1 (Ratte)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. L-Arginin ist eine proteinogene α-Aminosäure. Für den Menschen ist sie semi- bzw. halb-essentiell. Der Name leitet sich vom lateinischen Wort argentum (Silber) ab, da die Aminosäure zuerst als Silber-Salz isoliert werden konnte. Diese Aminosäure hat den höchsten Masseanteil an Stickstoff von allen proteinogenen Aminosäuren. Im Dreibuchstabencode wird L-Arginin mit Arg und im Einbuchstabencode als R abgekürzt.
Inhaltsverzeichnis
Struktur
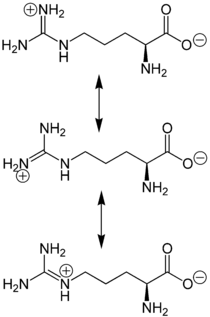
Arginin ist eine α-Aminosäure mit einer Guanidin-Funktionalität in der Seitenkette. Gemeinsam mit L-Lysin und L-Histidin gehört L-Arginin in die Gruppe der „basischen“ Aminosäuren oder Hexonbasen. Diese besitzen eine basische Gruppe, hier eine Guanidinogruppe, die im Neutralbereich stets protoniert (positiv geladen) ist. Arginin ist gut in Wasser löslich und reagiert (durch Bindung von Protonen) alkalisch. Der pKa-Wert der Guanidin-Gruppe liegt bei 12,1 (stark basisch), der Aminogruppe bei 9,0 und der Säuregruppe bei 2,0.[2] Die Guanidin-Gruppe ist sowohl im sauren und neutralen, als auch im schwach basischen Milieu protoniert und trägt eine positive Ladung, die zwischen den Aminogruppen delokalisiert ist. Proteine, die L-Arginin enthalten, werden durch diese Ladung hydrophiler, also wasserlöslicher.
Stereoisomerie
In den Proteinen kommt ausschließlich L-Arginin [Synonym: (S)-Arginin] peptidisch gebunden vor. Enantiomer dazu ist das spiegelbildliche D-Arginin [Synonym: (R)-Arginin], das in Proteinen nicht vorkommt. Racemisches DL-Arginin [Synonym: (RS)-Arginin] besitzt geringe Bedeutung.
Eigenschaften
Arginin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxylgruppe zum Guanidino-Rest wandert, der stärker basisch als die α-Aminogruppe ist:[3]
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert, hier 11,2[4]) der Fall, bei dem das Arginin auch seine geringste Löslichkeit in Wasser besitzt.
Vorkommen
L-Arginin ist weit verbreitet. Es findet sich in fast allen Eiweißen und in freier Form in vielen Pflanzen, beispielsweise Buchweizen, Kürbisgewächsen und Nadelhölzern. L-Arginin kommt in fast allen Proteinen vor.
Biosynthese
Im Harnstoffzyklus entsteht L-Arginin aus Carbamoylphosphat, L-Ornithin und L-Aspartat und dient dabei der Entgiftung des Körpers von Ammoniak.
Funktionen
L-Arginin dient in Keimlingen und Speicherzellen als Stickstoff-Reservoir. L-Arginin ist ein Metabolit des Harnstoffzyklus, in dem der Ammoniak, der beim Abbau von Stickstoffverbindungen (z. B. Aminosäuren) entsteht, in Harnstoff umgewandelt wird.
L-Arginin ist eine Quelle energiereicher Stickstoff-Phosphat-Verbindungen in Organismen und ist an zahlreichen Funktionen im Körper beteiligt. L-Arginin ist die alleinige Vorstufe von Stickstoffmonoxid (NO), einer der kleinsten und schnellflüchtigsten Botenstoffe im menschlichen Körper. 1998 erhielten die Wissenschaftler Robert F. Furchgott, Louis J. Ignarro und Ferid Murad für die Erforschung des Zusammenhangs von Arginin und NO den Nobelpreis für Medizin. Die Freisetzung von NO aus L-Arginin führt physiologischerweise zu einer Gefäßerweiterung und Hemmung der Thrombozytenaggregation und -adhäsion. Dadurch wird die Bereitschaft für thrombotische Veränderungen sowie Gefäßplaqueabbrüche herabgesetzt. Zusätzlich wird die Ausbildung der endothelialen Dysfunktion (gestörten Gefäßfunktion) verhindert.[5]
Bedarf
Der Mensch kann innerhalb des Harnstoffzyklus Arginin selbst synthetisieren, allerdings sind die entstehenden Mengen nicht ausreichend, um den Bedarf vor allem bei heranwachsenden Menschen vollständig zu decken. Daher ist L-Arginin für Kinder essentiell. Aber auch bei Erwachsenen wird der Bedarf an L-Arginin durch die körpereigene Produktion oft nicht ausreichend abgedeckt. Besonders in der Wachstumsphase, durch Stress, bei diversen Krankheiten (z. B. Arteriosklerose, Bluthochdruck, erektile Dysfunktion, Gefäßerkrankungen) oder nach Unfällen übersteigt der Bedarf an Arginin die vom menschlichen Organismus produzierte Menge. Arginin wird daher heute zu den essentiellen Aminosäuren gezählt.
Quellen
- ↑ a b c d e Sicherheitsadatenblatt (Carl Roth).
- ↑ Teresa, K.-J. et al. (2007): Nickel Ion Complexes of Amino Acids and Peptides. In: Metal Ions in Life Sciences Band 2: Nickel and Its Surprising Impact in Nature; John Wiley & Sons; ISBN 978-0-470-01671-8; doi:10.1002/9780470028131.ch3; S. 67
- ↑ Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, 1982, S. 42, ISBN 3-527-25892-2.
- ↑ Norman L. Allinger, Michael P. Cava, Don C. de Jongh, Carl R. Johnson, Norman A. Lebel und Calvin L. Stevens: Organische Chemie, Verlag Walther de Gruyter, 1980, S. 1129, ISBN 3-11-004594-X.
- ↑ Landmesser, U. et al. (2004): Endothelial function: a critical determinant in atherosclerosis? In: Circulation 109(21 Suppl 1); II27–33; PMID 15173060 ; PDF (freier Volltextzugriff, engl.)
Weblinks
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.