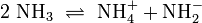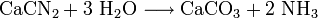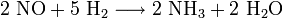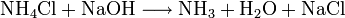- NH3
-
Strukturformel 
Allgemeines Name Ammoniak Andere Namen - Azan
- R717
Summenformel NH3 CAS-Nummer 7664-41-7 Kurzbeschreibung farbloses, stechend riechendes Gas Eigenschaften Molare Masse 17,03 g·mol−1 Aggregatzustand gasförmig
Dichte 0,7714 kg·m−3 @ 0 °C, 1,013 bar[1]
Schmelzpunkt −77,7 °C[1]
Siedepunkt −33 °C[1]
Dampfdruck 8,5737 bar (20 °C)[1]
pKs-Wert Löslichkeit 541 g·l−1 in Wasser (20 °C)[1], gut löslich in Alkohol, Aceton, schlecht in Hexan
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 10-23-34-50 S: (1/2)-9-16-26-36/37/39-45-61 MAK 14 mg·m−3[1]
Thermodynamische Eigenschaften ΔHf0 −46,1 kJ·mol−1[5]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ammoniak ist eine chemische Verbindung von Stickstoff und Wasserstoff mit der Summenformel NH3. Benannt ist es nach dem Ammonssalz Ammoniumchlorid (lat. „sal ammoniacum“, ammonisches Salz, dies aus gr. „ammōniakón“, Oase Ammon, heute Oase Siwa).[6] Ammoniak ist ein stark stechend riechendes, farbloses und giftiges Gas, das zu Tränen reizt und erstickend wirkt. Die Dichte von Ammoniakgas ist geringer als die Dichte der Luft. Es wird zur Herstellung von Düngemittel, Farbstoffen und Sprengstoff verwendet. Ammoniak ist eine Base. Es ist gut wasserlöslich und bildet dann Salmiakgeist (Ammoniumhydroxid). Ammoniak wird mit den UN-Nummern 1005 für das Gas bzw. 2672 für die wässrige Lösung bezeichnet.
Inhaltsverzeichnis
Weitere Eigenschaften
kritische Temperatur 132,5 °C kritischer Druck etwa 11,3 MPa (Megapascal) pKb 4,75 Schmelzwärme 5,655 kJ/mol (bei −77 °C) Verdampfungsenthalpie 22 kJ/mol (bei −33 °C) Lösungswärme 30,5 kJ/mol (bei 25 °C) Wärmekapazität cp 35,6 J/(mol K) bei 298 K Wärmeleitfähigkeit 0,02494 W/(m K) Schallgeschwindigkeit 414 m/s Ammoniak ist sehr gut wasserlöslich, bei 0 °C lösen sich in 100 ml Wasser 90,7 g (≙ 120 l). Eine Ammoniaklösung heißt Salmiakgeist (Ammoniumhydroxid). Sie reagiert alkalisch. Ammoniak hat einen stechenden Geruch.
Ammoniak-Luft-Gemische sind im Bereich von 15,5 bis 30 Vol.-% Ammoniak explosionsfähig. An heißen Oberflächen ab 630 °C kann es zum Zerfall in Stickstoff und Wasserstoff kommen; diese Zerfallsreaktion wird durch Metalle katalysiert, so dass in großtechnischen Anlagen schon bei Oberflächentemperaturen ab 300 °C die Möglichkeit einer explosionsartigen Zersetzung besteht. Es verbrennt schnell und vollständig, so dass anschließend kein NH3 mehr wahrnehmbar ist.
Ammoniak wirkt auf feuchte Körperoberflächen ätzend. Insbesondere feuchte Haut, Schleimhäute, Lungen und Augen werden daher verätzt. Geschluckt ruft es blutiges Erbrechen mit heftigen Schmerzen und eingeatmet Lungenschäden hervor, unter Umständen mit tödlichem Ausgang. Ein Ammoniakgehalt der Luft von 0,5 % (5000 ppm) wirkt nach 30 bis 60 Minuten tödlich.
Säure-Base-Eigenschaften
Ammoniak ist amphoter, kann also als Base und als Säure reagieren. Es bildet als Base unter Protonierung ionische Ammoniumsalze, als Säure mit starken Basen unter Deprotonierung ionische Amide. In flüssigem Ammoniak besteht daher ein Autoprotolysegleichgewicht, das durch ein Ionenprodukt beschrieben werden kann.
Struktur
Das Ammoniak-Molekül ist nicht eben gebaut, sondern entspricht einer dreiseitigen Pyramide (trigonal-pyramidal). Sie leitet sich von einem Tetraeder ab, in dem das freie (nicht-bindende) Elektronenpaar des Stickstoffs eine Ecke besetzt. Aufgrund der Ladungsabstoßung zwischen den N–H-Bindungselektronen und dem freien Elektronenpaar des Stickstoffs, welches ebenfalls Raum beansprucht, liegen die drei Wasserstoffatome nicht mit dem Stickstoffatom in einer Ebene. Auf diese Weise sind die N–H-Bindungselektronen und das freie Elektronenpaar maximal weit voneinander entfernt. Wegen der höheren Elektronegativität des Stickstoffs gegenüber Wasserstoff und durch die Winkelung ist das Molekül polarisiert: in der Nähe des freien Elektronenpaars liegt eine höhere negative Ladungsdichte vor. Dies ist daher der bevorzugte Angriffsort für Elektrophile, zum Beispiel H+. Bei Raumtemperatur ist das Ammoniakmolekül nicht starr. Das freie Elektronenpaar kann sich auf die gegenüberliegende Seite verlagern, wobei die Wasserstoffatome ebenfalls auf die andere Seite ausweichen. Dadurch kommt es zu einem „Durchschwingen“ des Moleküls, das sich anschaulich mit dem Umklappen eines Regenschirms vergleichen lässt. Diese Eigenschaft trifft auch auf die vom Ammoniak abgeleiteten Verbindungen zu (zum Beispiel Amine), sofern sie nicht durch eine starre Geometrie des Restmoleküls am „Durchschwingen“ gehindert werden.
Nachweis
- Klassische Nachweisreaktionen: Eine vorsichtige Geruchsprobe reicht meistens aus. Geringe Gasmengen können beispielsweise mit angefeuchtetem Indikatorpapier nachgewiesen werden, welches auf die bei der Reaktion von Ammoniak und Wasser entstehenden OH−-Ionen mit Färbung reagiert.
- Photometrisches Verfahren I: Ammoniak reagiert mit Tetraiodomercurat zu einer orangefarbenen Verbindung (Nessler-Reaktion), mit Kupfersulfatlösung zum tiefblauen Kupfertetraamminkomplex (Komplexbildungsreaktion).
- Photometrisches Verfahren II: Ammoniak bildet mit Hypochlorit-Ionen Chloramin. Dieses bildet mit Phenolen farbige Indophenole. Dieser Nachweis wird Indophenolreaktion oder Berthelot-Reaktion genannt.
Herstellung
Die Herstellung geschieht heute im industriellen Maßstab zum weitaus größten Teil (ca. 90 % der Welterzeugung) aus Wasserstoff und Stickstoff nach dem Haber-Bosch-Verfahren.
Alternative Herstellungsverfahren sind die Gewinnung aus Kalkstickstoff (Kalkstickstoffverfahren von Rothe-Frank-Caro)
oder durch Hydrolyse von Nitriden (Serpek-Verfahren)
Beide Verfahren haben keine nennenswerte technische Bedeutung, da die Synthese nach dem Haber-Bosch-Verfahren billiger ist.
Ein weiterer Weg der NH3-Erzeugung ist die Reduktion von Stickstoffmonoxid (NO) mit Wasserstoff (H2):
Man kann ihn auch mit Natronlauge aus Salmiaksalz (Ammoniumchlorid) herauslösen (Verdrängungsreaktion; das ist zugleich eine Nachweisreaktion für Ammoniumsalze):
Verwendung und Verschiedenes
Ammoniak ist eines der wichtigsten und häufigsten Produkte der chemischen Industrie. Heute beträgt die Weltjahresproduktion von Ammoniak etwa 125 Millionen Tonnen. Circa 3 % der weltweit produzierten Energie wird für die Herstellung von Ammoniak aufgebraucht. Der Großteil dieser Produktion wird als Ausgangsstoff für Stickstoffdünger verwendet. Weitere Anwendungen von Ammoniak:
- 1949 wurden Ammoniakmoleküle für den Betrieb der ersten Atomuhr verwendet.
- In der Sprengstoffindustrie zur Herstellung von Sprengstoffen.
- In der Tabakindustrie zur Verstärkung der Nikotinaufnahme aus Zigaretten.
- Flüssiges Ammoniak wird wegen seiner hohen Verdampfungswärme in Kältemaschinen eingesetzt (Kältemittel-Bezeichnung R717).
- In der Textilveredlung, zum Plastifizieren von Holz und als nichtwässriges Lösungsmittel.
- Gasförmiges Ammoniak wird als Destraktions-Mittel verwendet.
- In wasserfreier, verflüssigter Form wird Ammoniak als Reagenz und Lösungsmittel für die Birch-Reduktion in der organisch-chemischen Synthese verwendet.
- In der Metall-Industrie wird es als Ammoniak-Spaltgas[7] zur Nitrierhärtung und als Schutzgas zur Wärmebehandlung, auch zum Blankglühen, verwendet[8].
- Ammoniakwasser findet Verwendung zu Reinigungs- und Beizzwecken. Es wird zum Unschädlichmachen von Chlor und Formaldehyd nach Desinfektionsmaßnahmen eingesetzt.
- Ammoniak kann auch zur Entschwefelung von Rauchgas verwendet werden. Hierbei bildet sich Ammoniumsulfat, das als Düngemittel verwertet wird.
- Lange Zeit wurde konzentriertes Ammoniak (ca. 35%ig in Wasser) zur Entwicklung von Lichtpausen verwendet.
- Sowohl bei der Rauchgasreinigung von Kraftwerken wie auch bei der Abgasreinigung von Dieselmotoren wird Ammoniak zur Entstickung eingesetzt (SCR-Verfahren).
- In Dampfkraftwerken und anderen Dampfsystemen wird Ammoniak als Korrosionsinhibitor durch Alkalisierung von Kondensat und Speisewasser verwendet. Hierbei wirkt positiv aus, dass Ammoniak im Gegensatz zu anderen Alkalisierungsmitteln auch in die Dampfphase übertritt und so auch die Dampfleitungen schützt.
- Ammoniak wird zur Herstellung von Arzneimitteln eingesetzt.
- Ammoniakwasser wird in Chlorgasanlagen zur Dichtigkeitsprüfung eingesetzt; an Lecks kommt es aufgrund des entstehenden Ammoniumchlorids [NH4Cl] zur Nebelbildung.
- Es erlangt in flüssiger und überkritischer Form immer mehr Bedeutung als nicht oxidierendes Lösungsmittel, unter anderem wegen seiner physikalisch-chemischen Ähnlichkeit zu Wasser (Wasserstoffbrückenbindungen, Eigendissoziation 2 NH3 → NH4+ + NH2−, usw.).
- Ammoniak wird vom Bakterium Helicobacter pylori im Magen mit Hilfe des Enzyms Urease aus dem im Magen enthaltenen Harnstoff hergestellt, um die Magensäure zu neutralisieren und somit im Magen überleben zu können. Dieses Bakterium ist die häufigste Ursache für Magengeschwüre.
- Bei der Hepatischen Enzephalopathie finden sich bei ca. 90% der Patienten erhöhte Ammoniakspiegel(>100µg/l) im Blut, zurückzuführen auf eine verminderte Bikarbonat- Elimination in der Leber. Ammoniak wird vermehrt ins Gehirn aufgenommen und behindert dort Stoffwechselvorgänge, wodurch es zu einer Dämpfung der neuronale Aktivität kommen kann.[9]
- Aus Ammoniak werden zahlreiche weitere Vorprodukte hergestellt. Hierbei sind besonders zu nennen:
Ammoniak _________|_________________________________ | | | Oxidation | | sämtlicher | (NH2)2CO (Harnstoff) weiterer | / \ organischer Salpetersäure Kunstharze \ und / / | | \ Düngemittel anorganischer Nitrate / | | \ Stickstoff / | | \ / / | \ Düngemittel / | \ Hydroxylamin / | Nitrile / | Nitroaromaten / | / Adipinsäure \ Amine Hydrazin Sprengstoffe Anilin(-derivate)
Quellen
- ↑ a b c d e f Eintrag zu Ammoniak in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 28. Juni 2008 (JavaScript erforderlich)
- ↑ Christen, Meyer: Grundlagen der allgemeinen und anorganischen Chemie. Diesterweg, 1997, ISBN 978-3793554936.
- ↑ Frederick G. Bordwell, George E. Drucker und Herbert E. Fried: Acidities of Carbon and Nitrogen Acids: The Aromaticity of the Cyclopentadienyl Anion, in: J. Org. Chem. 1981, 46, 632-635 doi:10.1021/jo00316a032
- ↑ Eintrag zu CAS-Nr. 7664-41-7 im European chemical Substances Information System ESIS
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116
- ↑ Wissens-Center: Ammoniak in der Bertelsmann Lexikothek Online, abgerufen am 25. April 2009
- ↑ Ammoniakspalter zur Herstellung von Wasserstoff bzw. Formiergas.
- ↑ Thermische Behandlung von Stahl; Glühen und Härten.
- ↑ K. Arastéh et al.: Duale Reihe Innere Medizin, 2. Auflage, Stuttgart 2009, S.610f
Literatur
- Robert Schlögl: Katalytische Ammoniaksynthese - eine „unendliche Geschichte“? Angewandte Chemie 115(18), S. 2050–2055 (2003), ISSN 0044-8249
Weblinks
- Umweltberatung: Ammoniak und Ammonium
- Ammoniak-Springbrunnen Schauversuch zum Nachweis der ausgezeichneten Wasserlöslichkeit: Versuchsanleitung und Video
Wikimedia Foundation.