- Tigerpython
-
Tigerpython 
Dunkler Tigerpython (Python molurus bivittatus)
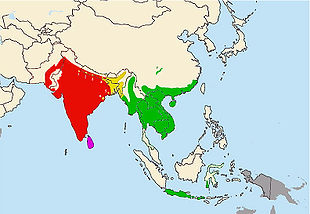
Systematik Unterordnung: Schlangen (Serpentes) Überfamilie: Wühl- und Riesenschlangenartige (Boidea) Familie: Riesenschlangen (Boidae) Unterfamilie: Pythons (Pythoninae) Gattung: Eigentliche Pythons (Python) Art: Tigerpython Wissenschaftlicher Name Python molurus (Linnaeus, 1758) Der Tigerpython (Python molurus) ist eine Schlangenart aus der Familie der Riesenschlangen und wird dort in die Unterfamilie der Pythons gestellt. Zwei Unterarten werden anerkannt, für die neuerdings auch Artstatus diskutiert wird: Der Helle Tigerpython (Python molurus molurus) und der Dunkle Tigerpython (P. m. bivittatus). Die dunkle Unterart gehört mit gesicherten Längen über fünf Meter zu den größten Schlangen der Welt. Das Verbreitungsgebiet umfasst weite Teile der Tropen und Subtropen Süd- und Südostasiens. Die Art bewohnt dort ein weites Spektrum bewaldeter Habitate in nicht zu großer Entfernung von Gewässern und zumindest gelegentlich auch Randbereiche menschlicher Siedlungen. Seit einigen Jahrzehnten hat sich außerdem eine durch illegale Auswilderungen begründete Population in Florida etabliert.
Die Nahrung besteht je nach Größe der Pythons aus kleinen bis mittelgroßen, sehr selten auch großen Wirbeltieren bis hin zu halbwüchsigen Schweinshirschen und erwachsenen Leoparden. Tigerpythons sind wie alle Arten der Gattung Python eierlegend (ovipar) und gehören zu den Arten, bei denen die Weibchen die Bebrütungstemperatur durch Muskelzittern deutlich erhöhen können. Der Tigerpython wird aufgrund seiner Gefährdung durch direkte Verfolgung und Habitatzerstörung von der IUCN als Art der Vorwarnliste („near threatened“) geführt.
Inhaltsverzeichnis
Beschreibung
Körperbau und Erbgut
Juvenile Tiere sind recht schlank gebaut, adulte Tigerpythons haben jedoch einen sehr kräftigen Körper. Hinsichtlich Körperlänge und -gewicht ist ein deutlicher Geschlechtsdimorphismus vorhanden: Weibchen sind im Mittel erheblich größer und schwerer als Männchen. Der Kopf ist wuchtig, beinahe zwei mal so lang wie breit und mäßig vom Hals abgesetzt.[1][2] Die seitliche Anordnung der Augen ergibt ein Sehfeld von 135°.[3] Der kräftige Greifschwanz macht bei Weibchen etwa 12 % und bei Männchen bis zu 14 % der Gesamtlänge aus. Aftersporne sind bei Männchen deutlich prominenter ausgebildet als bei Weibchen.[4] Das Erbgut besteht aus 36 diploiden Chromosomen (2n = 36) mit 16 Makrochromosomen und 20 Mikrochromosomen.[5]
Beschuppung
Die Nasenlöcher sind dorsal angeordnet und jeweils von einer großen nasalen Schuppe umgeben. Die Nasalia (Nasenschilde) sind voneinander durch ein Paar kleiner, aber deutlich erkennbarer Internasalia (Zwischennasenschilde) getrennt. An diese grenzen wiederum rechteckähnliche Präfrontalia (Vorstirnschilde) an. Ein zweites, viel kleineres Paar Präfrontalia, welches oftmals in mehrere kleine Schuppen geteilt ist, liegt zwischen den vorderen Präfrontalia und den sehr ähnlich geformten paarigen Frontalia (Stirnschilde). Über den Augen befindet sich ein großes Supraoculare (Überaugenschild). Das Rostrale (Schnauzenschild) hat, wie bei den meisten anderen Pythons, zwei tiefe Labialgruben. An den Kopfseiten folgen den nasalen Schuppen Richtung Auge mehrere Lorealia (Zügelschilde), welche in Größe und Aussehen variieren. Normalerweise sind zwei Präocularia (Voraugenschilde) und drei bis vier Postocularia (Hinteraugenschilde) vorhanden. Die Subocularia (Unteraugenschilde) sind unterartspezifisch ausgebildet. Es gibt 11 bis 13 Supralabialia (Oberlippenschilde), von denen die ersten und zweiten tiefe Labialgruben tragen. Von den 16 bis 18 Infralabialia (Unterlippenschilde) besitzen mehrere vordere und hintere undeutliche Labialgruben.[1]
Die Anzahl der Ventralia (Bauchschilde) variiert je nach Herkunft der Individuen zwischen 245 und 270, die Anzahl der dorsalen Schuppenreihen in der Körpermitte zwischen 58 und 73.[1] Die Anzahl der paarigen Subcaudalia (Schwanzunterseitenschilde) beträgt 57 bis 83. Das Anale (Analschild) ist ungeteilt.[6]
Färbung
Die helle Grundfarbe des Tigerpythons wird zu den Flanken hin blasser. Über den Rücken ziehen 30 bis 38 große, oft rechteckförmig ausgebildete, dunkle Sattelflecken. Auf den Flanken verlaufen alternierend zur Rückenmusterung große dunkle Flecken, welche unterartspezifisch geformt sind. Die helle Bauchseite ist zum Schwanz hin dunkel gesprenkelt. Auf den Kopfseiten verläuft ein spitz zulaufendes, dunkles Band vom Auge Richtung Nase. Ein breiteres, schwarz umrandetes Band zieht vom Auge bis unter den Mundwinkel. Dieses schließt zusammen mit einem unterhalb des Auges liegenden keilförmigen dunklen Fleck ein weißes Areal ein. Von der Nase über die Augen bis zum Nacken verläuft ein pfeilspitzenförmiges braunes Muster mit einem hellen Punkt in der Mitte. Die Farbintensität der Pfeilzeichnung ist unterartspezifisch ausgeprägt.[1]
Gebiss
Die dünnen, länglichen Zähne sind durchgehend spitz und zum Rachen hin gebogen. Am vorderen Teil der oberen Mundhöhle befindet sich das Zwischenkieferbein mit vier kleinen Zähnen. Die Oberkieferknochen tragen jeweils 18 bis 19 Zähne. Hiervon sind der 2. bis 6. Zahn am größten und gleichlang. Zur Maulspitze und zum Rachen hin werden die übrigen Zähne stetig kleiner. Gegen die Mitte der oberen Mundhöhle liegen parallel zu den Oberkieferknochen vorne das Gaumenbein und weiter hinten das Flügelbein. Ersteres hat sechs Zähne, die der Länge derjenigen des vorderen Oberkieferknochenabschnittes entsprechen. Die 8 bis 10 Zähne auf dem Flügelbein sind so lang wie die des hinteren Oberkieferknochens. Die Unterkiefer tragen jeweils 16 bis 19 Zähne. Die Zähne 2 bis 8 sind die größten und etwa gleich lang. Zur Maulspitze und zum Rachen verlieren die übrigen Zähne an Größe.[4]
Systematik
Innerhalb der Eigentlichen Pythons ist der Tigerpython nach einer molekulargenetischen Untersuchung am nächsten mit dem Nördlichen Felsenpython verwandt.[7]
Über die innere Systematik des Tigerpythons wird seit mehr als 200 Jahren kontrovers diskutiert. Aktuell werden zwei Unterarten anerkannt: Die Nominatform Heller Tigerpython (Python molurus molurus) und der Dunkle Tigerpython (P. m. bivittatus) (Kuhl, 1820).[8] Auf Grund neuerer Untersuchungen wird für die beiden Formen Artstatus diskutiert.[9] Die Verbreitungsgebiete der beiden Unterarten überschneiden sich mit Sicherheit in Nordost-Indien, Nepal, West-Bhutan, Südwest-Bangladesch und eventuell auch in Nordwest-Burma[10]. Eine adäquate Untersuchung der Tigerpythons dieser Regionen steht noch aus.[11] Jedoch zeigen bisherige Beobachtungen in Indien und Nepal, dass die beiden Unterarten bei sympatrischem Vorkommen entgegen früheren Annahmen verschiedene, teilweise sogar dieselben Habitate bewohnen und sich untereinander nicht verpaaren.[8] Auch Jacobs et al. (2009) schlagen deshalb vor, den beiden Formen gestützt durch die zwei charakteristischen morphologischen Unterschiede in Kopfseitenbeschuppung und Kopfoberseitenmusterung jeweils Artstatus als Heller Tigerpython (Python molurus) bzw. Dunkler Tigerpython (Python bivittatus) zu verleihen.[9]
Auf den indonesischen Inseln Bali, Sulawesi, Sumbawa und Java sprechen gewisse tiergeographische und morphologische Aspekte für eine Differenzierung von Python m. bivittatus. Diese Populationen sind mehr als 700 Kilometer von den Tieren des Festlands getrennt, zeigen Musterungsunterschiede und haben auf Sulawesi, Bali und Java Zwergformen ausgebildet.[11][12][13] 2009 wurden Tiere aus Sulawesi von Jacobs et al. erstmals genauer untersucht. Aufgrund von Größen- und Färbungsunterschieden schlagen die Autoren vor, diese Zwergform als eigene Unterart abzugrenzen; als wissenschaftlichen Namen schlagen sie, ihrer Erhebung des Dunklen Tigerpythons zu einer eigenen Art folgend, P. bivittatus progschai vor. Molekulargenetische Untersuchungen zum Status dieser Zwergform stehen jedoch noch aus. Wie weit sich die anderen indonesischen Inselpopulationen von der Festlandform abheben, ist ebenfalls noch ungeklärt.[9]
Eine weitere Unterart namens P. m. pimbura, welche ausschließlich auf der Insel Sri Lanka vorkommt, wurde 1945 von Deraniyagala beschrieben. Anhand von Färbung, Musterung und Anzahl der Subcaudalia (Schwanzunterseitenschilde) weniger Tiere wies er auf Unterschiede zur Festlandform von P. m. molurus hin.[14] Jedoch betrachtete bereits Constable 1949 die Unterschiede als nicht ausreichend. Für ihn spiegelten sie eine zu erwartende Variationsbreite von Individuen innerhalb einer Population wider.[15] Seither wurden die Tigerpythons von Sri Lanka nicht mehr ausführlicher morphologisch oder genetisch untersucht. Dennoch findet ihr Unterartstatus heute allgemein keine Unterstützung mehr. Sie werden wieder als Inselpopulation von Python m. molurus geführt.[6]
Heller Tigerpython (Python molurus molurus)
Beschuppung
Der sechste oder siebte Oberlippenschild (Supralabiale) grenzt direkt an den Augenunterrand. Beim Dunklen Tigerpython ist das Auge durch eine vollständige Reihe Unteraugenschilde (Subocularia) von den Supralabialia getrennt.[16]
Färbung
Die Grundfarbe ist weißlich, hellgrau, gelblich oder beige[14] und bei Jungtieren oftmals mit einem rosa Schimmer versehen.[4] Tiere aus den Bergwäldern in West-Ghats, Assam und Sri Lanka[14] sind generell dunkler gezeichnet als solche vom Dekkan-Plateau und der Ostküste Indiens.[17] Die großen beige bis kastanienbraunen Sattelflecken werden von einer feinen dunklen Linie umrandet. Auf dem Festland sind die Sattelflecken meist etwa rechteckig ausgeprägt, während sie besonders bei Tieren von Sri Lanka oft eine unregelmäßige Form zeigen.[4][14] Die schmalen Flankenflecken sind rundlich, dreieckig bis rhombusartig und weisen oftmals einen hellen Kern auf.[18] Die Bauchseite ist weißlich, gelblich oder leicht orange.[17][19] Das pfeilspitzenförmige braune Muster auf der Kopfoberseite ist bei Jungtieren oft noch gut ausgeprägt, jedoch bei Erwachsenen typischerweise von der Nasenspitze zu den Augen hin verwaschen. Bei einigen Individuen verschwindet der Pfeil beinahe komplett und ist nur noch im Bereich des Hinterhauptes erkennbar.[4] Herkunftsunabhängig kann die Kopfoberseite zusätzlich blassrosa gefärbt sein.[4][19] Die Zunge dieser Subspezies ist rosa.[20]
Länge
In Pakistan erreichen Helle Tigerpythons meist eine Gesamtlänge von 2,4 bis 3 Meter.[19] In Indien werden Helle Tigerpythons durchschnittlich 3 Meter lang.[4] Das bestätigt eine Studie im indischen Keoladeo-Nationalpark, wo 1990 Helle Tigerpythons von über 1,5 Meter Gesamtlänge vermessen wurden. Von den 135 Individuen waren die größten 25 % 2,7 bis 3,3 Meter lang. Nur zwei Exemplare erreichten beinahe 3,6 Meter.[18] Wegen zahlreicher Verwechslungen mit dem Dunklen Tigerpython in der Vergangenheit sind gesicherte Angaben zur maximalen Köperlänge für die Unterart kaum verfügbar. Ein sehr großes Exemplar ist aus Pakistan bekannt, es maß gesamthaft 4,6 Meter und wog 52 Kilogramm.[19]
Dunkler Tigerpython (Python molurus bivittatus)
Beschuppung
Das Auge ist von den Oberlippenschilden (Supralabialia) durch eine durchgehende Reihe Unteraugenschilde (Subocularia) getrennt.[16]
Färbung
Der Dunkle Tigerpython ist generell dunkler gemustert als der Helle Tigerpython. Seine Grundfarbe reicht von hellbraun, gelblich bis gräulich. Bei Tieren vom Festland sind die dunkelbraun bis rotbraunen Sattelflecken meist rechteckig geformt und schwarz eingefasst.[2] Die breiten, rechteckigen Flankenflecken besitzen eine braune oder grünbraune Farbe und haben eine schwarze Umrandung.[21] Flankenflecken und die Seitenränder der Sattelflecken sind zudem von einer hellen Aussparung umgeben. Die Bauchseite ist weiß-gelb. Charakteristischerweise ist das große, pfeilspitzenförmige, braune Muster auf der Kopfoberseite deutlich ausgeprägt. Meist reicht dessen Spitze bis zur Schnauzenspitze.[22] Die Zunge dieser Unterart ist blau-schwarz.[20]
Die sulawesische Population ist etwas abweichend gemustert. Diese Tiere zeigen häufig stark unregelmäßig geformte, teilweise zerstückelte und versetzt angeordnete Sattelflecken die Ozellen enthalten können. Charakteristischerweise sind die Sattelflecken zudem komplett von einer deutlichen, hellen Aussparung umgeben. Auch sind die Flankenflecken dieser Population teilweise ozelliert, was für den Dunklen Tigerpython sonst atypische ist.[9]
Länge
Wildlebende Dunkle Tigerpythons vom Festland erreichen gewöhnlich eine Gesamtlänge um 3,7 Meter.[23][2] Tiere ab über 4 Meter sind selten[22], solche von 5 Meter gelten als Ausnahmeerscheinungen.[21] Sehr große Exemplare, wie ein im nordost-indischen Cooch Behar vermessenes Individuum von 5,8 Meter Gesamtlänge und 91 Kilogramm Gewicht, sind äußerst rar.[22][4] Auf Grund zahlreicher nicht abgesicherter Behauptungen und Verwechslungen mit dem Netzpython in der Vergangenheit sind auch gesicherte Angaben zur Maximallänge des Dunklen Tigerpythons kaum möglich. Walls (1998)[1] nennt ein 1836 gemessenes Tier mit einer Gesamtlänge von 9,2 Meter[24] als Längenrekord und spricht von wenigen heute lebenden Exemplaren, welche möglicherweise an die 7,5 Meter lang sind. Schleich & Kästle (2002)[6] lassen ein von Deuve (1970)[21] beschriebenes Individuum mit einer Gesamtlänge von 7,62 Meter gelten, zweifeln aber an den 9,2 Metern. Bellosa (2007)[25] schreibt nichts über das 7,62 Meter lange Tier und bezeichnet keine seiner gesammelten Überlieferungen von über 7 Meter als glaubwürdig. Dunkle Tigerpythons von den indonesischen Inseln Java, Bali und Sulawesi sind wesentlich kleiner (Inselverzwergung).[11] Auf Bali beträgt die Gesamtlänge ausgewachsener Tiere durchschnittlich 2 Meter[13]; die Tiere auf Sulawesi erreichen eine maximale Gesamtlänge von 2,4 Meter.[9]
Verbreitung
Das Verbreitungsgebiet des Hellen Tigerpythons reicht von Südost-Pakistan[26] über Indien und Sri Lanka bis nach Nepal[6], Bhutan und Bangladesch.[20]
Die Verbreitung des Dunklen Tigerpythons schließt sich östlich an die des Hellen Tigerpythons an. Sie erstreckt sich von Nordost-Indien, Nepal, West-Bhutan, Südost-Bangladesch[16] über Burma, Thailand, Kambodscha, Laos, dem nördlichen Teil der Malaiischen Halbinsel, Vietnam bis Südchina mit einer nördlichen, isolierten Population im Sichuan-Becken und inklusive Hainan. Weiter südlich fehlt er auf den Inseln Borneo und Sumatra. Erst anschließend an diese markante Verbreitungslücke erstreckt sich sein Vorkommen auf die Insel Java, Süd-Sulawesi und die kleinen Sunda-Inseln Bali und Sumbawa.[11]
In Nordost-Indien, Nepal, West-Bhutan, Südwest-Bangladesch und eventuell auch in Nordwest-Burma[10] überschneidet sich die Verbreitung der beiden Unterarten. Sie bewohnen hier benachbarte Lebensräume, an einigen Orten sogar dieselben. In Bangladesch scheint der Dunkle Tigerpython besonders entlang des Brahmaputra vorzukommen. Im vom Hellen Tigerpython dominierten Indien und Nepal sind erst vor Kurzem Populationen des Dunklen Tigerpythons entdeckt worden: In Nepal namentlich im Bardia Nationalpark- [16] und im Chitwan Nationalpark[6], sowie in der Sagarmatha Zone[6]. Letztere geht südlich ins indische Ost-Bihar über. In Indien findet man den Dunklen Tigerpython zudem im Corbett Nationalpark [20] und im Bhitarkanika-Nationalpark[8] und in Süd-Kolkata. Wie groß die dortigen Verbreitungsgebiete der dunklen Unterart sind und ob sie vielleicht teilweise zusammenhängen ist bisher nicht bekannt.[11]
Durch illegale Auswilderungen von Terrarientieren hat sich seit 1979 eine Population des Dunklen Tigerpythons in den Everglades in Florida etabliert.[27]
Lebensraum
Tigerpythons besiedeln ein breites Spektrum von Habitaten, dazu zählen Regenwald[13], Monsunwald[13], Bergwald[16], Nebelwald[17], Galeriewald[19], Mangrovenwald[17], Sumpfland[19], Küstenebenen[28], Grasland, saisonal trockenes Buschland bis hin zu steinigem, sandigem Hügelland.[29] Voraussetzung ist dabei stets Gewässernähe. Die meisten Vorkommen befinden sich unter 200 Meter über Meer. Im Tam Dao Gebirge in Vietnam findet man ihn aber auch auf 1200 Meter und in den wenigen klimatisch milden Rhododendron- und Bambuswäldern Nepals bis gegen 2000 Meter über Meer.[11]
In Teilen Indiens, wo die beiden Unterarten sehr nahe nebeneinander existieren, wird der Helle Tigerpython in trockenen Wäldern und in ariden, sandigen Arealen gefunden, während der Dunkle Tigerpython feuchtes, von Fließgewässern durchzogenes Grasland besiedelt. Im Vergleich zum Netzpython, welcher in Südostasien zum Teil die gleichen Gebiete bewohnt, ist der Anspruch des Dunklen Tigerpythons an direkte Feuchtigkeit der Umgebung wesentlich niedriger.[8] Zudem werden Tigerpythons im Gegensatz zu Netzpythons weitgehend als Kulturflüchter beschrieben.[4] In der Nähe und auf landwirtschaftlichen Nutzflächen macht er aber immer wieder Jagd auf Nagetiere. Auch in Hongkong und Thailand[30] wurde die Art vereinzelt in besiedelter Umgebung gefunden.[10] Ebenso wurden auch in Indien wiederholt Individuen in Wohngebieten und Stadtgärten aufgegriffen.[31] Auf Bali lebt der Tigerpython sogar rund um die Stadt Gilimanuk. Hier besiedelt er Gärten und Hinterhöfe und erbeutet gelegentlich Haushühner.[13]
Lebensweise
 Heller Tigerpython im indischen Keoladeo-Nationalpark vor seiner Höhle
Heller Tigerpython im indischen Keoladeo-Nationalpark vor seiner Höhle
Verhalten
Trotz seines riesigen Verbreitungsgebietes und seiner Häufigkeit in einigen Bereichen des Areals ist über das Verhalten dieses Pythons nur wenig bekannt.[26] Der Tigerpython ist eine vorwiegend bodenbewohnende Schlange, die sich auf dem Untergrund gemächlich und in gerader Linie fortbewegt.[32] Als langsamer, guter Kletterer hält er sich oft auch im Geäst von Büschen und Bäumen auf, um gut getarnt Beute aufzulauern. Die Tiere klettern gelegentlich in erhebliche Höhen[4], in Südindien wurde beispielsweise ein Heller Tigerpython von 1,5 Meter Gesamtlänge in einer Baumkrone in 15 Meter Höhe beim Verspeisen eines Flughundes beobachtet.[33]
In Bereichen mit Seen, Flüssen und sonstigen Gewässern führen Vertreter beider Subspezies ein semi-aquatisches Leben. Im Wasser bewegen sie sich viel schneller und flinker als an Land.[4] Beim Schwimmen ist ihr Körper mit Ausnahme der Schnauzenspitze vollständig ins Wasser eingetaucht.[34] Oft liegen sie auch stundenlang partiell oder ganz untergetaucht am seichten Ufer. Dabei verharren sie bis zu einer halben Stunde komplett unter Wasser ohne Luft zu holen, oder es ragen nur die Nasenlöcher über die Wasseroberfläche hinaus. Im Gegensatz zum ebenfalls wasserliebenden Netzpython[35] scheint der Tigerpython das Meer zu meiden.[4]
Seine bevorzugten Versteck- und Ruheplätze sind Erdhöhlen, Felsspalten, verlassene Säugetierbauten, Termitenhügel, hohle Baumstämme, Mangrovenwurzeldickicht und hohes Gras.[4]
Tigerpythons sind überwiegend dämmerungs- und nachtaktiv.[32] Allerdings hängt die tageszeitliche Aktivität eng mit der Umgebungstemperatur zusammen. In Gebieten mit deutlichen jahreszeitlichen Temperaturunterschieden sucht er in kühlen und heißen Monaten ein Versteck mit angenehmerem, konstanterem Mikroklima auf.[29] Eine Untersuchung Heller Tigerpythons im nordwestindischen Keoladeo-Nationalpark zeigte, dass sie sich bevorzugt bei Temperaturen zwischen 20 und 30 °C bewegen. Im Winter von Mitte Dezember bis Ende Januar verlassen sie ihr Versteck nur während der warmen Mittagszeit, um sich in der Nähe für bis zu 6 Stunden zu sonnen.[26] Die Futtersuche unterbleibt meist. Im Frühling zwischen Februar und März, wo das Mikroklima in den Höhlen eigentlich günstiger ist, sind Tigerpythons sowohl am Tag als auch in der Nacht aktiv. Grund dafür ist die Paarungszeit. Ab April bis in den Sommer hinein zeigen sie Aktivitätsmaxima während Sonnenaufgang und Abenddämmerung. Sie meiden die Mittagshitze und die kühle Nacht. Die zunehmende Wärme im Sommer führt zu einer verstärkt nächtlichen Aktivität. Der günstigere Temperaturdurchschnitt in dieser Jahreszeit senkt die Bindung an feste Verstecke und fördert die Wanderschaft. Bei starker Hitze, besonders in Kombination mit niedriger Luftfeuchtigkeit, sinkt die Aktivität wieder. Kühlende Verstecke gewinnen dann an Bedeutung.[29]
In Nordpakistan[19], Nordindien und Nordburma[36] fallen Tigerpythons über die kühlen Monate in eine Kältestarre, meist von Dezember bis Februar, im südwestlichen Teil der Jammu Provinz[37] sogar noch länger. Dabei verringern sie ihren Stoffwechsel erheblich.[6] An Überwinterungsstellen unter Steinen, Laubhaufen oder in Baum- und Erdhöhlen finden sich manchmal mehrere Individuen zusammen.[4][32]
Auf der Suche nach Beute sind besonders jüngere Tigerpythons aktiv.[17] Dabei liegen zwischen Versteckplatz und Jagdrevier teilweise mehrere Kilometer Distanz.[38] Ein Dunkles Tigerpythonweibchen mit einer Gesamtlänge von 2,7 Meter wurde während 24 Tagen mittels Peilsender überwacht. In dieser Zeitspanne wurde eine Phase mit ausgedehnter Suche nach Futter, eine Periode limitierter Bewegung während der Verdauung und eine Rückkehr zum Beutesuchverhalten registriert. Für all das beanspruchte diese Schlange ein Areal von 12,3 Hektar und legte darin deutlich mehr als 2,5 Kilometer zurück.[28] Sehr große Tigerpythons scheinen sich außerhalb der Paarungszeit eher weniger zu bewegen. Sie lassen sich meist in einem idealen, beutereichen Territorium mit gutem Versteckplatz nieder.[17] Mittels Peilsendern konnte in den Everglades nachgewiesen werden, dass partnersuchende adulte Männchen während der Paarungszeit weite Strecken zurücklegen. Geschlechtsreife Weibchen bleiben im Durchschnitt viel stationärer. Auf der Suche nach einem geeigneten Lebensraum sind adulte Tigerpythons beider Geschlechter befähigt, mit Spitzengeschwindigkeiten von mehr als 2,3 Kilometer pro Tag innerhalb 2,5 Monaten via Wasser- und Landweg Strecken von 60 Kilometer zurückzulegen.[39]
Über das Sozialverhalten der Art gibt es ebenfalls noch erhebliche Wissenslücken. An verschiedenen Orten Indiens teilen sich mehrere Helle Tigerpythons, teilweise über das ganze Jahr hinweg, ihre Versteckplätze. Im Keoladeo-Nationalpark wurden gleichzeitig schon 12 Individuen in einer Erdhöhle gefunden.[40][4]
Im Keoladeo-Nationalpark, wo es an hohlen Bäumen, Felsspalten oder sonstigen Verstecken mangelt, ist der Helle Tigerpython auf schützende Erdhöhlen des Indischen Stachelschweines angewiesen.[26] Erstaunlicherweise bewohnen die Pythons die meisten Höhlen zusammen mit Stachelschweinen, obwohl diese Säugetiere normalerweise zur Beute des Tigerpythons gehören.[41] In einer Erdhöhle wurden neben 3 Pythons 5 indische Stachelschweine und 350 Rundblattnasen-Fledermäuse gezählt.[26] Eine mögliche Erklärung für das verträgliche Zusammenleben könnte an der Enge der Höhlen liegen, welche dem Python das Fangen, Erdrosseln und Verschlingen verunmöglicht.[40]
Nahrung
Das Beutespektrum reicht von Säugetieren und Vögeln bis zu wechselwarmen Echsen und Amphibien: Frösche, Kröten, Warane[19], Fledermäuse[6], Flughunde[6], Hirschferkel, Indische Zibetkatzen[17] und zahlreiche Nagetiere werden gefressen. Auch fängt er Wasser-[32], Stelz- und Hühnervögel. Die Größe des Beutetieres korreliert dabei mit der Größe des Tigerpythons. Von großen Exemplaren ist ausnahmsweise Beute bis zur Größe von kleinen Affen wie junge Hanuman-Languren, Wildschwein-Ferkeln[17], Goldschakalen, Muntjaks, Indischen Gazellen[32], halbwüchsigen Schweinshirschen als auch Pferdehirsch- und Axishirsch-Kitzen belegt. Ein Individuum mit 4,5 Meter Gesamtlänge hat beispielsweise einen Schweinshirsch mit 18 Zentimeter langen Hörnern verschlungen. Allzu große Hörner stellen aber ein Verschlinghindernis dar und bergen die Gefahr innerer Verletzungen. Zu den größten und wehrhaftesten nachgewiesenen Beutetieren gehört auch ein Leopard. Im Magen eines gesamthaft 5,4 Meter langen Tigerpythons wurde ein adultes Exemplar mit einer Kopf-Rumpf-Länge von 1,25 Meter gefunden.[4]
Systematische Untersuchungen zur Zusammensetzung des Beutespektrums wurden bisher offenbar nicht veröffentlicht. Während in der Studie von Bhatt & Choudhury (1993)[29] im Keoladeo-Nationalpark offenbar Vögel die Hauptnahrung waren, nennen Ernst & Zug (1996)[42] von anderen Orten Säugetiere als überwiegende Beute. Wahrscheinlich ist die Ernährungsweise an das Beuterepertoire des jeweiligen Habitats und an jährliche Fluktuationen durch Nagerwanderungen und Vogelzug adaptiert.[43]
Als Lauerjäger passt er seine Beute bevorzugt aus Verstecken, im Geäst oder im Wasser ab. Hat der Tigerpython ein Beutetier erkannt, bewegt er sich langsam darauf zu und wackelt dabei oftmals arttypisch mit dem Schwanz. Blitzschnell wird dann das Opfer gepackt, umschlungen und im für Würgeschlangen typischen Griff erstickt.[4] Wenn nötig, kann der Würgegriff für mehr als eine Stunde aufrechterhalten werden.[44] Je nach Größe des Beutetieres kann das anschließende Verschlingen mehrere Stunden dauern.[45] Während kleine Beute oft schon innerhalb einer Woche verdaut ist, benötigte ein Dunkler Tigerpython mit einer Gesamtlänge von über 5 Meter im Tierpark Berlin für ein 25 Kilogramm schweres Schwein 23 Tage.[46]
Laboruntersuchungen an juvenilen Dunklen Tigerpythons haben ergeben, dass sich der Herzmuskel beim Verdauen eines großen Futtertieres um bis zu 40 % vergrößern kann. Die maximale Vergrößerung der Herzzellen (Hypertrophie) wird durch gesteigerten Einbau kontraktiler Proteine in Muskelfibrillen bereits nach 48 Stunden erreicht. Dieser Effekt trägt zu einem energetisch günstigeren, gesteigerten Herzminutenvolumen bei, wodurch die Verdauung schneller vonstatten gehen kann.[47] Auch der Verdauungstrakt passt sich an die Verdauungsverhältnisse an. So wächst die Dünndarmschleimhaut zwei Tage nach der Fütterung bis auf das Dreifache an. Nach etwa einer Woche schrumpft sie wieder auf ihre Normalgröße zurück.[48] Für den gesamten Verdauungsvorgang werden bis zu 35 % der mit der Beute aufgenommenen Energie benötigt.[49]
Fortpflanzung
Zur Fortpflanzung im Freiland ist ebenfalls sehr wenig bekannt. In Nordindien finden sich Paare in den kühlen Monaten von Dezember bis Februar in einem gemeinsamen Überwinterungsquartier zusammen. Trotz niedriger Temperaturen und verringertem Stoffwechsel gelingt in dieser Zeit die Paarung.[4][32] Entlang des Ganges-Beckens wird Balz und Kopulation ebenfalls während der Überwinterung von Ende Dezember bis Mitte Februar beobachtet.[34] Im nordwestindischen Keoladeo-Nationalpark liegt die Paarungszeit Heller Tigerpythons in der zweiten Hälfte der kühlen Saison, von Mitte Februar bis März. In dieser Periode unterbleibt die Nahrungsaufnahme nahezu vollkommen.[40] Die Paarungsbereitschaft des Weibchens wird dem Männchen durch einen braunen, flüssigen Sexuallockstoff (Pheromon) aus der Kloake signalisiert. Nach einer Verfolgungs- und Annäherungszeit kriecht das Männchen über seine Partnerin, drückt seinen Kopf an sie und beginnt sie mit seinen Afterspornen zu kratzen. Das stimulierte Weibchen hebt seinen Schwanz an.[50] Nun kann das Tigerpython-Männchen einen seiner zweigelappten, abgeflachten Hemipenisse in die Kloake des Weibchens einführen.[1] Die Kopulation dauert in Gefangenschaft zwischen zehn Minuten und sieben Stunden und wird in den kommenden Tagen, zum Teil auch über Monate hinweg, mehrfach wiederholt.[51] Über die Interaktionen zwischen Männchen in der Paarungszeit ist aus der Natur noch nichts bekannt. In Gefangenschaft werden Tigerpython-Männchen in dieser Zeit teilweise territorial und liefern sich mit Nebenbuhlern Kommentkämpfe. Treffen zwei Konkurrenten aufeinander, bezüngeln sie sich anfangs, beginnen sodann nebeneinander herzukriechen, stellen sich mit dem vorderen Drittel auf, steigen aneinander empor und versuchen den Gegner zu Boden zu drücken. Bleibt eine Unterwerfung aus, kommt es zum heftigen Kratzen mit den Afterspornen und schließlich zu heftigen Beißereien.[52]
In Mittelindien dauert die Trächtigkeit 2 bis 4 Monate. In der Mitte der heißen Saison um den Monat Mai sucht sich das Weibchen einen Eiablageplatz. Dieser Platz besteht aus einem ungestörten Versteck unter einem Haufen aus Ästen und Blättern, einem hohlen Baum, einem Termitenhügel oder einer unbewohnten Höhle.[4] Abhängig von Größe und Verfassung des Weibchens werden durchschnittlich 8 bis 30 Eier gelegt.[1] Aus Nordindien ist ein Rekordgelege von 107 Eiern bekannt.[4] Die weichschaligen, weißen Eier messen 74-125 x 50-66 Millimeter und wiegen 140-270 Gramm.[6] Die zusammenklebenden Eier werden vom Weibchen umringt und beschützt. Durch die Schlingenanordnung wird die Feuchtigkeit und Wärme reguliert.[17] Zudem ist das Tigerpython-Weibchen zum Muskelzittern befähigt. Es erhöht mit diesem Effekt die Temperatur um bis zu 7,3 °C.[53] Das erlaubt das Brüten in kälteren Regionen unter Beibehaltung der optimalen Inkubationstemperatur[54] um 30,5 °C. In der Regel nimmt das Weibchen während der Bebrütungszeit keine Nahrung zu sich und verlässt das Nest nicht.[6]
Frische Eierschalen und frisch geschlüpfte Jungtiere werden im indischen Keoladeo-Nationalpark Ende Juli bis Anfangs August gefunden. Danach dauert die Brutzeit etwa 2 Monate.[40] In Südwest-Burma erscheinen Schlüpflinge bereits im Juni, die Fortpflanzungssaison beginnt hier folglich schon früher.[55] Die frisch geschlüpften, von nun an auf sich allein gestellten Jungtiere besitzen im größten Teil des Verbreitungsgebietes eine Gesamtlänge zwischen 40 bis 60 Zentimeter und wiegen 80 bis 150 Gramm.[56] Schlüpflinge der sulawesischen Zwergform weisen jedoch lediglich 30 bis 35 Zentimeter auf.[9] Die Geschlechtsreife erlangen Tigerpythons mit zirka drei Jahren.[1]
Im Artis-Zoo in Amsterdam legte ein Dunkles Tigerpython-Weibchen unter permanenter Abwesenheit von Männchen in fünf aufeinander folgenden Jahren vitale Eier. Eine DNA-Analyse des rein weiblichen Nachwuchses brachte zu Tage, dass dessen Erbgut mit demjenigen der Mutter identisch ist. Die Jungtiere sind folglich nicht durch Befruchtung sondern durch Parthenogenese (Jungfernzeugung) entstanden. Diese ist bei Reptilien selten und bei anderen Riesenschlangenarten bisher unbekannt.[57]
Alter und Lebenserwartung
Angaben zum Durchschnitts- und Maximalalter freilebender Individuen sind unbekannt. Es wird jedoch angenommen, dass Tigerpythons in der Natur unter günstigen Bedingungen mehr als 30 Jahre alt werden.[34] In Gefangenschaft wird ein Durchschnittsalter von 25 Jahren erreicht. Der Rekord liegt bei 34 Jahren.[58]
Natürliche Feinde
Abgesehen vom Menschen hat der Tigerpython besonders in seiner Jugend viele Feinde. Dazu gehören beispielsweise Königskobras[4], Indische Mungos, Raubkatzen wie Tiger[4] und Leoparden[16], Bären, verschiedene Eulen sowie einige Greifvögel wie der Schwarzmilan.[6] Zu den Nesträubern zählt unter anderem der Bengalenwaran (Varanus bengalensis).[38]
Gefährdung und Populationsstatus
 Tigerpython- und Netzpythonhäute (letztere jeweils ganz rechts) bei einem Lederwarenhändler in Mandalay, Burma
Tigerpython- und Netzpythonhäute (letztere jeweils ganz rechts) bei einem Lederwarenhändler in Mandalay, Burma
Die kommerzielle Ausbeutung des Tigerpythons für die Lederindustrie hat in zahlreichen Ländern seines Verbreitungsgebietes einen signifikanten Populationsrückgang bewirkt. In Indien und Bangladesch war der Tigerpython um 1900 noch häufig und weit verbreitet. Es folgte eine exzessive Bejagung über mehr als ein halbes Jahrhundert, wobei aus Indien jährlich bis 15.000 Häute nach Japan, Europa und in die USA exportiert wurden. In den meisten Gebieten führte das zum massiven Rückgang der Population und an zahlreichen Orten sogar zur kompletten Ausrottung. 1977 wurde der Export in Indien gesetzlich verboten.[10] Der illegale Handel hält aber bis heute an. Gegenwärtig ist der Tigerpython in Indien außerhalb von Schutzgebieten nur noch selten zu finden.[34] In Bangladesch ist er auf wenige Gebiete im Südosten beschränkt.[10]
In Thailand, Laos, Kambodscha und Vietnam war der Tigerpython in den 1970er Jahren noch weit verbreitet und relativ häufig. Die Nutzung der Art für die Lederindustrie wuchs aber in den folgenden Jahren massiv an und erreichte 1985 einen Spitzenwert von 189.068 offiziell aus diesen Ländern exportierten Häuten. Der internationale Handel mit lebendigen Tigerpythons erlangte in diesem Jahr ebenfalls seinen Höhepunkt mit 25.000 Tieren. Noch 1985 wurde in Thailand zum Schutz der Tigerpythons eine Handelsbeschränkung erlassen, wodurch jährlich nur noch 20.000 Häute exportiert werden dürfen. Daneben entstand ein beträchtlicher illegaler Handel. 1990 waren Tigerpythonhäute aus Thailand im Durchschnitt nur noch 2 Meter lang, ein eindeutiges Zeichen, dass die Anzahl fortpflanzungsfähiger Tiere massiv dezimiert sein muss.[10] Bis 2003 sollen Tigerpythons in einigen Teilen Thailands dennoch wieder häufiger geworden sein.[30] In Laos, Kambodscha und Vietnam ist die Lederindustrie heute immer noch bedeutend und wesentlich am fortlaufenden Populationsrückgang beteiligt.[59][60][61]
Der Handel mit Tigerpythonhäuten und deren Gallenblasen blühte auch in Indonesien über Jahrzehnte. Das führte zu einer bedrohlichen Verringerung der Bestände der dort ohnehin schon seltenen Schlange. 1978 handelte die Regierung und stellte den Tigerpython unter Schutz. Seither wurden praktisch keine Exportbewilligungen mehr erteilt.[10]
Bestimmte Volksstämme in Indien, Sri Lanka, Nord-Thailand, Laos und Kambodscha als auch Burmesen, Karen, Chinesen und kleine ethnische Gruppen in Indonesien jagen den Tigerpython des Fleisches wegen. In China gelten überdies die Eier als Delikatesse, die Leber und das Herz als Stimulanz, die Gallenblase dient medizinischen Zwecken und die Haut als Rohmaterial für Musikinstrumente und Kunsthandwerk. In Indien und auf Sri Lanka wird das Fett äußerlich zur Linderung von Prellungen, Verstauchungen, Brüchen, Rheuma und innerlich gegen Aussatz angewendet. Insbesondere für die bereits seit mehr als einem Jahrhundert stark geschrumpfte Tigerpythonpopulation in China ist das fortlaufende Konsumieren eine ernsthafte Bedrohung. Auch in Burma, wo der Tigerpython 1912 noch als „in Massen vorkommend“ beschrieben wurde, hat die intensive Nutzung als Nahrungsquelle eine sichtbare Dezimierung bewirkt.[10]
Ausgedehntes Kahlschlagen von Wäldern, Waldbrände und Bodenerosionen sind in Tigerpythonhabitaten ein zunehmendes Problem.[16] Auch die zunehmende Zersiedelung und Landwirtschaftsausdehnung einer ständig wachsenden Bevölkerung schränkt seinen Lebensraum immer mehr ein.[12][62] Das alles führt zur Schrumpfung, Isolierung und letztendlich zur Ausrottung einzelner Populationen.[16] Habitatverluste sind in Pakistan, Nepal und Sri Lanka hauptverantwortlich für den Rückgang des Tigerpythons, einen bedeutenden Handel gab es in diesen Ländern nie. Deswegen musste diese Schlange in Pakistan 1990 für bedroht erklärt werden. In Nepal gilt der Tigerpython als gefährdet und ist nur noch im Chitwan-Nationalpark häufig.[10] Auf Sri Lanka beschränkt sich sein Lebensraum zunehmend auf den unberührten Dschungel.[10][62]
Als unmittelbar bedroht wird der Helle Tigerpython im Anhang I des Washingtoner Artenschutz-Übereinkommens geführt und darf nicht gehandelt werden. Wilde Populationen des Dunklen Tigerpythons gelten als schutzbedürftig, werden im Anhang II gelistet und unterliegen Ausfuhrbeschränkungen.[63] Der Tigerpython wird von der IUCN heute als Art der Vorwarnliste ("near threatened") geführt.
Tigerpythons als Neozoon
In den Everglades im US-amerikanischen Bundesstaat Florida wurden Dunkle Tigerpythons illegal ausgewildert und konnten sich dort seit 1979 auch etablieren. Insbesondere ab dem Jahr 2001 war dort eine erhebliche Zunahme zu verzeichnen, im Jahr 2007 wurde der Bestand bereits auf etwa 30.500 Tiere geschätzt.[27] Die Tiere werden als Bedrohung für die heimische Fauna betrachtet, z. B. für Rotluchse, Beutelratten, Bindentaucher, Schneesichler und Rallenkraniche. Kleine bis mittelgroße Mississippi-Alligatoren gehören dort ebenfalls zum Beutespektrum. So wurde in einem verendeten 3,86 Meter langen Tigerpython ein 2,10 Meter langer Alligator gefunden.[43] Andererseits werden kleinere Tigerpythons auch von Alligatoren gefressen.[27]
Tigerpython und Mensch
Verhalten gegenüber Menschen
Wildlebende Tigerpythons sind normalerweise wenig aggressiv. Werden sie gestört, zischen sie warnend oder kriechen weg und versuchen sich zu verstecken. Erst bei massiver Beunruhigung verteidigen sie sich durch kräftige, schmerzhafte Abwehrbisse.[1][19] Nur wenige Tiere sind schnell reizbar und gehen von Anfang an zur Abwehr über. Das gilt insbesondere für einzelne Individuen von Sri Lanka und Sulawesi.[1][12] In der Wildnis lebenden Tigerpythons wurde wiederholt nachgesagt, Menschen getötet zu haben. Hauptsächlich unbeaufsichtigte Babys und kleine Kinder sollen im Verbreitungsgebiet Opfer geworden sein. Es gibt jedoch keine seriösen Belege dafür.[1][4] Gesicherte Todesfälle sind aus den USA bekannt, wo mitunter erwachsene Personen durch als Heimtier gehaltene Tigerpythons erstickt wurden. Die Ursache dafür war stets fahrlässiger Umgang, der in den Pythons den Jagdinstinkt auslösen konnte.[27][64]
Kulturelles
Bereits in frühen indischen Kulturen nutzten Priesterinnen das ruhige Naturell des Hellen Tigerpythons für den Schlangentanz. Diese Tiere wurden jung gefangen und in Tempeln in stabilen Körben aufgezogen. Durch ständigen Kontakt mit dem Menschen legten sie meist jegliche Bissigkeit ab.[65] Auch die später aufgekommenen zahlreichen ehemaligen indischen Fürstenstaaten hielten an ihren Höfen Tigerpythons als Beschützer der Herrscherfamilie. Im späten 19. und frühen 20. Jahrhundert behängten sich Schlangenbeschwörer und Fakire Indiens ebenfalls gerne mit Tigerpythons.[8] Im heutigen Indien ist Schlangenbeschwören sowie Besitz oder Töten dieses vom Aussterben bedrohten Pythons verboten. Die Strafe beläuft sich auf eine Buße und bis zu 6 Jahre Gefängnis.[20]
Seit Jahrhunderten wird in zahlreichen Ländern Südostasiens Tigerpythonfleisch gegessen. Zusätzlich sind besonders in der traditionellen chinesischen Medizin Tigerpythoninnereien sehr bedeutend. Auch die Lederindustrie ist in manchen südostasiatischen Ländern ein nicht zu unterschätzender Wirtschaftszweig, der professionelle Jäger, Gerber und Händler beschäftigt. Auch Bauern, die auf ihren Feldern per Zufall einen Tigerpython aufgreifen erhalten so ein Zusatzeinkommen.[10] Daneben haben sich über die letzten 20 Jahre in zahlreichen asiatischen Ländern, besonders in Südostasien, Tigerpython- und Netzpython-Farmen etabliert. Neben der Hauptnutzung für die Lederindustrie wird auch das Fleisch als Delikatesse verkauft. Besonders Tigerpythonfleisch aus Vietnam wird derzeit in die Europäische Union importiert.[66]
Mehrheitlich wird der Tigerpython von den Menschen in Südostasien nicht gefürchtet und als Mitgeschöpf behandelt. Mancherorts sind diese Schlangen sogar gern gesehen. Den Bauern wird zunehmend bewusst, dass Tigerpythons durch das Vertilgen von Nagetieren auf landwirtschaftlichen Anbauflächen eine bedeutende Funktion erfüllen.[10]
 Amelanotische Form des Dunklen Tigerpythons
Amelanotische Form des Dunklen Tigerpythons
In Europa sind Tigerpythons schon lange populäre Tiere. Seit im Tower of London 1245 eine königliche Kollektion von wilden und gefährlichen Tieren eröffnete, wurden hier immer wieder Tigerpythons aus Indien und Sri Lanka ausgestellt. 1829 gelang hier bereits beinahe die Nachzucht. Im Jardin des Plantes in Paris konnte 1842 anhand eines brütenden Dunklen Tigerpythonweibchens erstmals das Muskelzittern und die daraus resultierende Temperaturerhöhung studiert werden.[67] Im späten 19. Jahrhunderts durften diese imposanten Exoten in Menagerien zahlreicher Schlösser und Parkanlagen nicht fehlen. Lange Zeit dienten diese Pythons auch in Schlangenvorführungen im Zirkus und Varieté als Attraktion.[56]
Gegenwärtig erfreut sich der Tigerpython bei privaten Haltern in Europa und den USA großer Beliebtheit. Trotz seiner Größe wird insbesondere der Dunkle Tigerpython dank seiner ansprechenden Zeichnung und seines eher ruhigen Temperaments in Gefangenschaft rege gehalten und vermehrt. Es wurden zahlreiche Farbmutationen des Dunklen Tigerpythons gezüchtet.[56] Auch Hybride zwischen Hellem Tigerpython und Dunklem Tigerpython[56], Tigerpython und Netzpython[56], Tigerpython und Königspython sowie Tigerpython und Felsenpython[56] sind aus Verpaarung in Gefangenschaft bekannt.
Gesetzliche Haltungsvoraussetzungen
Der Helle Tigerpython ist im Anhang A der Europäischen Artenschutzverordnung geführt und darf ohne Genehmigung nicht gehalten werden. Damit Tigerpythons als potenziell gefährliche Wildtiere artgerecht und sachkundig gepflegt werden und keine Gefahr für die Öffentlichkeit darstellen, haben viele Länder zudem gesetzliche Haltungsvoraussetzungen geschaffen.
In der Schweiz gelten laut Tierschutzverordnung von 2008 Mindestanforderungen für die Haltung von Tigerpythons. Das kantonale Veterinäramt stellt Haltebewilligungen aus und führt periodische Kontrollen bei Haltern durch.[68]
In Deutschland gilt in acht Bundesländern ein Gefahrenabwehrrecht für sehr groß werdende Riesenschlangen. Die Haltung vom Tigerpythons ist dort genehmigungspflichtig.[56]
In Österreich unterliegt die Tigerpythonhaltung gemäß Tierschutzgesetz von 2004 (§25)[69] einer Meldepflicht und der 2. Tierhaltungsverordnung von 2004[70] Mindestanforderungen. Darüber hinaus herrschen bundeslandspezifische sicherheitspolizeiliche Regelungen. So ist die private Haltung des Dunklen Tigerpythons oder beider Unterarten in gewissen Bundesländern verboten. In anderen gelten teilweise Bewilligungspflichten und stichprobenartige bis periodische Kontrollen.[71]
Quellen
Einzelnachweise
- ↑ a b c d e f g h i j k J. G. Walls: The Living Pythons - A complete guide to the Pythons of the World. T. F. H. Publications 1998, ISBN 0-7938-0467-1, S. 131-142.
- ↑ a b c S. M. Campden-Main: A field guide to the snakes of South Vietnam. City of Washington 1970, S. 8-9.
- ↑ R. Bauchot (Hrsg.): Schlangen - Evolution, Anatomie, Physiologie, Ökologie und Verbreitung, Verhalten, Bedrohung, Gefährdung, Haltung und Pflege. Bechtermünz Verlag 1994, ISBN 3-8289-1501-9, S. 55, 181.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w F. Wall: A popular treatise on the common Indian snakes – The Indian Python. Journal of the Bombay Natural History Society Band 21, 1912, S. 447–476; online ab S. 419.
- ↑ L. Singh, T. Sharma, S.P. Ray-Chaudhuri: Chromosomes and the classification of the snakes of the family Boidae. Cytogenetics Band 7, 1968, S. 161-168. Zit. in: H. Schleich, W. Kästle: Amphibians and Reptiles of Nepal - Biology, Systematics, Filed Guide. A. R. G. Gantner Verlag K. G. 2002, ISBN 978-3-904144-79-7, S. 795.
- ↑ a b c d e f g h i j k l H. Schleich, W. Kästle: Amphibians and Reptiles of Nepal-Biology, Systematics, Field Guide. A.R.G. Gantner Verlag K.G. 2002, ISBN 978-3-904144-79-7, S. 795-802.
- ↑ L. H. Rawlings, D. L. Rabosky, S. C. Donnellan, M. N. Hutchinson: Python phylogenetics: inference from morphology and mitochondrial DNA. Biological Journal of the Linnean Society Band 93, 2008, S. 603–619; online, pdf.
- ↑ a b c d e M. O’Shea: Boas and Pythons of the World. New Holland Publishers 2007, ISBN 978-1-84537-544-7, S. 80-87.
- ↑ a b c d e f H. J. Jacobs, M. Auliya, W. Böhme: Zur Taxonomie des Dunklen Tigerpythons, Python molurus bivittatus KUHL, 1820, speziell der Pupulation von Sulawesi – On the Taxonomy of the Burmese Python, Python molurus bivittatus KUHL, 1820, specifically on the Sulawesi Population. SAURIA Band 31, Heft 3, Berlin 2009, S. 5-16, online, pdf.
- ↑ a b c d e f g h i j k l B. Groombridge, L. Luxmoore: "Pythons in South-East Asia - A review of distribution, status and trade in three selected species". Secretariat of CITES, Lausanne, Switzerland 1991, ISBN 2-88323-003-X.
- ↑ a b c d e f D. G. Barker, T. M. Barker: The Distribution of the Burmese Python, Python molurus bivittatus. (Zusammenstellung aus diversen Publikationen sowie Stellungnahmen von Experten), Bulletin of the Chicago Herpetological Society Band 43, Heft 3, 2008, S. 33-38; online, pdf.
- ↑ a b c R. de Lang, G. Vogel: The snakes of Sulawesi: A field guide to the land snakes of Sulawesi with identification keys. Frankfurt Contributions to Natural History Band 25, Edition Chimaira 2005, ISBN 3-930612-85-2, S. 23-27, 198-201.
- ↑ a b c d e J. L. McKay: A field guide to the amphibians and reptiles of Bali. Krieger Publishing Company 2006, ISBN 1-57524-190-0, S. 13, 14, 18, 86.
- ↑ a b c d P. E. P. Deraniyagala: Some New Races of the Python, Chrysopelea, Binocellate Cobra and Tith-Polonga inhabiting Ceylon and India. Spolia Zeylanica Band 24, Heft 2, 1945, S. 103-112.
- ↑ J.D. Constable: Reptiles from the Indian peninsula in the Museum of Comparative Zoology. Bulletin of the Museum of Comparative Zoology Band 103, Heft 2, 1949; Volltext, online.
- ↑ a b c d e f g h M. O’Shea: Herpetological results of two short field excursions to the Royal Bardia region of western Nepal, including range extensions for Assamese/Indo-Chinese snake taxa. In: A. de Silva (Hrsg.): Biology and conservation of the amphibians,reptiles, and their habitats in South Asia (Proceedings of the International Conference on Biology and Conservation of Amphibians and Reptiles in South Asia, Sri Lanka, August 1-5) October 1996. Amphibia and Reptile Research Organization of Sri Lanka (ARROS) 1998, ISBN 955-8213-00-4, S. 306-317.
- ↑ a b c d e f g h i R. Whitaker: Common Indian Snakes – A Field Guide. The Macmillan Company of India Limited 1987, ISBN 0-333-90198-3, S. 6-9.
- ↑ a b S. Bhupathy: Blotch structure in individual identification of the Indian Python (Python molurus molurus) and its possible usage in population estimation. Journal of the Bombay Natural History Society Band 87, Heft 3, 1990, S. 399-404.
- ↑ a b c d e f g h i S. A. Minton: A contribution to the herpetology of West Pakistan. Bulletin of the American Museum of Natural History Band 134, Heft 2, 1966, S. 117-118; Volltext, pdf.
- ↑ a b c d e R. Whitaker, A. Captain: Snakes of India, The field guide. Chennai, India: Draco Books 2004, ISBN 81-901873-0-9, S. 3, 12, 78-81.
- ↑ a b c J. Deuve: Serpents du Laos. Mémoire O.R.S.T.O.M. Nr. 39, Paris 1970, S. 61-62, 65-66.
- ↑ a b c H. Saint Girons: Les serpents du Cambodge. Mémoires du Muséum national d'Histoire naturelle, Série A 1972, S. 40-41.
- ↑ M. A. Smith: Reptilia and Amphibia, Vol. III, Serpentes. In: The Fauna of British India, Ceylon and Burma, including the whole of the Indo-Chinese Sub-Region. Tailor and Frances, Ltd., London 1943, S. 102-109
- ↑ W. Elliot: On the Habits of the Indian Rock-snake (Python molurus). Report of the fortieth meeting of the British Association for the advancement of Science 1870, London 1871, S. 115; Volltext, online.
- ↑ H. Bellosa, L. Dirksen, M. Auliya: Faszination Riesenschlangen - Mythos, Fakten und Geschichten. BLV Buchverlag GmbH & Co. 2007, ISBN 978-3-8354-0282-9, S. 74-79.
- ↑ a b c d e S. Bhupathy , C. Ramesh: Ecology of the endangered Indian Rock Python (Python molurus) in Keoladeo National Park, Bharatpur, Rajasthan, India. Annual Report of the Salim Ali Centre for Ornitology and Natural History 2007-2008; Volltext, pdf.
- ↑ a b c d R. W. Snow, K. L. Krysko, K. M. Enge, L. Oberhofer, A. Warren-Bradley, L. Wilkins: Introduced populations of Boa constrictor (Boidae) and Python molurus bivitattus (Pythonidae) in southern Florida. In R. W. Henderson, R. Powell: The Biology of Boas and Pythons. Eagle Mountain 2007, ISBN 0-9630537-0-1, S. 416–438.
- ↑ a b N. C. Goodyear: Python molorus bivittatus (Burmese python). Movements. Herpetological Review Band 25, Heft 2, 1994, S. 71-72.
- ↑ a b c d K. Bhatt, B.C. Choudhury: The diel activity pattern of Indian Python (Python molurus molurus Linn.) at Keoladeo National Park, Bharatpur, Rajasthan. Journal of the Bombay Natural History Society Band 90, Heft 3, 1993, S. 394-403.
- ↑ a b O. S. G. Pauwels, P. David, C. Chimsunchart, K. Thirkakhupt: Reptiles of Phetchaburi Province, Western Thailand: a list of species, with natural history notes, and a discussion on the biogeography at the Isthmus of Kra. The Natural History Journal of Chulalongkorn University Band 3, Heft 1, 2003, S 23-53; online, pdf.
- ↑ R. Nande, S. Deshmukh: Snakes of Amravati district including Melghat, Maharashtra, with important records of the Indian egg-eater, montane trinket snake and Indian smooth snake. Zoos’ Print Journal Band 22, Heft 12, 2007, S. 2920-2924; online, pdf.
- ↑ a b c d e f J. C. Daniel: The Book of Indian Reptiles and Amphibians. Bombay Natural History Society and Oxford University Press, Delhi 2002, ISBN 0-19-566099-4, S. 83-87.
- ↑ J. Foster, P. Price: A case of predation by Python molurus on a fruit bat, Pteropus giganteus, with notes on bat-snake interactions. Hamadryad Band 22, Heft 1, 1997, S. 58–61. Zit. in: H. Schleich, W. Kästle: Amphibians and Reptiles of Nepal - Biology, Systematics, Field Guide. A. R .G. Gantner Verlag K. G. 2002, ISBN 978-3-904144-79-7, S. 799.
- ↑ a b c d R. C. Sharma: Fauna of India and the adjacent countries - Reptilia, Volume III (Serpentes). Kolkata 2007, ISBN 978-81-8171-155-7, S. 91-93.
- ↑ P. A. Rawlinson, R. A. Zann, S. van Balen, I. W. B. Thornton: Colonization of the Krakatau islands by vertebrates. GeoJournal Band 28, Heft 2, 1992, DOI 10.1007/BF00177236, S. 225–231.
- ↑ F. Wall: Ophidia Taprobanica, or the snakes of Ceylon. Colombo: H. R. Cottle, Government Printer, Ceylon 1921, S. 48-77. Zit. in: C. H. Pope: The Reptiles of China: turtles, crocodilians, snakes, lizards. American Museum of Natural History, New York 1935, S. 72-75.
- ↑ B. D. Sharma, T. Sharma: Notes on the ecology of the Indian Python, Python molurus molurus, LINN., in the Jamur region, India. British Herpetological Society 1977, Newsletter 16, S. 30 -33. Zit. in: H. Schleich, W. Kästle: Amphibians and Reptiles of Nepal - Biology, Systematics, Field Guide. A. R. G. Gantner Verlag K. G. 2002, ISBN 978-3-904144-79-7, S. 797.
- ↑ a b W. Auffenberg: The Bengal monitor. Gainesville, University Press of Florida 1994, S. 210, 314, 405, 478.
- ↑ R. G. Harvey, M. L. Brien, M. S. Cherkiss, M. Dorcas, M. Rochford, R. W. Snow, F. J. Mazzotti: Burmese Pythons in South Florida - Scientific Support for Invasive Species Management. University of Florida, April 2008, IFAS Publication Number WEC-242; online, pdf.
- ↑ a b c d S. Bhupathy, V.S. Vijayan: Status, distribution and general ecology of the Indian Python (Python molurus molurus Linn.) in Keoladeo National Park, Bharatpur, Rajasthan. Journal of the Bombay Natural History Society Band 86, Heft 3, 1989, S. 381-387.
- ↑ S. Bhupathy, M.N. Haque: Association of Indian Rock Python (Python molurus) with Porcupine (Hystrix indica). Journal of the Bombay Natural History Society Band 83, Heft 2, 1986, S. 449-450.
- ↑ C. H. Ernst, G. R. Zug: Snakes in Question. Washington DC. and London: Smithsonian Institution Press 1996, S. 91-169. Zit. in: R. W. Snow, M. Brien, M. S. Cherkiss, L. Wilkins, F. J. Mazzotti: Dietary habits of the Burmese python, Python molurus bivittatus, in Everglades National Park, Florida. British Herpetological Society: Herpetological Bulletin Nr. 101, Autumn 2007, ISSN 1473-0928, S 6.
- ↑ a b R. W. Snow, M. Brien, M. S. Cherkiss, L. Wilkins, F. J. Mazzotti: "Dietary habits of the Burmese python, Python molurus bivittatus, in Everglades National Park, Florida." Herpetological Bulletin Band 101, 2007, ISSN 1473-0928, S. 5-7.
- ↑ O. P. Dubey: A Coucal – Python Incident. Journal of the Bombay Natural History Society Band 81, 1985, S. 711.
- ↑ C. H. Pope: The giant snakes : the natural history of the boa constrictor, the anaconda, and the largest pythons, including comparative facts about other snakes and basic information on reptiles in general. Routledge and Kegan, London 1962, S. 93, 140-147.
- ↑ H.-G. Petzold: Ungewöhnliche Fressleistung eines Dunklen Pythons (Python molurus bivittatus). Der Zoologische Garten - Zeitschrift für die gesamte Tiergärtnerei Band 28, Akademische Verlagsgesellschaft Leipzig 1963/1964, S. 200-202.
- ↑ J. B. Andersen, B. C. Rourke, V. J. Caiozzo, A. F. Bennett, J. W. Hicks: Physiology: postprandial cardiac hypertrophy in pythons. Nature Band 434, 2005, S. 37-38.
- ↑ J.M. Starck, K. Beese: Structural flexibility of the intestine of Burmese python in response to feeding. Journal of Experimental Biology Band 204, Heft 2, 2001, S. 325-335.
- ↑ J. Overgaard: The Effects of Fasting Duration on the Metabolic Response to Feeding in Python molurus: An Evaluation of the Energetic Costs Associated with Gastrointestinal Growth and Upregulation. Physiological and Biochemical Zoology Band 75, Heft 4, 2002, S. 360–368.
- ↑ T. Walsh, J. B. Murphy: Observations on the husbandry, breeding and behaviour of the Indian python. International Zoo Yearbook Band 38, 2003, S. 145-152.
- ↑ R. Vyas: Breeding data on captive Indian Rock Python (Python molurus molurus). Zoos’ Print Journal Band 17, Heft 4, 2002, S. 752-756; online, pdf.
- ↑ D. G. Barker, J. B. Murphy, K. W. Smith: Social Behavior in a Captive Group of Indian Pythons, Python molurus (Serpentes, Boidae) with Formation of a Linear Social Hierarchy. Copeia Band 3, 1979, S. 466-471.
- ↑ V. H. Hutchison, H. G. Dowling, A. Vinegar: Thermoregulation in a Brooding Female Indian Python, Python molurus bivittatus. Science, New Series Band 151, Heft 3711, 1966, S. 694-696; online, pdf.
- ↑ A. Vinegar: Evolutionary Implications of Temperature Induced Anomalies of Development in Snake Embryos. Herpetologica Band 30, Heft 1, 1974, S. 72-74.
- ↑ F. Wall: Snakes collected in Burma in 1925. Journal of the Bombay Natural History Society 1926, S. 558-566.
- ↑ a b c d e f g H. Bellosa: Python Molurus - der Tigerpython. Terrarien-Bibliothek Natur und Tier-Verlag 2007, ISBN 978-3-937285-49-8, S. 4-40, 81-91, 106-107.
- ↑ T. V. M. Groot, E. Bruins, J. A. J. Breeuwer: Molecular genetic evidence for parthenogenesis in the Burmese python, Python molurus bivittatus. Heredity Band 90, 2003, S. 130–135.
- ↑ F. L. K Lim, M. T.-M. Lee: Fascinating Snakes of Southeast Asia - An Introduction. Tropical Press, Kuala Lumpur 1989. Zit. in: R. de Lang, G. Vogel: The snakes of Sulawesi: A field guide to the land snakes of Sulawesi with identification keys. Frankfurt Contributions to Natural History Band 25. Frankfurt am Main: Edition Chimaira 2005, ISBN 3-930612-85-2, S. 200.
- ↑ WCS Lao program: Biodiversity Profile for Luang Namtha Province. Biodiversity Country Report 2003, S. 57; online, pdf.
- ↑ B. L. Stuart: The Harvest and Trade of Reptiles at U Minh Thuong National Park, southern Viet Nam. Traffic Bulletin Band 20, Heft 1, 2004, S. 25-34; online, pdf.
- ↑ N. Q. Truong, R. Bain: An Assessment of the Herpetofauna of the Green Corridor Forest Landscape, Thua Thien Hue Province, Vietnam. Technical Report Band 2, 2006, S. 24, 25, 28; Volltext, pdf.
- ↑ a b S. Todd: The Sri Lankan Python (Python molurus molurus): Spotlight on a Crisis. The Herptile Band 9, Heft 3, 1984, S. 77-85.
- ↑ CITES - Convention on International Trade in Endangered Species of Wild Fauna and Flora: Appendices I, II and II, valid from 1 July 2008; online.
- ↑ D. Chiszar, H. M. Smith, A. Petkus, J. Dougherty: A fatal attack on a teenage boy by a captive Burmese Python (Python molurus bivittatus) in Colorado. Bulletin of the Chicago Herpetological Society Band 28, 1993, S. 261-262; Inhalt teilweise wiedergegeben in [1].
- ↑ W.-E. Engelmann, F. J. Obst: Mit gespaltener Zunge - Biologie und Kulturgeschichte der Schlange. Verlag Herder 1981, ISBN 3-451-19393-0, S. 123, 169.
- ↑ European Food Safety Authority: Scientific Opinion of the Panel on Biological Hazards on a request from the European Commission on public health risks involved in the human consumption of reptile meat. The EFSA Journal Band 578, 2007, S. 12; Zusammenfassung als pdf.
- ↑ J. B. Murphy: Wild and Ferocious Reptiles in the Tower of London. Herpetological Review Band 37, Heft 1, 2006, S. 10–13; online, pdf.
- ↑ Schweizer Tierschutzverordnung vom 23. April 2008; online, pdf.
- ↑ Österreich: Tierschutzgesetz BGBl I Nr. 118/2004 idgF (§ 25) online.
- ↑ Österreich: Tierhaltungsverordnung BGBl. II Nr. 486/2004 idgF: Mindestanforderungen an die Haltung von Reptilien (siehe 2.2.54); online, pdf.
- ↑ Österreich: bundeslandspezifische Bestimmungen der Tigerpythonhaltung:
- Vorarlberg: Gesetz über Maßnahmen gegen Lärmstörungen und über das Halten von Tieren LGBl.Nr. 1/1987, 57/1994 (§ 2 Abs 2 und 3) online, pdf, Bewilligungspflicht;
- Niederösterreich: §7a NÖ Tierschutzgesetz LGBl.4610-3 online, pdf, stichprobenartige Überprüfung, Verordnung über Wildtierarten, deren Haltung beschränkt ist - Landesgesetzblatt 4610/3-0 (§1) online, pdf, bei den Boiden spp. nur Python reticulatus, Python sebae und Eunectes murinus für Private verboten;
- Kärnten: Verordnung, mit der jene Tiere bestimmt werden, die wegen der von ihnen ausgehenden Gefahr für die körperliche Sicherheit von Menschen als gefährlich einzustufen sind LGBl Nr 21/1991, Verbot über 3 Meter lang werdender Riesenschlangen für Private;
- Oberösterreich: § 6 des O.Ö. Polizeistrafgesetzes - Halten gefährlicher Tiere online, pdf, Haltung erlaubt, Bezirksverwaltungsbehörde kontrolliert jährlich;
- Salzburg: Haltung erlaubt, Kontrollen stichprobenartig, Meldeformular online, pdf, Landessicherheitsgesetz § 2d online, pdf, Gemeinden sind zur Erlassung eines örtlichen Tierhalteverbotes ermächtigt;
- Wien: 1. Wiener Tierschutz- und Tierhalteverordnung LGBl. 22/1997 (§ 3) online, pdf, Haltung von Python m. bivitattus für Private verboten, alle Reptilienhaltungen werden überprüft.
Literatur
- F. Wall: A popular treatise on the common Indian snakes - The Indian Python. Journal of the Bombay Natural History Society Band 21, 1912, S. 447–476; (online ab S. 419).
- S. Bhupathy, V.S. Vijayan: Status, distribution and general ecology of the Indian Python (Python molurus molurus Linn.) in Keoladeo National Park, Bharatpur, Rajasthan. Journal of the Bombay Natural History Society Band 86, Heft 3, 1989, S. 381-387.
- K. Bhatt, B.C. Choudhury: The diel activity pattern of Indian Python (Python molurus molurus Linn.) at Keoladeo National Park, Bharatpur, Rajasthan. Journal of the Bombay Natural History Society Band 90, Heft 3, 1993, S. 394-403.
- B. Groombridge, L. Luxmoore: Pythons in South-East Asia - A review of distribution, status and trade in three selected species. Lausanne, Switzerland: Secretariat of CITES 1991, ISBN 2-88323-003-X.
- D. G. Barker, T. M. Barker: The Distribution of the Burmese Python, Python molurus bivittatus. Bulletin of the Chicago Herpetological Society Band 43, Heft 3, 2008, S. 33-38; (online, pdf).
- H. Schleich, W. Kästle: Amphibians and Reptiles of Nepal - Biology, Systematics, Field Guide. A.R.G. Gantner Verlag K.G. 2002, ISBN 978-3-904144-79-7, S. 795-802.
- R. Whitaker: Common Indian Snakes – A Field Guide. The Macmillan Company of India Limited 1987, ISBN 0-333-90198-3, S. 6-9.
- J. C. Daniel: The Book of Indian Reptiles and Amphibians. Bombay Natural History Society and Oxford University Press, Delhi 2002, ISBN 0-19-566099-4, S. 83-87.
- R. C. Sharma: Fauna of India and the adjacent countries - Reptilia, Volume III (Serpentes). Kolkata 2007, ISBN 978-81-8171-155-7, S. 91-93.
- J. Deuve: Serpents du Laos. Mémoire O.R.S.T.O.M. Band 39, Paris 1970, S. 61-62, 65-66.
- H. Saint Girons: Les serpents du Cambodge. Mémoires du Muséum national d'Histoire naturelle, Série A, 1972, S. 40-41.
- S. M. Campden-Main: A field guide to the snakes of South Vietnam. City of Washington 1970, S. 8-9.
- S. A. Minton: A contribution to the herpetology of West Pakistan. Bulletin of the American Museum of Natural History Band 134, Heft 2, 1966, S. 117, 118; (Volltext, pdf).
- R. de Lang, G. Vogel: The snakes of Sulawesi: A field guide to the land snakes of Sulawesi with identification keys. Frankfurt Contributions to Natural History Volume 25. Frankfurt am Main: Edition Chimaira, 2005, ISBN 3-930612-85-2, S. 23-27, 198-201.
- R. W. Snow, K. L. Krysko, K. M. Enge, L. Oberhofer, A. Warren-Bradley, L. Wilkins: Introduced populations of Boa constrictor (Boidae) and Python molurus bivitattus (Pythonidae) in southern Florida. In: R. W. Henderson, R. Powell: The Biology of Boas and Pythons. Eagle Mountain 2007, ISBN 0-9630537-0-1, S. 416–438.
Weblinks
 Commons: Tigerpython – Album mit Bildern und/oder Videos und Audiodateien
Commons: Tigerpython – Album mit Bildern und/oder Videos und Audiodateien Wiktionary: Tigerpython – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: Tigerpython – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen- Python molurus in der Roten Liste gefährdeter Arten der IUCN 2008. Eingestellt von: World Conservation Monitoring Centre, 1996. Abgerufen am 14. September 2009
- Python molurus in The Reptile Database

Dieser Artikel wurde am 3. Oktober 2009 in dieser Version in die Liste der exzellenten Artikel aufgenommen. Kategorien:- Wikipedia:Exzellent
- Riesenschlangen
Wikimedia Foundation.