- Äpfelsäure
-
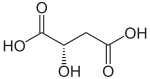
Strukturformel 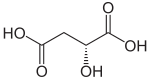
D-Äpfelsäure L-Äpfelsäure Allgemeines Name Äpfelsäure Andere Namen - Apfelsäure
- 2-Hydroxybernsteinsäure
- 2-Hydroxybutandisäure
- E 296
Summenformel C4H6O5 CAS-Nummer - 97-67-6 (L-Äpfelsäure)
- 636-61-3 (D-Äpfelsäure)
- 6915-15-7 (DL-Äpfelsäure)
Kurzbeschreibung weißer Feststoff[1]
Eigenschaften Molare Masse 134,09 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt pKs-Wert Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Gefahr
H- und P-Sätze H: 318-335-315 EUH: keine EUH-Sätze P: 261-302+352-305+351+338-321-405-501 [1] EU-Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36 S: keine S-Sätze LD50 1600 mg·kg−1 (Maus, oral)[4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Äpfelsäure (2-Hydroxybernsteinsäure, seltener auch Apfelsäure) ist eine chemische Verbindung aus den Gruppen der Dicarbonsäuren und Hydroxycarbonsäuren, die als rechtsdrehende D- und als linksdrehende L-Äpfelsäure vorkommt. Die L-Form ist ein Zwischenprodukt im Citratzyklus. In der Natur ist L-Äpfelsäure meist in unreifen Früchten, wie etwa Äpfeln, Quitten, Weintrauben, Berberitzenbeeren, Vogelbeeren oder Stachelbeeren, enthalten. Die Ester und Salze der Äpfelsäure heißen Malate (von lateinisch malus = Apfel, nicht zu verwechseln mit Maleaten, die Ester und Salze der Maleinsäure).
Inhaltsverzeichnis
Historisches
L-Äpfelsäure wurde erstmals 1785 von Carl Wilhelm Scheele aus Apfelsaft isoliert und beschrieben. Antoine Lavoisier schlug 1787 den Namen acide malique, abgeleitet vom lateinischen Wort für Apfel, mālum vor.[5] Paul Walden konnte durch Synthese von L-Äpfelsäure und D-Äpfelsäure die Chiralität und die Konfigurationsumkehr am Kohlenstoffatom beweisen.
Eigenschaften
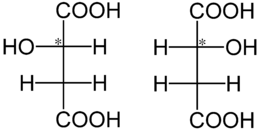
Die Äpfelsäure besitzt ein Stereozentrum (*) und ist optisch aktiv. Unten dargestellt sind die L-Äpfelsäure (links) und die D-Äpfelsäure (rechts) in der Fischerprojektion:
Wie alle Enantiomeren besitzen die L-Äpfelsäure und die D-Äpfelsäure, mit Ausnahme der Richtung des Drehwertes α die gleichen physikalischen Eigenschaften. Die physikalischen Eigenschaften (Beispiel: Schmelzpunkt) von DL-Äpfelsäure, ein Racemat, unterscheiden sich deutlich von denen der reinen Enantiomeren L-Äpfelsäure und D-Äpfelsäure.
Verwendung
Als Lebensmittelzusatzstoff (E 296) darf sowohl die natürliche L-Form als auch die synthetische D-Form oder das Racemat verwendet werden. In der Praxis ist ihre Verwendung aufgrund des relativ hohen Preises eher gering. Stattdessen werden meist günstigere Alternativen, wie Citronensäure (E 330), Natriumbenzoat (E 211) oder auch Phosphorsäure (E 338) verwendet. Als Zusatzstoff in Kartoffelchips werden Natriummalat (E 350), Kaliummalat (E 351) und Calciummalat (E 352) verwendet. In der Medizin wird Kaliummalat bei Hypokaliämie als Infusionslösung eingesetzt, falls Kaliumchlorid wegen gleichzeitig bestehender Hyperchlorämie nicht eingesetzt werden kann.
Herstellung
Die L-Äpfelsäure und ihre Salze (Malate) werden nach einem biotechnologischen Verfahren, katalysiert durch das Enzym Fumarat-Hydratase, aus Fumarsäure (E 297) beziehungsweise als Stoffwechselprodukt von Bakterien und Pilzen (z. B. Brevibacterium, Corynebacterium, Escherichia, Microbacterium, Proteus, Pichia) gewonnen.[6] Die enantiospezifische Anlagerung von Wasser an Maleinsäure wird durch die Maleat-Hydratase katalysiert und führt zu D-Äpfelsäure.[6] Racemische Äpfelsäure kann durch die Bildung diastereomerer Salze mit einem geeigneten enantiomerenreinen Amin in L-Äpfelsäure und D-Äpfelsäure gespalten werden.
Weinbau
L-Äpfelsäure ist auch in Weintrauben enthalten. Ein niedriger Äpfelsäureghalt gilt als Reifeparamter. Beim Ausbau des Weines kann gezielt oder auch spontan eine Malolaktische Gärung eingeleitet werden. Milchsäurebakterien Oenococcus oeni verstoffwechseln unter Abgabe von CO2 und sonstigen Nebenprodukten die deutlich saurer schmeckende Äpfelsäure in die weniger sauer schmeckende Milchsäure.
Biologische Funktion
Die Äpfelsäure ist für den sauren Geschmack von Äpfeln verantwortlich. Wenn die Frucht reift, nimmt ihr Gehalt ab, wobei gleichzeitig der Zuckergehalt ansteigt. Dieser Effekt ist für die Fortpflanzung des Apfelbaums von essentieller Bedeutung, da der hohe Gehalt an Äpfelsäure in den Früchten verhindert, dass Tiere diese fressen und damit die noch unreifen Samen verteilen.[7]
Bei Pflanzen, die einen Crassulaceen-Säurestoffwechsel (CAM) aufweisen, wird Malat in der Nacht aus aufgenommenem Kohlenstoffdioxid gebildet und gespeichert. Am Tag wird CO2 wieder aus Äpfelsäure freigesetzt und direkt dem Calvin-Zyklus zugeführt. Das führt dazu, dass die CAM-Pflanzen tagsüber ihre Poren geschlossen halten können und damit Verdunstungsverluste von Wasser stark vermindert werden.[3]
Einzelnachweise
- ↑ a b c d e f Eintrag zu CAS-Nr. 6915-15-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Januar 2008 (JavaScript erforderlich).
- ↑ a b c d e The Merck Index, 9. Auflage, 1976, ISBN 0-911910-26-3, S. 741.
- ↑ a b c d Thieme Chemistry (Hrsg.): Eintrag zu CAM-Pflanzen im Römpp Online. Version 3.14. Georg Thieme Verlag, Stuttgart 2011, abgerufen am 25. Juli 2011..
- ↑ Malic acid bei ChemIDplus.
- ↑ William B. Jensen: The Origin of the Names Malic, Maleic, and Malonic Acid, in: J. Chem. Educ., 2007, 84, S. 924; doi:10.1021/ed084p924.
- ↑ a b Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, 2006, ISBN 3-906390-29-2, S. 362–370.
- ↑ Chemie Oberstufe – Organische Chemie, 1. Auflage, Cornelsen Verlag, Berlin 2010, ISBN 978-3-06-011177-0.
Weblinks
Siehe auch
Kategorien:- Reizender Stoff
- Alpha-Hydroxycarbonsäure
- Dicarbonsäure
- Stoffwechselintermediat
- Säuerungsmittel
- Beta-Hydroxycarbonsäure
Wikimedia Foundation.