- Isovanillin
-
Strukturformel 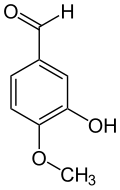
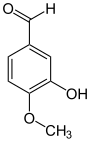
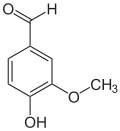
Allgemeines Name Isovanillin Andere Namen 3-Hydroxy-4-methoxybenzaldehyd
Summenformel C8H8O3 CAS-Nummer 621-59-0 PubChem 12127 Kurzbeschreibung schwach gelbliche glasglänzende Säulen[1]
Eigenschaften Molare Masse 152,15 g·mol−1 Aggregatzustand fest
Schmelzpunkt Siedepunkt pKs-Wert 8,89 (25 °C)[3]
Löslichkeit in heißem Wasser leicht, in kaltem kaum löslich; sehr leicht löslich in Chloroform, leicht in Ethanol, Ether, Methanol und Eisessig[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [2] EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36/37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Isovanillin (3-Hydroxy-4-methoxybenzaldehyd) ist eine organische chemische Verbindung mit der Summenformel C8H8O3. Es ist ein substituiertes Derivat des Benzaldehyds mit einer zusätzlichen Hydroxy- und einer Methoxygruppe. Es ist ein Isomer zum Vanillin, von dem es sich nur durch die Stellung der Methoxygruppe unterscheidet. Anstatt an Position 3 ist diese hier an Position 4 vorzufinden. Hydroxy- und Methoxygruppe tauschen im Vergleich zum Vanillin die Plätze.
Inhaltsverzeichnis
Eigenschaften
Isovanillin wurde 1882 von Rudolf Wegscheider isoliert und charakterisiert.[1] Es bildet monokline Kristalle[4], schmilzt bei 113–116 °C[2] und siedet bei 179 °C bei Unterdruck 15 mmHg (20 hPa)[2]. Der pKs-Wert der phenolischen OH-Gruppe beträgt 8,89 (25 °C).[3] Im Gegensatz zum Vanillin ist das Isovanillin nahezu geruchlos.[5][6] Auch bildet es mit einer wässrigen Lösung von Eisen(III)-chlorid keine Färbung.[1] Isovanillin kann enzymatisch zur Isovanillinsäure oxidiert werden.[7] Es ist ein Synthesebaustein, der vor allem im Pharma-, Kosmetik-, Agrar- und Nahrungsmittelbereich Verwendung findet.
Darstellung
Zur Darstellung sind zahlreiche Verfahren bekannt:[8]
- Piperonal (3,4-(Methylendioxy)-benzaldehyd) wird mit Natriummethanolat in Gegenwart von Kupfer(I)-chlorid in Dimethylformamid umgesetzt.[9]
- Veratrumaldehyd (3,4-Dimethoxybenzaldehyd) kann durch selektive Demethylierung mit Methionin in Methansulfonsäure zu Isovanillin umgesetzt werden.[10] Die Reaktionszeiten sind lang und die Selektivität ist nicht sehr hoch.
- Eine selektive O-Methylierung von Protocatechualdehyd (3,4-Dihydroxybenzaldehyd) durch Methyliodid in Gegenwart von Natriumhydrid in Dimethylsulfoxid führt zu einer Ausbeute von etwa 65 % Isovanillin.[11]
- Eine Formylierung von Guajacol (o-Methoxyphenol), welches als Acetat geschützt ist, erfolgt mit Dichlormethoxymethan in Gegenwart von Titantetrachlorid in Dichlormethan. Der 3-Acetoxy-4-methoxybenzaldehyd wird anschließend mit NaOH hydrolysiert.[12]
Einzelnachweise
- ↑ a b c d Rudolf Wegscheider: "Über Isovanillin", in: Monatshefte für Chemie, 1882, 3 (1), S. 789–795; doi:10.1007/BF01516846.
- ↑ a b c d e f g Datenblatt Isovanillin bei Sigma-Aldrich, abgerufen am 6. April 2011.
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Fujiko Iwasaki: "The Crystal Structure of 3-Hydroxy-4-methoxybenzaldehyde (Isovanillin)", in: Chemistry Letters, 1973, 2 (3), S. 227–228; doi:10.1246/cl.1973.227; PDF.
- ↑ Toru Egawa, Akiyo Kameyama, Hiroshi Takeuchi: "Structural determination of vanillin, isovanillin and ethylvanillin by means of gas electron diffraction and theoretical calculations", in: Journal of Molecular Structure, 2006, 794 (1–3), S. 92–102; doi:10.1016/j.molstruc.2006.01.042.
- ↑ Riechstofflexikon: Vanillin.
- ↑ Georgios I. Panoutsopoulos, Christine Beedham: "Enzymatic Oxidation of Vanillin, Isovanillin and Protocatechuic Aldehyde with Freshly Prepared Guinea Pig Liver Slices", in: Cell. Physiol. Biochem., 2005, 15 (1–4), S. 89–98; PMID 15665519; PDF.
- ↑ Patentschriften: PatentDE: Verfahren zur Herstellung von Isovanillin; United States Patent 5648552: Process for the preparation of isovanillin.
- ↑ Baratov et al., Zh. Org. Khim., 1991, 27 (7), S. 1578–.
- ↑ Nobutaka Fujii, Hiroshi Irie, Haruaki Yajima: "Regioselective Cleavage of Aromatic Methyl Ethers by Methanesulphonic Acid in the Presence of Methionine", in: J. Chem. Soc., Perkin Trans. 1, 1977, 20, S. 2288–2288; doi:10.1039/P19770002288.
- ↑ Satinder V. Kessar, Yash P. Gupta, Taj Mohammed, (Miss) Manju Goyal, Kewal K. Sawal: "Regioselective Mono-O-alkylation of some Pyrocatechoxide Dianions", in: J. Chem. Soc., Chem. Commun., 1983, 7, S. 400–401; doi:10.1039/C39830000400.
- ↑ Maria Luisa Scarpati, Armandodoriano Bianco, Livia Mascitelli, Pietro Passacantilli: "Selective Formylation of Diphenols", in: Synth. Commun., 1990, 20 (17), S. 2565–2572; doi:10.1080/00397919008051462.
Weblinks
Siehe auch
Wikimedia Foundation.