- 2-Aminobutandisäure
-
Strukturformel 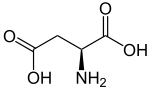
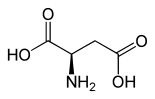
L-Asparaginsäure (links) bzw. D-Asparaginsäure (rechts)Allgemeines Name Asparaginsäure Andere Namen - Aminobernsteinsäure
- 2-Aminobutandisäure
- Asp (Dreibuchstabencode)
- D (Einbuchstabencode)
Summenformel C4H7NO4 CAS-Nummer - 56-84-8 (L-Enantiomer)
- 1783-96-6 (D-Enantiomer)
PubChem 424 ATC-Code V06DD
DrugBank NUTR00016 Kurzbeschreibung weißes Pulver Eigenschaften Molare Masse 133,10 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit schlecht in Wasser (4 g·l−1 bei 20 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Asparaginsäure ist in seiner natürlichen L-Form eine der 20 proteinogenen α-Aminosäuren. Das Säureanion bezeichnet man als Aspartat-Ion. Da Aminosäuren im Körper normalerweise immer deprotoniert vorliegen, wird in der Biochemie statt L-Asparaginsäure häufig nur die Bezeichnung L-Aspartat verwendet.
Inhaltsverzeichnis
Eigenschaften
Asparaginsäure reagiert aufgrund ihrer zwei Carboxylgruppen sauer. Daher liegt diese Aminosäure physiologisch – je nach pH-Wert – meist als inneres Salz in Form eines Aspartats vor.
Vorkommen
L-Asparaginsäure wurde erstmals durch Hydrolyse von Asparagin gewonnen, das in den Keimlingen von Leguminosen vorkommt. Gemüsespargel (Asparagus officinalis) enthält ebenfalls relativ hohe Anteile an L-Asparaginsäure.
Biosynthese und industrielle Herstellung
Die Biosynthese von L-Asparaginsäure erfolgt zum Beispiel aus der homologen Ketosäure Oxalacetat durch Transaminierung. Industriell wird die L-Asparaginsäure nach einem biotechnologischen Verfahren enantioselektiv durch Anlagerung von Ammoniak an die C=C-Doppelbindung von Fumarsäure gewonnen.[2] Dabei wird ein Mikroorganismus mit dem Enzym L-Aspartase eingesetzt.
Funktionen
L-Aspartat (die konjugierte Base der Asparaginsäure) soll bei Wirbeltieren zusammen mit Glutaminsäure in mehr als 50 Prozent aller Synapsen des zentralen Nervensystems als Transmitter fungieren, unter anderem in den Kletterfasern des Kleinhirns und den Moosfasern der Ammonshornformation. Es wirkt über die Stimulation der NMDA-Rezeptoren. Die Wirkung ist jedoch nicht so stark wie mit Glutamat.[3]
Außerdem wird L-Asparaginsäure im Harnstoffzyklus durch das Enzym Argininosuccinat-Synthethase mit Citrullin unter Spaltung von ATP zu AMP und PPi zu Argininosuccinat zusammengefügt. Dieses wird dann durch die Argininosuccinatlyase in L-Arginin und Fumarat aufgespalten. L-Arginin gibt dann Harnstoff ab, während Fumarat wieder im Citratzyklus zum Oxalacetat konvertiert wird, das wieder zum L-Aspartat transaminiert werden kann (Aminogruppenübertragung von α-Aminosäuren auf Harnstoff via Transaminierung von Oxalacetat).
Verwendung
Erhebliche Mengen L-Asparaginsäure werden für die Synthese von Aspartam eingesetzt. Weiterhin wird L-Asparaginsäure als Edukt für die stereoselektive Synthese einer Vielzahl chiraler organisch-chemischer Verbindungen benutzt.[4] N-substituierte Asparaginsäureester werden als Reaktivkomponenten in modernen Lacksystemen eingesetzt. .
Siehe auch
Quellen
- ↑ a b c Eintrag zu L-Asparaginsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. Mai 2008 (JavaScript erforderlich)
- ↑ Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: "Herstellung und Verwendung von Aminosäuren", Angewandte Chemie 90 (1978) 187–194, doi:10.1002/ange.19780900307; Angewandte Chemie International Edition in English 17, 176–183, doi:10.1002/anie.197801761
- ↑ Philip E. Chen, Matthew T. Geballe, Phillip J. Stansfeld, Alexander R. Johnston, Hongjie Yuan, Amanda L. Jacob, James P. Snyder, Stephen F. Traynelis, and David J. A. Wyllie. 2005. Structural Features of the Glutamate Binding Site in Recombinant NR1/NR2A N-Methyl-D-aspartate Receptors Determined by Site-Directed Mutagenesis and Molecular Modeling. Molecular Pharmacology. Ausgabe 67, Seiten 1470-1484.
- ↑ Gary M. Coppola und Herbert F. Schuster: Asymmetric Synthesis – Construction of Chiral Molecules Using Amino Acids, Wiley, 1987, S. 204-213, ISBN 0-471-82874-2.
Weblinks
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.
