- Softenon
-
Strukturformel 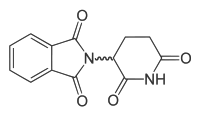
Allgemeines Freiname Thalidomid Andere Namen - 2-(2,6-Dioxo-3-piperidyl)isoindol-1,3-dion
- 2-(2,6-Dioxopiperidin-3-yl)isoindol-1,3-dion (IUPAC)
- α-Phthalimidoglutarimid
- 3-Phthalimidopiperidin-2,6-dion
Summenformel C13H10N2O4 CAS-Nummer 50-35-1 PubChem 5426 ATC-Code L04AX02
DrugBank APRD01251 Arzneistoffangaben Wirkstoffklasse Fertigpräparate Thalidomide Pharmion®
Verschreibungspflichtig: ja Eigenschaften Molare Masse 258,23 g·mol−1 Schmelzpunkt Sicherheitshinweise Gefahrstoffkennzeichnung [1]
T
GiftigR- und S-Sätze R: 21-25-46-61-62 S: 22-26-36/37/39-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Thalidomid (α-Phthalimidoglutarimid) ist der Wirkstoff des Schlaf- und Beruhigungsmittels, das unter den Markennamen Contergan® und Softenon® verkauft wurde. Es führte Ende der 1950er/Anfang der 1960er-Jahre zu zahlreichen schweren Schädigungen an ungeborenem Leben und damit zum Contergan-Skandal.
Chemisch gesehen gehört es – wie auch Glutethimid, Methyprylon und Pyrithyldion – zur Gruppe der Piperidindione. Diese wiederum sind strukturelle Abwandlungen der Barbiturate.
Thalidomid ist eine chirale Verbindung, die in Form des racemischen Gemischs der beiden Enantiomere als Schlaf- und Beruhigungsmittel auf den Markt gebracht wurde. Zunächst wurde angenommen, dass für die Fehlbildungen (die teratogene Wirkung) allein das (S)-Enantiomer verantwortlich sei und nur das (R)-Enantiomer die gewünschte beruhigende Wirkung hervorrufe. Da die Enantiomere bei Thalidomid im Körper allerdings racemisieren (also gegenseitig ineinander umgewandelt werden), ist diese Unterscheidung unerheblich. Die Gabe eines reinen Thalidomid-Enantiomers hätte demnach die Contergan-Katastrophe nicht verhindern können.
Inhaltsverzeichnis
Geschichte
Schlaf- und Beruhigungsmedikament
Im Jahr 1953 wurde in der Forschungsabteilung des Stolberger Pharmaunternehmens Grünenthal - auf der Suche nach einer günstigen Methode zur Gewinnung von Antibiotika aus Peptiden - durch die Erhitzung des Phthaloylisoglutamin das Phthalimidoglutarimid synthetisiert. Es erhielt durch den Leiter der Forschungsabteilung Heinrich Mückter den Namen Thalidomid.[3]
Diese Substanz zeigte bei Tests mit Mäusen und Ratten keine antibiotische Wirkung oder andere Effekte. Zunächst erschien die Substanz harmlos; hohe Dosen der Substanz zeigten keine tödliche Wirkung bei Nagetieren, Hasen, Katzen oder Hunden. Es wurde nun begonnen für das patentierte Molekül eine Anwendung zu finden. Obwohl das Thalidomid keine sedierenden Effekte im Tierversuch zeigte, wurde es vom Management als „nicht tödliches Schlafmittel mit enormem Marktpotential“[3] betrachtet.
Zunächst wurde es zur Anfallsprophylaxe bei Epilepsie verschrieben. Es zeigte zwar keine antikonvulsive Wirkung, die Patienten berichteten jedoch von der guten schlafbringenden und entspannenden Eigenschaft des Medikamentes.[4]
Thalidomid durfte in Deutschland nicht verkauft werden, solange nicht seine Wirkung im Tierversuch getestet wurde. Da im Tierversuch Thalidomid keine sedierende Wirkung zeigte, wurde es an Mäusen im Schüttelkäfig getestet. Dabei wurde untersucht, inwiefern sich die Bewegungen der Mäuse in der Verumgruppe und der Placebogruppe unterschieden.[3]
Bevor das Mittel auf den Markt kam, wurde eine Probe von einem Grünenthal-Mitarbeiter mit nach Hause genommen, der es seiner schwangeren Frau gab, um ihr zu einem besseren Schlaf zu verhelfen. Das Kind kam ohne Ohren zur Welt und wurde so zum ersten Contergan-Opfer.[4]
Grünenthal vermarktete die Substanz vom 1. Oktober 1957 bis Ende 1961 unter dem Namen Contergan als „erstes bromfreies Schlaf- und Beruhigungsmedikament ohne größere Nebenwirkungen“. Da Contergan unter anderem auch gegen die typische morgendliche Schwangerschaftsübelkeit in der frühen Schwangerschaftsphase half, wurde es Ende der 1950er-Jahre gezielt als das Beruhigungs- und Schlafmittel für Schwangere empfohlen und beworben. Im Hinblick auf Nebenwirkungen galt es als besonders sicher, denn als bromfreies Schlafmittel sollten Nebenwirkungen wie Verwirrtheitszustände, Delirien und Stottern ausbleiben.
Contergan-Skandal
- Hauptartikel: Contergan-Skandal
Ende der 1950er-Jahre kam es zu einer zunächst unerklärlichen Häufung von Missbildungen Neugeborener. Das deutsche Bundesgesundheitsministerium hatte zu derselben Zeit eine Untersuchung vorgelegt, die eine mögliche Schädigung durch Kernenergie zum Thema hatte. Dabei wurden die Rate von Fehlbildungen bei Kindern untersucht und eine Zunahme statistisch verneint, allerdings mit Daten, die nur bis zum Zeitpunkt der Marktzulassung von Thalidomid reichten. Aufgrund dieser Statistik glaubte man bei den neu aufgetretenen Schädigungen erst an eine zufällige Häufung, was die Ursachenforschung deutlich verzögerte.[5]
Dass die Schädigungen eine Folge des Wirkstoffs Thalidomid waren, wurde unabhängig voneinander in Deutschland, Großbritannien und Australien entdeckt. Der deutsche Kinderarzt und Humangenetiker Widukind Lenz, der zu den Entdeckern dieses Zusammenhanges zählt, machte seine Erkenntnisse auf einem Kongress publik und löste dadurch den Skandal aus.[6] Die Firma Grünenthal reagierte zunächst nicht auf die Warnungen. Obwohl dem Stolberger Herstellerunternehmen 1961 bereits 1.600 Warnungen über beobachtete Fehlbildungen an Neugeborenen vorlagen, wurde Contergan nach wie vor vertrieben. Zu jenem Zeitpunkt hatte es 46 % des Marktes für barbituratfreie Schlafmittel erobert. Erst nach einem Zeitungsartikel in der Welt am Sonntag vom 26. November 1961 zog Grünenthal schließlich am darauffolgenden Tag Contergan aus dem Handel – allerdings war das Unternehmen nach eigenen Angaben bereits am 16. November von Lenz in Kenntnis gesetzt worden.
Laut Bundesverband Contergangeschädigter wurden etwa 5000 contergangeschädigte Kinder geboren. Andere Quellen sprechen von 10.000 Fällen weltweit, von denen 4000 auf die Bundesrepublik Deutschland entfielen, wovon die Hälfte bereits verstorben ist. Hinzu kommt eine unbekannte Zahl von Fehlgeburten. In der DDR hatte der Zentrale Gutachterausschuss für das Arzneimittelwesen die Herstellung und den Vertrieb von Schlafmitteln auf Basis von Thalidomid abgelehnt, da man dieses als noch nicht ausreichend überprüft einstufte.[7] Einige wenige Conterganpackungen gelangten aus der Bundesrepublik in die DDR. Insgesamt sind in der DDR acht Fälle von Missbildungen dokumentiert, die durch Contergan bedingt waren.[8]
In Österreich und in der Schweiz hieß das Mittel Softenon und war verschreibungspflichtig. Offiziell gibt es in Österreich dreizehn Contergan-Opfer, da man hier damals sehr restriktiv mit der Rezeptpflicht umging. In der Schweiz wurden neun contergangeschädigte Kinder geboren.[9] Softenon wurde 1962 vom Markt genommen.
Auch in Brasilien gibt es anerkannte Schadensfälle durch Thalidomid.[10] Contergan wurde auch in größeren Mengen nach Osteuropa und Vorderasien geliefert.[11]
In den USA wurde Contergan die Zulassung verweigert, wurde aber in großen Mengen „zu Testzwecken“ verteilt, nachdem der amerikanische Hersteller Richardson-Merrell die Zulassung im September 1960 erstmals beantragt hatte. Frances Oldham Kelsey, die zuständige Pharmakologin der US-Gesundheitsbehörde Food and Drug Administration hatte sich nicht auf die Angaben der Firma Richardson-Merrell verlassen, die keine Testergebnisse beinhalteten. Stattdessen wurden nur generelle Aussagen Grünenthals und des Marketing-Departments von Richardson-Merrell angegeben, und Geschäftsleute und Politiker übten Druck auf Kelsey aus. Sie forderte Richardson-Merrell auf, Tests durchzuführen und die Ergebnisse mitzuteilen. Die Firma weigerte sich und verlangte insgesamt sechs Mal, die Zulassung zu gestatten, was jedes Mal abschlägig beschieden wurde. Im Jahre 1962 zog Richardson-Merrell dann den Antrag auf Zulassung zurück. Trotzdem wurden insgesamt 17 Kinder mit Contergan-bedingten Missbildungen geboren.[12]
Die geballte Medienpräsenz des Themas durch den 50. Jahrestag der Markteinführung von Contergan und dem Fernsehzweiteiler „Eine einzige Tablette“ kurz darauf führte 46 Jahre nach Bekanntwerden der schädigenden Wirkung zu ersten Gesprächen am 7. Dezember 2007 zwischen Grünenthal und dem Bundesverband der Contergangeschädigten.[13][14][15] Auch andere Geschädigte fordern zum Dialog auf und haben dazu eine das Zitat des Produzenten des Zweiteilers aufgreifende Online-Unterschriften-Aktion gestartet.[16] Betroffenen-Verbände hoffen als Ergebnis auch auf finanzielle und andere Verbesserungen ihrer Situation.[17] Zum 1. Juli 2008 wurde die Verdoppelung der monatlichen Entschädigungszahlungen umgesetzt. Dies wird von Politik und Verbänden als „erster wichtiger Schritt“ zur Milderung der „finanziellen Auswirkungen der Spät- und Folgeschäden“ [18] bezeichnet. [19] Am 8. Mai 2008 gab Grünenthal bekannt, freiwillig 50 Mio. Euro in die Conterganstiftung einzahlen zu wollen, um die Lebenssituation der Contergan-Geschädigten dauerhaft verbessern zu helfen.[20]
Schädigungen durch Thalidomid
Thalidomid führt, innerhalb der ersten drei Monate der Schwangerschaft eingenommen, zu schweren Fehlbildungen[21] der Gliedmaßen (Dysmelien), speziell zum Fehlen von Röhrenknochen (Phokomelie), oder sogar zum totalem Fehlen (Aplasien) von Gliedmaßen und Organen der Kinder. Thalidomid blockiert den Wachstumsfaktor VEGF (Vascular Endothelial Growth Factor), wodurch es zu einer fehlenden Vaskularisierung (Blutgefäßbildung) in den Extremitäten des Embryos kommt. Dies führt zu einer verkürzten oder fehlenden Anlage der Arme und Beine, meist beidseitig (unterscheidet sich von mechanischer Abschnürung von Gliedmaßen, siehe dazu Amniotisches-Band-Syndrom).
Bei der Thalidomid-Embryopathie ist besonders gut untersucht, zu welchem Zeitpunkt der Einwirkung des Medikaments welche Schädigung verursacht wird[22]: zwischen dem 34. und 38. Tag nach der letzten Regelblutung kommt es zu einem Fehlen der Ohrmuschel und zu einer Lähmung des Gesichtsnervs (Facialisparese), zwischen dem 40. und 44. Tag treten Arm-, zwischen dem 43. und 46. Tag Bein- und zwischen dem 48. und 50. Tag Daumenfehlbildungen und eine Verengung des Enddarms auf. Die Dosis ist für das Ausmaß der Schädigung nicht relevant.
In der Zeit nach 1961, nachdem Contergan vom Markt zurückgezogen wurde, wurde es weiterhin an verschiedenen Tierarten getestet. Die Resultate waren größtenteils negativ oder zeigten keine vergleichbaren Fehlbildungen am Nachwuchs. Obwohl Ratten und Mäuse durch die Substanz sediert wurden (der Grund, weshalb man überhaupt auf die sedierende Wirkung des Thalidomid gekommen war, lag darin, dass bei einem Versuch, bei dem eine völlig andere Wirkung des Wirkstoffes untersucht werden sollte, die Nagetiere, die Thalidomid erhielten, wider Erwarten einschliefen), konnte auch in klassischen Tierversuchen mit hoher Konzentration keine fruchtschädigende Wirkung des Präparates nachgewiesen werden. Erst viel später nach der Contergankatastrophe zeigte sich bei Weißen Neuseeländern – einer Kaninchenrasse, die als Versuchstier vor Markteinführung überhaupt nicht als Tiermodell üblich war – eine teratogene Wirkung. Diese dadurch nachgewiesene Artspezifität einer teratogenen Wirkung war bis dato unbekannt und stellt bis heute ein Dilemma bei der Übertragbarkeit von Tierversuchsergebnissen auf den Menschen dar.
Die Befürchtung, dass Thalidomid durch Veränderung des Erbgutes auch nachfolgende Generationen schädigen könnte, hat sich nicht bewahrheitet. Die Kinder thalidomidgeschädigter Menschen sind von dem Thalidomid-Syndrom nicht betroffen. Eine vor einigen Jahren auftauchende Pressemeldung zur angeblichen Vererbbarkeit wurde von Experten als nicht seriös bezeichnet und beruhte vermutlich auf der Verwechslung mit anderen, gelegentlich thalidomid-ähnlichen Behinderungen.
Unterschiedliche Wirkung von (S)- und (R)-Enantiomer
Bei Thalidomid handelt es sich um eine chirale Verbindung, die als (R)- und (S)-Enantiomer enantiomerenrein hergestellt werden kann. Die Verbindung wurde als Racemat verkauft und führte zu schweren Fehlbildungen am ungeborenen Leben. Racemate können mit Boranen (Borwasserstoffen) getrennt werden. Diese Anwendung wurde durch den amerikanischen Chemiker Lipscomb entdeckt, die Borane selbst wurden durch den deutschen Chemiker Alfred Stock entdeckt. Man vermutete zunächst eine teratogene Wirkung der (S)-Verbindung. Da jedoch beide Enantiomere im Körper nach wenigen Stunden racemisieren [23] , wenn auch unvollständig, lässt sich keinem der Enantiomere eine teratogene bzw. beruhigende Wirkung zuschreiben. Dabei wandeln sich die Enantiomere ineinander um, und zwar unabhängig davon, ob reines R- oder S-Enantiomer verabreicht wird; es stellt sich ein R/S-Verhältnis von ca. 1:1,7 ein. Die Geschichte vom „guten“ und „bösen“ Thalidomid-Enantiomer hat jedoch noch immer sehr viele Anhänger und ist in vielen renommierten Lehrbüchern und Journalen zu finden. Sogar das Nobel-Komitee macht davor nicht Halt.[24] Es gibt zwar Hinweise darauf, dass bei ähnlichen Verbindungen das (S)-Enantiomer dennoch das wirksamere, d. h. das fruchtschädigende Enantiomer sein könnte, das in das Immunsystem eingreift. Selbst wenn man wüsste, dass nur eines der Enantiomere schädlich ist, würde das wenig nützen, da im Körper durch die Racemisierung immer beide Formen präsent sind.
Neue Indikationen
In klinischen Studien zeigte Thalidomid aufgrund seiner antiinflammatorischen (entzündungshemmenden), antineoplastischen (tumorhemmenden) und antiangiogenetischen (Verminderung von Gefäßneubildung) Wirksamkeit therapeutische Effekte bei verschiedenen Krankheiten, unter anderem bei Hauterkrankungen (Erythema nodosum leprosum, Lupus erythematodes), dem multiplen Myelom sowie Autoimmunerkrankungen.[5][25] Bei korrekter Anwendung kann Thalidomid eine hilfreiche Therapie für Patienten sein, für deren Krankheiten keine adäquate Behandlung existiert.[26]
Bei an Prostata-Krebs erkrankten Patienten, die sich einer intermittierenden Hormonblockade unterzogen, führte die Gabe von Thalidomid zu einer Verlängerung der Zeit bis zum Wiederanstieg des PSA-Wertes (als Zeichen einer erneuten Aktivität des Karzinoms).[27]
Lepra
Im Jahre 1964 fand der israelische Hautarzt Jacob Sheskin, der einer Lepra-Patientin Contergan aus Restbeständen verabreichte, dass sich ihre Geschwüre am nächsten Tag deutlich zurückgebildet hatten.[25] Bedingt durch diese Entdeckung, wurde Thalidomid für diese Indikation getestet, vor allem in südamerikanischen Ländern wie Kolumbien und Brasilien. Unglücklicherweise kam es dabei auch zu erneuten Fehlbildungen bei Neugeborenen. Da die Rate der Analphabeten in Brasilien extrem hoch ist, missverstanden viele Frauen das Etikett mit einer durchgestrichenen schwangeren Frau auf der Verpackung als Antibabypille. Dadurch kam es in Brasilien zu einer neuen Generation schwer fehlgebildeter Kinder. Infolgedessen verbot Brasilien zunächst die Herausgabe von Thalidomid an Menschen im fortpflanzungsfähigen Alter. In Brasilien gibt es insgesamt 480 anerkannte Schadensfälle durch Contergan.[28] Heute hat sich Thalidomid in Brasilien als verschreibungspflichtige Standardmedikation gegen Lepra durchgesetzt, es gilt als das wirksamste Mittel gegen die Seuche.
1998 beschied in den USA die Food and Drug Administration einen Zulassungsantrag positiv für ein Thalidomid-haltiges Arzneimittel zur Behandlung des Erythema Nodosum Leprosum (ENL), einer besonders schweren Verlaufsform der Lepra. Der Zulassungsinhaber Celgene hat für strenge therapiebegleitende Sicherheitsvorkehrungen zu sorgen. Ein Patient, der daran teilnimmt, muss starke Auflagen akzeptieren und einhalten.
Multiples Myelom
Inzwischen wurde die Indikation um die Behandlung des multiplen Myeloms erweitert.[29][30]. Nachdem Thalidomid 2001 bereits als so genanntes „Arzneimittel für seltene Leiden“ (orphan drug) ausgewiesen und als solches in das entsprechende EU-Gemeinschaftsregister eingetragen wurde, erteilte die EU-Kommission im April 2008 die Zulassung für eine orale Darreichungsform (50 mg Hartkapseln) zur Kombinationstherapie mit Melphalan und Prednison von Patienten mit nicht vorbehandelten multiplen Myelomen ab 65 Jahren oder Patienten, bei denen eine hoch dosierte Chemotherapie nicht in Betracht gezogen werden kann (Zulassungsinhaber: Pharmion Ltd.) [31].
Myelodysplastisches Syndrom
Die Gabe von Thalidomid zur Behandlung des myelodysplastischen Syndroms wird in multizentrischen Studien geprüft. Ein genauer Wirkmechanismus ist noch nicht bekannt, besteht aber möglicherweise in der Hemmung des Tumornekrosefaktor (TNF-α) und Stimulation von zytotoxischen T-Zellen. Vorläufige Daten zeigen, dass Thalidomid bei vielen Patienten zu einer Verbesserung der peripheren Blutzellwerte führen kann. Einige Patienten erreichen eine vollständige Normalisierung des Blutbilds.
Vertrieb
Außer in den USA (seit 1998) ist Thalidomid zurzeit in Australien (seit Oktober 2003), Neuseeland (seit Dezember 2003), der Türkei (seit Juni 2004), Israel (seit September 2004) und in den Mitgliedstaaten der EU (seit April 2008) zugelassen. In den USA, China, Japan, Korea und Taiwan wird Thalidomid durch die Firma Celgene vertrieben. Diese produziert auch das dem Thalidomid ähnliche Lenalidomid. Für alle übrigen Länder hatte die britische Firma Pharmion die Vermarktungsrechte von Celgene erworben. Anfang 2008 jedoch übernahm Celgene die Firma Pharmion mit ihrem gesamten Produktportfolio. Ehemals auslizenzierte Produkte wie z.B. Thalidomid werden nun wieder ausschließlich von Celgene betreut.[32] Die Anwendung erfolgt unter strengen Sicherheitsrichtlinien.
In Deutschland ist die Abgabe thalidomidhaltiger Arzneimittel durch den Paragraf 3a der Arzneimittelverschreibungsverordnung reguliert und unterliegt der amtlichen Überwachung, deshalb muss der Arzt für die Verordnung das so genannte T-Rezept verwenden. Der Arzt muss versichern, die Sicherheitsmaßnahmen gemäß der aktuellen Fachinformation einzuhalten, insbesondere auch, erforderlichenfalls ein Schwangerschafts-Präventionsprogramm durchzuführen. Ferner muss er auf der Verschreibung vermerken, ob die Behandlung innerhalb oder außerhalb (Off-Label-Use) der jeweils zugelassenen Anwendungsgebiete erfolgt.[33]
Das Unternehmen Chemie Grünenthal GmbH, das einst Contergan produzierte, verschenkte[34] Restbestände des Mittels noch bis Ende 2003 an Wissenschaftler. Die inzwischen in Aachen beheimatete Firma vertreibt heute jedoch kein Thalidomid mehr.
Siehe auch
- Contergan (Film) – filmische Umsetzung aus dem Jahr 2006
- Conterganstiftung für behinderte Menschen
Literatur
- K. Roth: Eine unendliche chemische Geschichte, in: Chemie in unserer Zeit 2005, 39, 212–217; doi:10.1002/ciuz.200590038.
- Catia Monser: Contergan/Thalidomid: Ein Unglück kommt selten allein. Eggcup-Verlag, 1993, ISBN 3-930004-00-3 – Buch einer Betroffenen
- Beate Kirk: Der Contergan-Fall: eine unvermeidbare Arzneimittelkatastrophe? Zur Geschichte des Arzneistoffs Thalidomid. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 1999. ISBN 3-8047-1681-4
- L. Zichner, M. A. Rauschmann, K. D. Thomann (Hrsg.): Die Contergankatastrophe – eine Bilanz nach 40 Jahren. Darmstadt: Steinkopff, 2005. ISBN 3-7985-1479-8
- Henning Sjöstrom/Robert Nilsson:Thalidomide and the Power of the Drug Companies.Penguin Books, 1972; deutsche Übersetzung: Contergan oder die Macht der Arzneimittelkonzerne. VEB Verlag Volk und Gesundheit, Berlin(Ost)1975
Weblinks
- Contergan – Thalidomid: umfangreiche kommentierte Linksammlung
- Die Contergan-Katastrophe: Von der trügerischen Sicherheit der "harten" Daten (Ärzteblatt.de)
- Darstellung aus Sicht des Contergan-Herstellers Grünenthal
Einzelnachweise
- ↑ a b Eintrag zu Thalidomid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 18. Dezember 2007 (JavaScript erforderlich)
- ↑ Thalidomid bei ChemIDplus
- ↑ a b c William Silverman, MD: The Schizophrenic Career of a "Monster Drug". In: Pediatrics. 110, Nr. 2, 2002-04-22, S. 404-406
- ↑ a b T. Stephens und R. Brynner: Dark Remedy – The Impact of Thalidomide and Its Revival as a Vital Medicine. Cambridge, MA; Perseus Publishing; 2001, ISBN 978-0738205908.
- ↑ a b Klaus-Dieter Thomann: Die trügerische Sicherheit der „harten“ Daten. Dtsch Arztebl 2007; 104(41): A 2778–82
- ↑ W. von Lenz, K. Knapp: Die Thalidomid-Embryopathie. Deutsche medizinische Wochenschrift, Stuttgart, 1962, 87(24): 1232-1242.
- ↑ Vgl. Huhn, Klaus: Laut Gutachten überflüssig : warum es in der DDR kein Contergan gab..
- ↑ Vgl. Auch in der DDR gab es Kinder mit Missbildungen : Bundesverband: Die Betroffenen wünschen keine Öffentlichkeit.
- ↑ Vgl. Angelika Overath, Das Janusgesicht, Contergan, in: NZZ Folio 04/01 – Thema Pillen
- ↑ Vgl. Hallberg, Stefanie: Vom Horrormittel zum Hoffnungsträger : Comeback des Conterganwirkstoffs Thalidomid..
- ↑ Vgl. Contergan politisch kein Thema : Ausschlussfrist abgelaufen...
- ↑ Vgl. Linda Bren: Frances Oldham Kelsey: FDA Medical Reviewer Leaves Her Mark on History (Artikel im FDA Consumer magazine, March-April 2001).
- ↑ Pressemitteilung des Bundesverbandes
- ↑ Pressemitteilung von Grünenthal
- ↑ Pressemeldungen in der Aachener Zeitung
- ↑ Unterschriften-Aktion
- ↑ Forderungskatalog des Bundesverbandes, neben dem weitere anderer Verbände existieren
- ↑ Pressemitteilung des Familienministeriums zur Verdoppelung
- ↑ Bundesverband zur Verdoppelung
- ↑ Pressemitteilung Grünenthal: „Grünenthal bietet Contergan-Betroffenen 50 Millionen Euro an - Lösung soll Lebenssituation der Betroffenen verbessern“ Homepage der Grünenthal GmbH
- ↑ Fehlbildungen in Abhängigkeit vom Tag der Einnahme der Tablette
- ↑ Fehlbildungen in Abhängigkeit vom Tag der Einnahme der Tablette
- ↑ Bernard Testa, Pierre-Alain Carrupt, Joseph Gal: The so-called ldquointerconversionrdquo of stereoisomeric drugs: An attempt at clarification. In: Chirality. 5, Nr. 3, 1993, S. 105–110 (doi:10.1002/chir.530050302).
- ↑ Vgl. Nobel Komitee
- ↑ a b Silverman WA:The schizophrenic career of a „monster drug“. Pediatrics. 2002 Aug;110(2 Pt 1):404-6. PMID 12165600
- ↑ Calabrese L, Fleischer AB: Thalidomide: current and potential clinical applications. Am J Med. 2000 Apr 15;108(6):487-95. Review. PMID 10781782
- ↑ http://www.ncbi.nlm.nih.gov/pubmed/19167733?ordinalpos=48&itool=EntrezSystem2.PEntrez.Pubmed.Pub
- ↑ Vgl. Hallberg, Stefanie: Vom Horrormittel zum Hoffnungsträger: Comeback des Conterganwirkstoffs Thalidomid.
- ↑ Singhal S et.al., Antitumor activity of thalidomide in refractory multiple myeloma., in N Engl J Med, 341/1999, S.1565–71.
- ↑ Hideshima T et.al., Thalidomide and its analogues overcome drug resistance of human multiple myeloma cells to conventional therapy., in Blood, 96/2000, S.2943–50
- ↑ Monatlicher Bericht von der Plenarsitzung des CHMP, 6. Mai 2008 (PDF, englisch)
- ↑ Pressemitteilung von Celgene Inc.
- ↑ Arzneimittelverschreibungsverordnung (AMVV) § 3a
- ↑ FOCUS Heft 18 (1994) Link FOCUS-Online
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.