- Terephthalsäure
-
Strukturformel 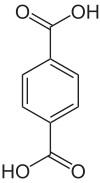
Allgemeines Name Terephthalsäure Andere Namen - p-Phthalsäure
- 1,4-Benzoldicarbonsäure
- TPA
- TPS
- PTA (Purified Terephthalic Acid)
Summenformel C8H6O4 CAS-Nummer 100-21-0 PubChem 7489 Kurzbeschreibung farbloser kristalliner Feststoff mit säuerlichem Geruch[1]
Eigenschaften Molare Masse 166,13 g·mol−1 Aggregatzustand fest
Dichte 1,51 g·cm−3[1]
Sublimationspunkt 402 °C[1]
Dampfdruck pKs-Wert Löslichkeit praktisch unlöslich in Wasser: 15 mg·l−1 (20 °C)[1], Alkoholen und Ether, besser löslich in heißer Schwefelsäure, Pyridin, Dimethylsulfoxid und Dimethylformamid
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze MAK 0,1 mg·m−3 (gemessen als einatembarer Aerosolanteil)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Terephthalsäure oder para-Phthalsäure ist eine organisch-chemische Verbindung und gehört zu den aromatischen Dicarbonsäuren (Benzoldicarbonsäuren). Der Name der Säure leitet sich von Terpentinöl, durch dessen Oxidation sie erstmals dargestellt wurde sowie von Phthalsäure, zu der sie isomer ist, ab.[3] Üblicherweise wird sie in Form eines farblosen rieselfähigen Pulvers zur Herstellung von gesättigten Polyestern verwendet. Konstitutionsisomere sind die Phthalsäure und die Isophthalsäure.
Inhaltsverzeichnis
Gewinnung und Darstellung
Terephthalsäure lässt sich durch Oxidation mit Hilfe von Katalysatoren aus p-Xylol herstellen.
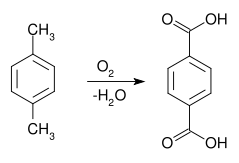
Meist sind diese Katalysatoren Kombinationen aus Cobalt, Mangan und Brom oder Cobalt mit einem Co-Oxidant, zum Beispiel Ethanal. Als Reaktions-Lösungsmittel wird Essigsäure verwendet (Amoco-Verfahren). Weitere Verfahren beruhen auf der Carboxylierung von Benzoesäure mit Kaliumhydrogencarbonat (Kolbe-Schmitt-Reaktion) sowie auf der Isomerisierung von Kaliumphthalat.[3]Eigenschaften
Terephthalsäure kann durch langsame Kristallisation nadelförmige Kristalle ausbilden.
Sie ist in den meisten Lösungsmitteln schwer löslich. Die besten Löslichkeiten (>10 g in 100 g Lösungsmittel bei Normaltemperatur) erreicht man mit Ammoniaklösung, Natronlauge, Dimethylformamid und Dimethylsulfoxid.
Löslichkeiten bei 25 °C Wasser 0,0017 g/100 g Eisessig 0,013 g/100 g Methanol 0,1 g/100 g Dimethylformamid 6,7 g/100 g Dimethylsulfoxid 19,0 g/100 g Verwendung
Sie wird hauptsächlich zur Herstellung von gesättigten Polyestern mit aliphatischen Diolen als Comonomer verwendet. Etwa 90 % der Jahresproduktion von Terephthalsäure gehen in die Produktion des Kunststoffs Polyethylenterephthalat (PET). Als Comonomere werden dabei Ethylenglycol oder 1,4-Butandiol verwendet. Die jährliche Produktionsmenge von Terephthalsäure im Jahr 1992 betrug 12,6 · 106, 1993 waren es bereits mehr als 14 · 106 Tonnen. Zur Herstellung der Polyester werden häufig die Terephthalsäureester Bis(hydroxyethyl)terephthalat und Dimethylterephthalat als Zwischenprodukte eingesetzt. Große Mengen an Terephthalsäure fließen auch in die Produktion aromatischer Polyamide vom Typ Aramid Kevlar™ für hochreißfeste Fasern.
Sicherheitshinweise
Terephthalsäure ist nicht sehr toxisch. Bei Kontakt kann es zu leichten, reversiblen Reizungen der Haut, der Augen und Atemwege kommen. Die orale LD50 liegt für Ratten bei 18,8 g pro Kilogramm Körpergewicht, für Mäuse bei 6,4 g·kg−1. Bei der Aufnahme von hohen Dosen (etwa 3 %), die dem Futter beigemischt wurden, kam es bei Ratten zur Bildung von Blasensteinen aus Calciumterephthalat. Diese Steine verletzten die Harnblase und führten zu Krebs.
Terephthalsäurestäube können mit der Luft explosionfähige Gemische bilden. Die für eine Explosion nötige Minimalkonzentration von Terephthalsäure ist 40 g·m−3 bei 20 °C, der erforderliche Sauerstoffanteil liegt bei 12,4 %. Bei 150 °C ist nur noch ein Sauerstoffanteil von 11,1 % nötig. Es wurde errechnet, dass über einer Konzentration von 1400 g·m−3 Terephthalsäure keine Explosion mehr erfolgt.
Der Flammpunkt von Terephthalsäure beträgt 260 °C und die Zündtemperatur liegt bei 678 °C. Bei der Reaktion mit starken Oxidationsmitteln kann es zu Hitzeentwicklung kommen.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Terephthalsäure in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Beyer-Walter, Lehrbuch der organischen Chemie, S. Hirzel Verlag, Stuttgart 1998.
Literatur
- H. Römpp, J. Falbe, M. Regitz: Römpp Chemie Lexikon., 10. Auflage, Thieme, Stuttgart 1996, ISBN 3-13-107830-8.
- Jacqueline I. Kroschwitz (Hrsg.): Encyclopedia of Chemical Technology, 4th Edition, John Wiley & Sons, 1998, ISBN 0-471-52687-8.
- Barbara Elvens et. al. (Hrsg.): Ullmann´s Encyclopedia of Chemical Industry, 5th Edition, ISBN 3-527-20100-9.
Weblinks
 Wiktionary: Terephthalsäure – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: Terephthalsäure – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wikimedia Foundation.
