- Bindefähigkeit
-
Die Wertigkeit oder Valenz eines Atoms oder einer Gruppe von Atomen innerhalb einer chemischen Verbindung wurde 1852 vom englischen Chemiker Edward Frankland eingeführt und gab ursprünglich an, wie viele Atome Wasserstoff das Atom oder die Gruppe an sich binden kann. Der Begriff wurde vielfach erweitert und steht nun in verschiedenen Bereichen der Chemie je nach Kontext für die stöchiometrische Wertigkeit, die Ionenwertigkeit, die Bindigkeit (Bindungswertigkeit, Kovalenz) oder die koordinative Wertigkeit (Koordinationszahl).[1][2] Ergänzt man die ursprünglich vorzeichenlose stöchiometrische Wertigkeit je nach Polarität einer Bindung um ein positives oder negatives Vorzeichen, erhält man die elektrochemische Wertigkeit oder Oxidationszahl eines Atoms innerhalb einer Verbindung. Bestimmt wird die Wertigkeit eines Elements durch seine Elektronenkonfiguration,[3] weshalb auch Elemente derselben Hauptgruppe des Periodensystems der Elemente dieselbe Wertigkeit aufweisen. Bei den meist metallischen Nebengruppenelementen besitzen Elemente einer Gruppe zumindest ähnliche Wertigkeiten.
Geschichte
1852 stellte der englische Chemiker Sir Edward Frankland fest, dass jedes Atom eine bestimmte Bindefähigkeit gegenüber anderen Atomen hat. Aus dieser Feststellung entstand der Begriff der Wertigkeit.
In der modernen Chemie spielt der Begriff der Wertigkeit nur noch eine untergeordnete Rolle und wird heute häufig als Synonym zur Oxidationszahl verwendet, wobei beide Zahlen aber nur in ionischen Verbindungen gleich sind. Im modernen Atombild entstehen Bindungen durch Orbital-Wechselwirkungen, so dass die Zahl und Art der für chemische Bindungen zur Verfügung stehenden Orbitale die „Bindefähigkeit“ bestimmt. So kennt man beispielsweise für Sauerstoff, der nach alter Definition eine Wertigkeit von II besitzt, auch kovalent aufgebaute Verbindungen mit einer, zwei, drei oder sogar vier Bindungen. Darüber hinaus können sogenannte Mehrzentrenbindungen auftreten und der Übergang von kovalenten zu ionischen Wechselwirkungen ist häufig fließend, so dass auch höhere Koordinationszahlen auftreten, als es der Zahl der Valenzorbitale des betrachteten Atoms entspricht.
Die Stöchiometrische Wertigkeit
Beispiele
Die Wertigkeit von Hauptgruppenelementen gegenüber Fluor und Sauerstoff
Die maximale Wertigkeit eines chemischen Elements aus einer der Hauptgruppen des Periodensystems gegenüber den elektronegativsten Nichtmetallen Fluor und Sauerstoff entspricht fast immer der Hauptgruppennummer des chemischen Elements.
Die Elemente der VIII. Hauptgruppe bilden dabei eine Ausnahme, da diese Edelgase nur unter extremen Bedingungen (siehe: Edelgasverbindungen) chemischen Bindungen eingehen.
Wertigkeit von Hauptgruppenelementen mit griechischen Zahlworten
Die einfachste Darstellung der Wertigkeit ist über griechische Zahlwörter möglich, die dabei den Index des im Namen nachstehenden Elements angeben, zum Beispiel:
- Kohlenstoffdioxid → CO2
- Stickstofftrifluorid → NF3
- Schwefeltrioxid → SO3
Die Wertigkeit von Nebengruppenelementen
Die meist metallischen Nebengruppenelemente besitzen in der Regel die Wertigkeit I, II, III oder IV, können aber auch höhere Wertigkeiten haben. Um die Wertigkeit des jeweiligen Nebengruppenelementes anzugeben, gibt es neben den griechischen Zahlworten noch eine andere Möglichkeit.
Wertigkeit von Nebengruppenelementen mit deutschen Zahlworten
Das deutsche Zahlwort für die römische Ziffer gibt die Wertigkeit des im Namen voranstehenden Elements an, zum Beispiel:
- Kupfer(I)-oxid (sprich „Kupfer-Eins-Oxid“) → Cu2O
- Eisen(III)-oxid (sprich „Eisen-Drei-Oxid“) → Fe2O3
- Cer(IV)-oxid (sprich „Cer-Vier-Oxid“) → CeO2
Die Wertigkeit von Hauptgruppenelementen gegenüber Wasserstoff
Jedes Hauptgruppenelement der Gruppe I bis VII hat gegenüber Wasserstoff zwei mögliche Wertigkeiten:
- die Wertigkeit, die seiner Hauptgruppennummer entspricht.
- die Wertigkeit, die der Differenz zwischen 8 und der Hauptgruppennummer entspricht.
Hierbei ist die jeweils kleinere Wertigkeit die häufigere. Die Elemente der VIII. Hauptgruppe sind dabei nicht mit einbegriffen, da diese Edelgase sind und in der Regel keine chemischen Verbindungen eingehen.
Berechnung der Wertigkeit in chemischen Verbindungen
Aus Atomen zweier verschiedener chemischer Elemente
Zur Berechnung von chemischen Verbindungen aus Atomen zweier chemischer Elemente muss das kleinste gemeinsame Vielfache (kurz: KGV) der Wertigkeiten der beiden beteiligten chemischen Elemente gebildet werden. Um nun die Zahl der in der Verbindung vorhandenen Atome des jeweiligen Elements zu ermitteln, muss das KGV durch die Wertigkeit dividiert werden.
Beispiel 1: Die Ermittlung der chemischen Formel von Wasser
- Die Wertigkeit von Wasserstoff ist:
- I, da Wasserstoff in der I. Hauptgruppe steht.
- Die Wertigkeit von Sauerstoff ist:
- VIII − VI = II, da Sauerstoff in der VI. Hauptgruppe steht.
- Das KGV heißt:
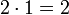 .
.
- Die Zahl der beteiligten Sauerstoff-Atome ist:
 .
.
- Die Zahl der beteiligten Wasserstoff-Atome ist:
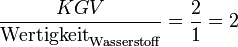 .
.
- Die chemische Formel lautet:
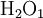 ,
,- und da die Eins (1) im Index von Sauerstoff (O) nicht mit notiert wird:
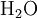 .
.
Beispiel 2: Die Ermittlung der chemischen Formel von Aluminiumoxid
- Die Wertigkeit von Aluminium ist:
- III, da Aluminium in der III. Hauptgruppe steht.
- Wertigkeit von Sauerstoff ist:
- VIII − VI = II, da Sauerstoff in der VI. Hauptgruppe steht.
- Das KGV heißt:
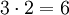 .
.
- Die Zahl der beteiligten Sauerstoff-Atome ist:
 .
.
- Die Zahl der beteiligten Aluminium-Atome ist:
 .
.
- Die chemische Formel lautet:
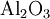 .
.
Beispiel 3: Die Ermittlung der chemischen Formel von Ammoniak
- Die Wertigkeit von Stickstoff ist:
- VIII − V = III, da Stickstoff in der V. Hauptgruppe steht.
- Die Wertigkeit von Wasserstoff ist:
- I, da Wasserstoff in der I. Hauptgruppe steht.
- Das KGV heißt:
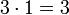 .
.
- Die Zahl der beteiligten Wasserstoff-Atome ist:
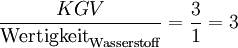 .
.
- Die Zahl der beteiligten Stickstoff-Atome ist:
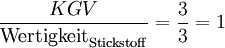 .
.
- Die chemische Formel lautet:
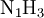 ,
,- und da die Eins (1) im Index von Stickstoff (N) nicht notiert wird:
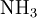 .
.
Die elektrochemische Wertigkeit
- siehe Hauptartikel Oxidationszahl
Definition und Vereinbarungen
Die elektrochemische Wertigkeit oder Oxidationszahl eines Atoms beziffert, wie viele Wasserstoff- oder andere einwertige Atome es binden oder in Verbindungen ersetzen kann.
Man traf folgende Vereinbarungen:
- Alle Atome, die Wasserstoff-Atome binden, dokumentieren eine negative Wertigkeit; alle Atome, die Wasserstoff-Atome ersetzen, verfügen über eine positive Wertigkeit.
- Wasserstoff weist definitionsgemäß die Wertigkeit +I auf.
- Die Wertigkeit wird mit römischen Ziffern rechts oben neben dem Elementsymbol angegeben. Falls es aus Platzgründen nicht möglich ist, kann die Wertigkeit auch direkt über das betreffende Elementsymbol notiert werden.
Wertigkeiten der chemischen Elemente
Element Elementsymbol Wertigkeit[4] Actinium Ac III Aluminium Al III Americium Am III, IV, V, VI Antimon (Stibium) Sb III, V Argon Ar 0 Arsen As III, V Astat At I, III, V, VII Barium Ba II Berkelium Bk III, IV Beryllium Be II Bismut / Wismut Bi III, V Blei (Plumbum) Pb II, IV Bohrium Bh * Bor B III Brom Br I, III, V, VII Cadmium Cd II Caesium / Cäsium Cs I Calcium Ca II Californium Cf III, IV Cer Ce III, IV Chlor Cl I, III, V, VII Chrom Cr 0, II, III, VI Cobalt Co 0, I, II, III Curium Cm III, IV Darmstadtium Ds * Dubnium Db * Dysprosium Dy III Einsteinium Es III Eisen (Ferrum) Fe 0, II, III, VI Erbium Er III Europium Eu II, III Fermium Fm III Fluor F I Francium Fr I Gadolinium Gd III Gallium Ga III Germanium Ge II, IV Gold (Aurum) Au I, III Hafnium Hf IV Hassium Hs * Helium He 0 Holmium Ho III Indium In III Iod I I, V, VII Iridium Ir 0, I, II, III, IV, VI Kalium K I Kohlenstoff (Carboneum) C II, IV Krypton Kr 0, II Kupfer (Cuprum) Cu I, II Lanthan La III Lawrencium Lr III Lithium Li I Lutetium Lu III Magnesium Mg II Mangan Mn 0, I, II, III, IV, VI VII Meitnerium Mt * Mendelevium Md II, III Molybdän Mo 0, II, III, IV, V, VI Natrium Na I Neodym Nd III Neon Ne 0 Neptunium Np III, IV, V, VI Nickel Ni 0, II, III Niob Nb III, V Nobelium No II, III Osmium Os 0, II, III, IV, VI, VIII Palladium Pd 0, II, IV Phosphor P III, V Platin Pt 0, II, IV Plutonium Pu III, IV, V, VI Polonium Po II, IV VI Praseodym Pr III, IV Promethium Pm III Protactinium Pa IV, V Quecksilber (Hydrargyrum) Hg I, II Radium Ra II Radon Rn 0, II Rhenium Re I, II, IV, VI, VII Rhodium Rh 0, I, II, III, IV, V Roentgenium Rg * Rubidium Rb I Ruthenium Ru 0, II, III, IV, VI, VIII Rutherfordium Rf IV Samarium Sm II, III Sauerstoff (Oxygenium) O II, I Scandium Sc III Schwefel (Sulfur) S II, IV, VI Seaborgium Sg * Selen Se II, IV, VI Silber (Argentum) Ag I, II Silicium Si II, IV Stickstoff (Nitrogenium) N II, III, IV, V Strontium Sr II Tantal Ta V Technetium Tc IV, VI, VII Tellur Te II, IV, VI Terbium Tb III, IV Thallium Tl I, III Thorium Th IV Thulium Tm II, III Titan Ti II, III, IV Ununbium Uub * Ununhexium Uuh * Ununoctium Uuo * Ununpentium Uup * Ununquadium Uuq * Ununseptium Uus * Ununtrium Uut * Uran U III, IV, V, VI Vanadium V 0, II, III, IV, V Wasserstoff (Hydrogenium) H I Wolfram W 0, II, III, IV, V, VI Xenon Xe 0, II, IV, VI Ytterbium Yb II, III Yttrium Y II, III Zink Zn II Zinn (Stannum) Sn II, IV Zirconium Zr IV *Die Wertigkeit(en) ist (sind) noch unbekannt / nicht gefunden. Literatur
- Alfred Dörrenbächer (Illustrationen v. Detlef Surrey): Duden-Schülerhilfen, Chemie 8. bis 10. Klasse, Chemische Verfahren und Gesetze richtig verstehen und anwenden. S. 45, 46, 110, 111. Bibliographisches Institut & F. A. Brockhaus AG, Mannheim 2006, 3., aktualisierte Auflage, ISBN 9783411059331
Siehe auch
Quellen & Weblinks
- Periodensystem mit Wertigkeiten
- Periodensystem mit Überblick über die Wertigkeiten
- Liste der Wertigkeiten von wichtigen chemischen Elementen in Mineralien
- Die Wertigkeit (allgemein)
Einzelnachweise
- ↑ Definition: Wertigkeit - Meyers Lexikon online. web.archive.org. Abgerufen am 2. April 2009.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Wertigkeit im Lexikon der Chemie, abgerufen 18. August 2008
- ↑ Universität Erlangen: Chemische Grundlagen - Elektronenkonfiguration und Wertigkeit
- ↑ Alfred Dörrenbächer: Duden-Schülerhilfen. Chemie 8. bis 10. Klasse, Chemische Verfahren und Gesetze richtig verstehen und anwenden. 3. Auflage, Bibliographisches Institut & F. A. Brockhaus AG, Mannheim 2006, , ISBN 978-341-1059-33-1. S. 45, 46, 110, 111
Wikimedia Foundation.
