- 2-Aminoiso-valeriansäure
-
Strukturformel 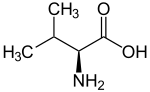
L-Valin (linke Abbildung) D-Valin (rechte Abbildung)Allgemeines Name Valin Andere Namen - L-Valin
- (S)-Valin
- D-Valin
- (R)-Valin
- 2-Amino-3-methyl-butansäure
- 2-Aminoisovaleriansäure
- Abkürzungen:
- Val (Dreibuchstabencode)
- V (Einbuchstabencode)
Summenformel C5H11NO2 CAS-Nummer - 72-18-4 (L-Enantiomer)
- 640-68-6 (D-Enantiomer)
PubChem 6287 ATC-Code V06[1]
DrugBank DB00161 Kurzbeschreibung weißer Feststoff Eigenschaften Molare Masse 117,15 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt 295–300 °C [2]
pKs-Wert pKCOOH: 2,29
pKNH2: 9,72[3]Löslichkeit gut in Wasser (88 g·l−1 bei 20 °C), nicht in Ethanol und Aceton
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Valin ist in seiner natürlichen L-Form eine essentielle proteinogene α-Aminosäure, die in geringen Mengen in allen wichtigen Proteinen vorkommt. Die Stoffbezeichnung leitet sich ab von lat. validus für kräftig und gesund. Isoliert wurde Valin erstmals 1901 durch Hermann Emil Fischer aus dem Casein, einem Milcheiweiß. Strukturell leitet sich Valin durch Substitution des α-Wasserstoffatoms durch eine Aminogruppe (–NH2) von der Isovaleriansäure ab. L-Isovalin und L-Norvalin sind Konstitutionsisomere.
Essentiell ist die Säure wahrscheinlich wg. der verzweigten Kohlenstoffkette, eine Struktur, die der tierische Stoffwechsel nicht aufbauen kann. Der menschliche Mindestbedarf liegt bei ca. 50 mg pro Tag und kg Körpergewicht. Im Protein der Kuhmilch ist Valin zu ca. 8 %, im Protein des Weizens zu ca. 3 % enthalten. Im menschlichen Organismus ist Valin wichtig für die Nerven- und Muskelfunktion. Ungenügende Zufuhr verursacht Hyperästhesie (Überempfindlichkeit) und Krämpfe.
In der alkoholischen Gärung wird Valin durch Hefeenzyme zu Isobutanol, einem Bestandteil des Fuselöls, vergoren (Aminosäuregärung). Spät geerntete Weintrauben haben einen signifikant höheren Aminosäuregehalt, auch Valingehalt.
Inhaltsverzeichnis
Darstellung und Gewinnung
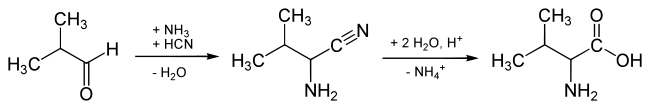
Die Darstellung von Valin kann durch die Strecker-Synthese erfolgen. Ausgangsprodukt ist Isobutanal (Iso-Butyraldehyd):
Bei der Strecker-Synthese entsteht DL-Valin. Zur Racematspaltung wird DL-Valin am Stickstoffatom acetyliert. Das so gebildete DL-N-Acetylvalin wird einer enzymatischen Racematspaltung unterworfen. Das Enzym L-Acetylase hydrolysiert dabei enantioselektiv die Amidbindung im L-N-Acetylvalin zu Essigsäure und L-Valin, während D-N-Acetylvalin unverändert bleibt.
L-Valin kann auch durch Fermentation, einem Verfahren der Biotechnologie, direkt erhalten werden. Die Ausgangsstoffe sind abhängig von den verwendeten Bakterienkulturen. So benötigt Bacillus lactofermentum Glucose, B. flavum Essigsäure und Corneybacterium acetoacephilum Ethanol als Quelle für den Gerüstkohlenstoff. Um die Ausbeute zu erhöhen und die Bildung unerwünschter Produkte zu unterbinden, handelt es sich meist um speziell gezüchtete (genetisch manipulierte oder selektierte) Kulturen.
Eigenschaften
Valin verfügt über eine lipophile Seitenkette. Der Oktanol-Wasser-Verteilungskoeffizient beträgt −2,26 (log KOW).[4] Der isoelektrische Punkt liegt bei 5,96[5], das van-der-Waals-Volumen bei 105. Valin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxylgruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert.
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Valin auch seine geringste Löslichkeit in Wasser hat.
Verwendung
Valin kann als Precursor (fertiger Baustein eines Produktmoleküles) die Ausbeute von Penicillin-bildenden Kulturen steigern.
Es ist Bestandteil von Energiedrinks und Infusionslösungen.
In der gezielten Herstellung von enantiomerenreinen Stoffen besitzt (S)-Valin eine praktische Bedeutung in der Chemie.[6][7]
Einzelnachweise
- ↑ a b Daten der Firma Merck vom 9. Dezember 2003.
- ↑ Daten der Firma Sigma Aldrich.
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart, 1991, ISBN 3-7776-0485-2, S. 823.
- ↑ C. Hansch; A. Leo; D. Hoekman: Exploring QSAR. Hydrophobic, electronic and steric constants ACS Professional Reference Book, American Chemical Society, Washington DC, 1995; ISBN 978-0-84122991-4.
- ↑ P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- ↑ Karlheinz Drauz, Axel Kleemann und Jürgen Martens: "Induktion von Asymmetrie durch Aminosäuren", in: Angewandte Chemie 1982, 94, 590–613; Angewandte Chemie – International Edition English 1982, 21, 584–608.
- ↑ Jürgen Martens: "Asymmetric Syntheses with Amino Acids", in: Topics in Current Chemistry / Fortschritte der Chemischen Forschung 1984, 125, 165–246.
Literatur
- Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, 20. Auflage, S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2.
- Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2.
- Jesse Philip Greenstein und Milton Winitz: Chemistry of Amino Acids, John Wiley & Sons, 1962, Bände 1 bis 3, ISBN 0-471-32637-2.
- Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: "Production and Utilization of Amino Acids", in: Angewandte Chemie International Edition in English 1978, 17, 176–183.
Weblinks
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.