- Methanogenese
-
Übergeordnet Anaerobe Atmung
Biosynthese der Alkane
Metabolismus des MethanUntergeordnet aus Acetat
aus CO2
aus Methanol
aus MethylaminenGene Ontology AmiGO QuickGO Unter Methanogenese (auch Methanbildung) versteht man die Bildung von Methan durch den Stoffwechsel von Lebewesen. Sie stellt die letzte Stufe des anaeroben Abbaus von Biomasse dar. Bisher sind nur Archaeen als methanbildende Lebewesen bekannt. Sie werden auch als Methanogene oder Methanbildner bezeichnet. In der obligat anaerob ablaufenden Methanogenese setzen die meisten Methanogenen Kohlenstoffdioxid in Methan um. Auch aus anderen einfachen C1-Verbindungen wie Ameisensäure, Methanol und Methylaminen wird es gebildet. Essigsäure wird durch Essigsäure-spaltende (acetoklastische) Methanbildner in Methan und Kohlenstoffdioxid umgewandelt. Bakterielle Gärungsprodukte wie Milchsäure, Propionsäure und Buttersäure können dagegen nicht als Substrate verwendet werden. Bei der Methanogenese handelt es sich um eine anaerobe Atmung.
Die Methanbildner nutzen die exergone (energiefreisetzende) Methanogenese als Energiequelle.[1]
Inhaltsverzeichnis
- 1 Vorkommen
- 2 Substratvielfalt
- 3 Biochemische Reaktionen
- 4 Energiegewinnung
- 5 Bedeutung
- 6 Evolution
- 7 Anwendung
- 8 Literatur
- 9 Einzelnachweise
- 10 Weblinks
- 11 Siehe auch
Vorkommen
→ siehe auch Methanbildner
Die Methanbildung kommt in der Natur ausschließlich in anaeroben Milieus vor, in denen ein Abbau von Biomasse stattfindet. Das können beispielsweise Sedimente von Seen und des Meeres, der Pansen von Rindern, der Darm von Termiten und Menschen, Reisfelder oder Sümpfe sein. In diesen Habitaten herrschen moderate (mesophile) Temperaturen. Die Methanogenese tritt aber auch in Umgebungen mit extrem hohen und niedrigen Temperaturen sowie bei hohen Salz- oder Säuregehalten auf, beispielsweise in geothermalen Systemen.[2] In allen Fällen müssen in diesen Habitaten die Konzentration von Sulfat, Nitrat, Mangan(IV)- und Eisen(III)-Ionen niedrig sein, da anderenfalls Bakterien diese Stoffe als externe Elektronenakzeptoren in einer anaeroben Atmung verwenden und in dieser Atmung die für Methanogene nutzbaren Elektronendonatoren verbrauchen. Die Redoxvorgänge mit diesen Elektronenakzeptoren laufen nämlich bevorzugt vor der Methanogenese ab und den Methanogenen wird dadurch ihre Energiequelle und damit ihre Lebensgrundlage entzogen.[3] Unter anaeroben Bedingungen ist Kohlenstoffdioxid, das Substrat der meisten Methanogenen, selbst selten limitierend, da es fortlaufend durch Vergärungsreaktionen durch vergesellschaftete Bakterien freigesetzt wird.[2]
Die Methanogenese wird von Archaeen betrieben, die alle zur Abteilung der Euryarchaeota zählen. Methanogene Archaeen finden sich in fünf Ordnungen: Methanopyrales, Methanobacteriales, Methanococcales, Methanomicrobiales und Methanosarcinales.[3] Hierbei ist Methanopyrales der stammesgeschichtlich älteste, Methanosarcinales dagegen der phylogenetisch jüngste Zweig. 2008 wurde eine sechste Ordnung („Methanocellales“ ) vorgeschlagen, da die im Boden von Reisfeldern vorkommenden Archaeen „Methanocella paludicola“ und „Methanocella arvoryzae“ eine Methanogenese aus Kohlenstoffdioxid und Wasserstoff betreiben.[4][5]
Methanopyrales, Methanobacteriales, Methanococcales zählt man zu den Klasse I-Methanogenen, Methanomicrobiales und Methanosarcinales sind Klasse II-Methanogene.[6]
Substratvielfalt
In vielen Habitaten sind Methanogene Endkonsumenten in der sogenannten „anaeroben Nahrungskette“.[7] In dieser Kette werden zunächst Biopolymere wie Proteine und insbesondere Polysaccharide wie Cellulose über Oligomere in Monomere (beispielsweise Aminosäuren und Kohlenhydrate) gespalten und ebenfalls Lipide werden in ihre Komponenten (beispielsweise Fettsäuren) abgebaut. Danach vergären Bakterien diese Spaltprodukte zu einfachen organischen Carbonsäuren (wie Formiat, Acetat, Propionat, Lactat und Succinat), zu Alkoholen (wie Ethanol, 2-Propanol und Butanol) und zu anderen niedermolekularen Verbindungen (H2, CO2 und Ketone). Syntrophe, acetogene Bakterien nutzen einen Teil dieser Verbindungen und setzen sie zu Acetat und C1-Verbindungen um. Im letzten Teil der anaeroben Nahrungskette, der Methanogenese, werden diese Verbindungen als Kohlenstoff-, Reduktans und Energiequelle verwendet, wobei meistens CO2 und CH4 freigesetzt werden.
- Die meisten Methanogenen betreiben die Methanogenese mit Kohlenstoffdioxid (CO2) als Substrat, bei der Wasserstoff (H2) als primäres Reduktionsmittel verwendet wird.[2] Man bezeichnet solche Methanogene als wasserstoffoxidierend oder hydrogenotroph. Zu den obligaten Hyrogenotrophen zählen die Methanopyrales, Methanobacteriales, Methanococcales und Methanomicrobiales, die nur H2 und CO2 oder Ameisensäure (HCOOH) als Substrate für die Methanogenese nutzen.[8][9] Eine Ausnahme unter den Methanomicrobiales ist Methanosphaera stadtmanae, die im menschlichen Verdauungstrakt vorkommt. Sie ist auf Methanol und Wasserstoff angewiesen, da sie nicht CO2 nutzen kann.[10] Modellorganismen unter den Hydrogenotrophen sind Methanothermobacter thermoautotrophicus und Methanocaldococcus jannaschii (ehemals Methanococcus jannaschii).
- Kohlenstoffmonoxid (CO) kann nur von wenigen Arten für die Methanogenese genutzt werden.[2] M. thermoautotrophicus und Methanosarcina barkeri bilden aus vier Molekülen CO drei Moleküle CO2 und ein Molekül Methan. Auch Methanosarcina acetivorans kann CO als Substrat verwenden, wobei parallel Acetat und Formiat gebildet werden.[11] Diese Art der Acetogenese in Methanogenen bezeichnet man als carboxidotrophe Acetogenese.[12]
- Die Methanosarcinales sind die vielseitigsten Methanogenen, sie können sehr unterschiedliche C1-Verbindungen für die Methanogenese verwenden. Neben CO2 + H2 nutzen viele Arten C1-Verbindungen, in denen der Kohlenstoff als Methylgruppe enthalten ist, wie Methanol, Methylamine (Mono-, Di-, Trimethylamin) und Methylthiole (Dimethylsulfid, Methanthiol).[7] Methanosarcinales können aber nicht Ameisensäure umsetzen.
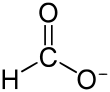
- Acetat (CH3COOH) ist die einzige C2-Verbindung, die für eine Methanogenese genutzt werden kann. Dazu sind – soweit bisher bekannt – nur die Gattungen Methanosaeta und Methanosarcina (Methanosarcinales) fähig. Man bezeichnet sie als acetoklastische Methanogene oder Acetoklaster. Bei dieser Art von Methanogenese wird Acetat in CO2 und CH4 gespalten.[2] Obwohl Acetat nur von wenigen Archaeen für eine Methanogenese genutzt wird, trägt das dabei entstehende Methan mit 66 % zur jährlichen Methanproduktion auf der Erde bei.[13] Damit ist Methanbildung der Acetoklaster die größte biogene Quelle.
Reaktion in der Methanogenese ΔG0’ [kJ/mol CH4][2] Organismus Kohlenstoffdioxid-Typ CO2 + 4 H2 → CH4 + 2 H2O −135 die meisten Methanogenen 4 HCOOH → CH4 + 3 CO2 + 2 H2O −130 viele hydrogenothrophe Methanogene CO2 + 4 Isopropanol → CH4 + 4 Aceton + 2 H2O −37 manche hydrogenothrophe Methanogene 4 CO + 2 H2O → CH4 + 3 CO2 −196 Methanothermobacter und Methanosarcina mit Methylverbindungen 4 CH3OH → 3 CH4 + CO2 + 2 H2O −105 Methanosarcina und andere methylothrophe Methanogene CH3OH + H2 → CH4 + H2O −113 Methanomicrococcus blatticola und Methanosphaera[14] 2 (CH3)2S + 2 H2O → 3 CH4 + CO2 + 2 H2S −49 manche methylothrophe Methanogene 4 CH3NH2 + 2 H2O → 3 CH4 + CO2 + 4 NH3 −75 manche methylothrophe Methanogene 2 (CH3)2NH + 2 H2O → 3 CH4 + CO2 + 2 NH3 −73 manche methylothrophe Methanogene 4 (CH3)3N + 6 H2O → 9 CH4 + 3 CO2 + 4 NH3 −74 manche methylothrophe Methanogene 4 CH3NH3Cl + 2 H2O → 3 CH4 + CO2 + 4 NH4Cl −74 manche methylothrophe Methanogene mit Acetat (Essigsäure) CH3COOH → CH4 + CO2 −33 Methanosarcina und Methanosaeta Biochemische Reaktionen
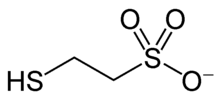
Bei der Reduktion von Carboxygruppen (-COOH) zu Methan und von Kohlenstoffdioxid zu Methan spielen Enzyme mit charakteristischen Coenzymen eine Rolle. Diese kommen nur bei Methanbildnern vor. Insbesondere sind dies die Coenzyme Tetrahydromethanopterin, Coenzym M, Coenzym F430 und F420, sowie spezielle Elektronen- bzw. Wasserstoffüberträger.
Zentraler Weg der Methanogenese aus Kohlenstoffdioxid und Wasserstoff
Bedeutung der Cytochrome
Methanogene der Ordnungen Methanosarcinales enthalten Cytochrome, während man diese unter den anderen vier Ordnungen nicht gefunden hat. Dies hat neben physiologische auch stoffwechselspezifische Auswirkungen darauf, wie methanogene Archaeen Kohlenstoffdioxid und Wasserstoff zu Methan verstoffwechseln.[3]
- Methanogene mit Cytochromen enthalten Methanophenazin. Es ist der universelle Elektronenüberträger in der Membran dieser Methanogenen und ersetzt dort Chinon, das nur in geringen Konzentrationen vorkommt und in anderen Organismen für den Transport von Elektronen in der Atmungskette essentiell ist. Wachstum auf CO2 + H2 wird nur von manchen Methanosarcinales durchgeführt, viele greifen auf Acetat und methylierten Verbindungen zurück – Ameisensäure können diese nicht nutzen (vgl. weiter oben). Falls sie CO2 + H2 verwerten, muss der H2-Partialdruck über 10 Pa liegen, die Teilungsrate liegt bei über 10 Stunden pro Teilung. Bisher wurden unter Methanogenen mit Cytochromen keine Vertreter entdeckt, die unter hyperthermophilen Bedingungen wachsen.
- Bei Methanogenen ohne Cytochromen fehlt dagegen Methanophenazin. Im Gegensatz zu den Methanosarcinales wachsen jene Methanogene mit CO2 + H2 bzw. Format und können weder methylierte Verbindungen noch Acetat verwerten. Eine Ausnahme bildet der im Menschen verkommene M. stadtmanae, der Methanol und Wasserstoff zum Wachstum benötigt. Ihnen genügt ein H2-Partialdruck von unter 10 Pa, die Verdopplungszeit liegt bei unter 1 Stunde pro Verdopplung. Unter den Methanogenen ohne Cytochromen findet man viele hyperthermophile Arten.
Die Unterschiede in der Biochemie der Methanogenese bei Archaeen mit bzw. ohne Cytochrome werden im folgenden Abschnitt mitberücksichtigt.
Reduktion von Kohlenstoffdioxid zu Methan
 Biochemischer Weg der archaeellen Methanogenese aus Kohlenstoffdioxid und Wasserstoff H2, gekoppelt mit ADP-Phosphorylierung. Abkürzungen: MF - Methanofuran, THM - Tetrahydromethanopterin, CoM - Coenzym M, CoB - Coenzym B, B12 - B12-Cofaktor, Ni - Hydrogenase mit Nickel-Cofaktor, Mo - Dehydrogenase mit Molybdän-Cofaktor, F420 und F430 - Elektronenüberträger Faktor 420 bzw. 430
Biochemischer Weg der archaeellen Methanogenese aus Kohlenstoffdioxid und Wasserstoff H2, gekoppelt mit ADP-Phosphorylierung. Abkürzungen: MF - Methanofuran, THM - Tetrahydromethanopterin, CoM - Coenzym M, CoB - Coenzym B, B12 - B12-Cofaktor, Ni - Hydrogenase mit Nickel-Cofaktor, Mo - Dehydrogenase mit Molybdän-Cofaktor, F420 und F430 - Elektronenüberträger Faktor 420 bzw. 430
Damit Kohlenstoffdioxid als Substrat genutzt werden kann, wird es zunächst an die eine reaktive Aminogruppe des Coenzyms Methanfuran (MFR) geknüpft. Dabei entsteht N-Carboxymethanofuran, ein instabiles Zwischenprodukt, das dann zum ersten stabilen Intermediat, dem N-Formylmethanofuran (CHO-MFR), reduziert wird. Eine Formylmethanofuran-Dehydrogenase (MFR-Dehydrogenase, EC 1.2.99.5) katalysiert diese beiden Reaktionen und benötigt ein Reduktionsmittel in Form von reduziertem Ferredoxin. Die für diese Reduktion notwendigen Reduktionsmittel stammen dabei entweder aus Wasserstoff, die eine Hydrogenase auf oxidiertes Ferredoxin überträgt, oder die Elektronen gelangen aus der Oxidation von Format, dem Anion der Ameisensäure, zu Kohlenstoffdioxid, was eine Format-Dehydrogenase katalysiert. Da die Bildung von CHO-MFR endergon ist, wird die nötige Energie aus dem elektrochemischen Ionengradienten der Membran angezapft.[9]
Die an MFR gebundene Formylgruppe (–CHO) wird auf Tetrahydromethanopterin (H4MPT) übertragen, dass strukturell dem Tetrahydrofolat (THF) anderer Organismen ähnelt. Anschließend wird die an H4MPT gebundene Formylgruppe schrittweise über N5,N10-Methenyl-H4MPT und N5,N10-Methylen-H4MPT zu Methyl-H4MPT (–CH3) reduziert. Dieser Prozess ist vollständig reversibel und kann auch in entgegengesetzter Richtung ablaufen. Reduktionsmittel ist hier jeweils F420H2. Eine cytosolische Methenyl-H4MPT-Cyclohydrolase (EC 3.5.4.27), Methylen-H4MPT-Dehydrogenase (EC 1.5.99.9) bzw. eine (F420-abhängige) Methylen-Reduktase (EC 1.5.99.11) katalysieren diese Reaktionen. In Methanosarcinaarten liegt Tetrahydosarcinapterin (H4SPT) vor, das dem H4MPT sehr ähnlich ist.[9]
Neben der F420-abhängigen Methylen-Reduktase nutzen manche obligaten Hydrogenotrophen auch Wasserstoff direkt. Diese Methylen-Reduktase (EC 1.12.98.2) enthält im Gegensatz zu anderen Hydrogenasen weder Eisen-Schwefel- noch Nickel-Eisen-Cluster, sie ist „metallfrei“.
Das universelle Reduktionsmittel F420H2 wird nach Oxidation durch eine Eisen-Nickel enthaltende F420-reduzierende Hydrogenase (EC 1.12.98.1) regeneriert, welche Wasserstoff benötigt.
Die Methylgruppe aus Methyl-H4MPT wird dann auf das einfachste Coenzym, Coenzym M (CoM), übertragen. Es entsteht Methyl-CoM, bei der die Methylgruppe mit dem Sulfidrest des Coenzyms verknüpft ist (H3C–S-CoM). Der Transfer erfolgt über eine membrangebundene Methyltransferase (EC 2.1.1.86). Da diese Reaktion exergon ist (ΔG0'= −29 kJ/mol[9]), wird die freiwerdende Energie genutzt, um etwa zwei Natriumionen pro Umsetzung aus der Zelle zu exportieren. Dadurch bildet sich ein elektrochemisch wirkender Natriumionkonzentrationsunterschied.
Methyl-CoM reagiert schließlich mit Coenzym B (CoB) zu einem gemischten Disulfid, CoM-S–S-CoB, und Methan. Dies ist die Schlüsselreaktion der Methanogenese. Das gemischte Disulfid bezeichnet man auch als Heterodisulfid. Diese Reaktion wird von einer Methyl-CoM-Reduktase (EC 2.8.4.1) katalysiert, die den Cofaktor F430 enthält.
In der Bilanz wird damit ein Molekül Kohlenstoffdioxid umgesetzt gemäß:
Regeneration der Coenzyme M und B
Die Coenzyme M und B müssen für einen erneuten Durchgang regeneriert werden. Dies erfolgt durch eine Oxidation von CoM-S–S-CoB zu CoM und CoB und wird durch eine Heterodisulfidreduktase katalysiert. Die für diese Reaktion benötigten Elektronen entstammen entweder aus Wasserstoff, reduziertem Ferredoxin oder F420H2. Bei der Reaktion wird Energie freigesetzt (ΔG0'= −39 kJ·mol−1).
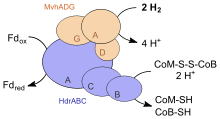
In Methanogenen mit Cytochromen wird CoM-S–S-CoB an einer membranständigen Heterodisulfidreduktase reduziert. In obligaten kohlenstoffreduzierenden Methanogenen ist dies ein Komplex mit drei Untereinheiten (HdrABC), in Methanosarcina-Arten ist er aus zwei Untereinheiten aufgebaut (HdrDE).[15] Für die Reduktion werden Elektronen benötigt. Entweder wird Wasserstoff an einer membrangebundenen Hydrogenase oxidiert, die unter anderem Häm b als prosthetische Gruppe enthält (Vho). Parallel werden Protonen nach außen transportiert. Der Hydrogenasekomplex wurde beispielsweise im Süßwasser lebenden Ms. barkeri identifiziert. Ms. acetivorans, ein im Salzwasser vorkommenes Archaeon, oxidiert statt Wasserstoff Ferredoxin an einen ebenfalls membranständigen Komplex (Ma-Rnf), der u. a. Cytochrom c als prosthetische Gruppe aufweist. Dabei werden Natriumionen nach außen gebracht. Falls Ms. acetivorans ausschießlich auf Kohlenmonoxid wächst, oxidiert ein membranständiger F420-Dehydrogenasekomplex (Fpo) reduziertes F420, bei dem Vorgang werden Protonen exporiert. Die Übertragung der Elektronen vom Hydrogenase- bzw. Dehydrogenasekomplex zur Heterodisulfidreduktase wird durch Methanophenazin vermittelt. Die Reduktion von CoM-S–S-CoB ist exergon, daher werden durch diesen Prozess ebenfalls gleichzeitig Protonen nach außen transportiert, so dass insgesamt eine protonenmotorische Kraft aufgebaut wird. Diese nutzen die Methanogenen zum Aufbau von ATP (vgl. Abschnitt unten).
Dagegen besitzen Methanogene ohne Cytochrome weder Methanophenazin noch eine membrangebundene Heterodisulfidreduktase.[16] Für die Oxidation des Heterodisulfides CoM-S–S-CoB nutzen sie eine cytosolische Hydrogenase/Reduktase (EC 1.8.98.1), die Wasserstoff benötigt und die freiwerdende Energie zur Reduktion von Ferredoxin koppelt. Jedoch liegt kein Mechanismus zugrunde, bei der die freiwerdende Energie zum Aufbau einer protonenmotorischen Kraft gekoppelt werden könnte – die Hetereosulfidreduktase liegt nicht membrangebunden vor. Daher können Methanogene ohne Cytochrome nur den Natriumionenkonzentrationsunterschied nutzen, der bei der Methyltransferasereaktion aufgebaut wird.
Umsetzung von Format zu Methan
Format ist das Anion der Ameisensäure und kann von etwa der Hälfte aller Methanogenen als Substrat genutzt werden.[7] Im Gegensatz zu Kohlenstoffdioxid wird es aber nicht direkt auf MFR übertragen, sondern zunächst durch eine Format-Dehydrogenase zu Kohlenstoffdioxid oxidiert. Das Enzym enthält Molybdän und Eisen-Schwefel-Cluster, es wurde bereits aus methanogenen Archaeen isoliert (beispielsweise aus Methanobacterium formicicium und Mc. vannielii). Bei der katalysierten Reaktion wird gleichzeitig F420 zu F420H2 reduziert. Kohlenstoffdioxid wird dann, wie weiter oben beschrieben, zu Methan reduziert.
Für die schrittweise Umsetzung von Kohlenstoffdioxid zu Methan werden an vier Stellen Reduktionsmittel benötigt. An zwei Stellen werden sie direkt in Form von F420H2 bei der stufenweisen Reduktion von Methenyl-H4MPT zu Methyl-H4MPT verbraucht. An den anderen beiden wird Wasserstoff für die cytosolische Heterodisulfidreduktase benötigt, das die Oxidation von CoM-S–S-CoB zu CoM und CoB und die Bildung von reduziertem Ferredoxin koppelt.[16] Wasserstoff kann entweder durch die F420-reduzierende Hydrogenase erzeugt werden oder alternativ durch eine Nickel-freie Hydrogenase.[17] Das bei der Heterodisulfidreduktase-Reaktion gebildete reduzierte Ferredoxin wird für die MFR-Dehydrogenase in der Eingangsreaktion benötigt.
Daher sind insgesamt vier Moleküle F420H2 erforderlich, die bei den Oxidationen von vier Molekülen Ameisensäure zu Kohlenstoffdioxid entstehen. Drei Moleküle Kohlenstoffdioxid werden freigesetzt. In der Bilanz werden damit vier Moleküle Ameisensäure umgesetzt gemäß:
Methanogenese mit methylierten C1-Verbindungen
Methylierte C1-Verbindungen wie Methylamin (CH3NH2) oder Methanol (CH3OH) kommen insbesondere in Meerwasser oder Brackwasser vor und sind anaerobe Abbauprodukte zellulärer Bestandteile bestimmter Pflanzen und des Phytoplanktons.[7]
Da der Kohlenstoff in der Methylgruppe bereits stärker reduziert ist als in CO2, müssen diese Verbindungen nicht den gesamten Weg wie der bei Kohlenstoffdioxid durchlaufen. Sie werden daher im unteren Drittel des Weges in der Methanogenese in Form von CH3–CoM eingespeist. Neben dem direkten Weg zu Methan (in der Abbildung nach „unten“) werden methylierte Verbindungen auch zu Kohlenstoffdioxid oxidiert (in der Abbildung nach „oben“). Es gibt also einen oxidativen und einen reduktiven Zweig. Das liegt daran, dass die Elektronen für den reduktiven Zweig aus der Oxidation von Methylgruppe zu Kohlenstoffdioxid entnommen werden müssen, da die Nutzung von Wasserstoff aus der Umgebung (als Elektronenquelle) häufig nicht möglich ist.
Ein Molekül Methanol wird beispielsweise zu Kohlenstoffdioxid oxidiert, so dass mit Hilfe der freigesetzten Reduktionsäquivalente drei Moleküle zu Methan reduziert werden. Diese Disproportionierung erfolgt z. B. gemäß:
Diese beiden Zweige treten auch bei der Umsetzung von Methylaminen durch Methanosarcina auf. Methylamine werden zu Methan, CO2 und Ammoniak (NH3) verstoffwechselt, wobei drei der Methylgruppen zu Methan reduziert und eine zu Kohlenstoffdioxid oxidiert wird.Hierbei wird die Methylgruppe des Substrates auf CoM übertragen und schließlich – wie oben beschrieben – zu Methan reduziert. Den Transfer auf CoM katalysieren cytosolische Methyltransferasen, die für die Reaktion Pyrrolysin als 22. Aminosäure benötigen und ein Corrinoid als prosthetische Gruppe enthalten.
Im oxidativen Zweig wird die Methylgruppe auf H4MPT durch eine membrangebundene Methyl-H4MPT-CoM-Methyltransferase übertragen. Da diese Reaktion Energie verbraucht (endergon ist), wird hierfür der elektrochemische Natriumionengradient angezapft. Methyl-H4MPT wird dann, in umgekehrter Reihenfolge wie oben beschrieben, zu Formyl-H4MPT oxidiert, wobei gleichzeitig F420 reduziert wird. Die Formylgruppe wird dann an MFR gekoppelt und schließlich durch die Formyl-Dehydrogenase zu Kohlenstoffdioxid oxidiert. Formal entsprechen also die Reaktionen des oxidativen Zweiges der umgekehrten Verstoffwechslung von Kohlenstoffdioxid zu CH3-CoM.
Beispielsweise werden vier Molekülen Methylamin umgesetzt zu:
Allgemein werden methylierte C1-Verbindungen abgebaut gemäß:
(mit R = –SH, –OH, –NH2, –NHCH3, –N(CH3)2, –N(CH3)3+)
Spaltung von Acetat zu Methan und Kohlenstoffdioxid
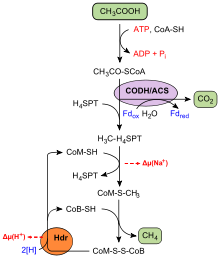 Übersicht über die acetoklastische Methanogenese am Beispiel von Methanosarcina. Bei dem Vorgang wird Protonen- und Natriumionen-Konzentrationsunterschied aufgebaut, der zur ATP-Synthese angezapft wird. CODH/ACS = Kohlenmonoxid-Dehydrogenase/Acetyl-CoA-Synthasekomplex; Hdr = membrangebundener Heterodisulfidreduktasekomplex.
Übersicht über die acetoklastische Methanogenese am Beispiel von Methanosarcina. Bei dem Vorgang wird Protonen- und Natriumionen-Konzentrationsunterschied aufgebaut, der zur ATP-Synthese angezapft wird. CODH/ACS = Kohlenmonoxid-Dehydrogenase/Acetyl-CoA-Synthasekomplex; Hdr = membrangebundener Heterodisulfidreduktasekomplex.
Acetat (CH3COOH) ist die einzige C2-Verbindung für die Metanogenese, die nur Vertreter der Gattungen Methanosaeta und Methanosarcina umsetzen können. Im Vergleich zu allen anderen Methanbildnern stammt indes der überwiegend größere Teil an Methan weltweit aus der Spaltung von Acetat.[7]
Um als Substrat für die Methanogenese genutzt zu werden, muss Acetat zunächst „aktiviert“ werden. Dies erfolgt dadurch, dass es an Coenzym A verknüpft wird, so dass Acetyl-CoA entsteht. Hierbei wurden zwei Stoffwechselwege identifiziert:
- Entweder geschieht die Aktivierung direkt durch die Acetyl-CoA-Synthetase (EC 6.2.1.1), bei dem Vorgang wird ein Molekül ATP zu AMP und Pyrophosphat (PPi) gespalten. Die Acetyl-CoA-Synthetase findet man in obligat acetotrophen Methanogenen der Gattung Methanosaeta.
- Alternativ erfolgt der Prozess schrittweise: Acetat wird durch eine Acetatkinase (EC 2.7.2.1) mittels ATP zunächst phosphoryliert, dabei entsteht Acetylphosphat. Dieses reagiert mit Coenzym A zu Acetyl-CoA. Eine Phosphotransacetylase (EC 2.3.1.8) katalysiert die zweite Reaktion.
Acetyl-CoA (CH3-CO-SCoA) wird für den weiteren Verlauf in drei Bestandteile gespalten: Coenzym A (HS-CoA), die Methylgruppe (–CH3) und die Carboxygruppe (–CO). Diese Reaktion findet im CO-Dehydrogenase/Acetyl-CoA-Synthase-Komplex (kurz CODH/ACS) statt. Der Komplex transferiert die Methylgruppe auf H4MPT, das dann wie weiter oben beschrieben im zentralen Weg zu Methan umgesetzt wird. CO wird enzymgebunden zu CO2 oxidiert, die dabei freiwerdenden Elektronen gelangen auf Ferredoxin, das für die Regenerierung von Coenzym B und M benötigt wird. Die Spaltung von Acetyl-CoA in drei Bestandteile entspricht formal der Umkehrung des reduktiven CoA-Weges, bei der Acetyl-CoA gebildet wird. Aus einem Molekül Acetat wird somit ein Molekül Kohlenstoffdioxid sowie ein Molekül Methan gebildet, gemäß:
Energiegewinnung
ATP-Synthese
Im Zuge der Methanogenese wird sowohl ein Protonen-, als auch ein Natriumionen-Konzentrationsunterschied erzeugt (ΔµH+, ΔµNa+), was gleichzeitig zu einer Energetisierung der Zellmembran führt.[9] Dabei sind Methanogene die einzigen Organismen, die diese beiden Konzentrationsunterschiede parallel aufbauen. Wie bei der anaeroben oder aeroben Atmung wird die Energie beider Konzentrationsunterschiede zum Aufbau von ATP durch eine ATP-Synthase genutzt.
Archaeen besitzen ATP-Synthase des Typs A1AO, Bakterien, Mitochondrien und Chloroplasten die F1FO-ATP-Synthase und Eukaryoten die vom Typ V1VO. Letztere hydrolysieren ATP zum Aufbau eines Ionengradienten.[7] Methanogene nutzen eine A1AO-ATP-Synthase, obwohl in Ms. barkeri und Ms. acetivorans im Genom auch Gene für eine bakterielle F1FO-ATP-Synthase entdeckt wurden. Jedoch ist es nicht einmal sicher, ob diese auch abgelesen werden und überhaupt funktionell vollständig sind.[9] Wahrscheinlich sind sie durch horizontalen Gentransfer in das Genom jener Archaeen gelangt.
Ob die A1AO-ATP-Synthase in methanogenen Archaeen sowohl Protonen als auch Natriumionen nutzt, ist noch nicht eindeutig geklärt. Durch das Vorhandensein eines Na+/H+-Antiporters kann aber der elektrochemische Natriumionen-Konzentrationsunterschied in eine protonenmotorische Kraft umgewandelt werden. So hat man im Genom von Ms. mazei drei dieser Transporter identifiziert.
Die genaue Struktur der ATP-Synthase ist noch Gegenstand der Forschung. A1AO-ATP-Synthasen ähneln zwar eukaryotischen des Typs V1VO, sind aber funktionell anders – sie erzeugen ATP. Die meisten Archaeen haben einen Rotor von 12 ionentranslozierenden Gruppen und eine katalytische Domäne mit drei Bindestellen, so dass man berechnet hat, dass vier Protonen für die Synthese eines Moleküls ATP notwendig sind. Als Ausnahme gilt die ATP-Synthase in Mc. janaschii und Mc. maripaludis, bei denen das Rotorelement nur über 8 ionentranslozierende Gruppen verfügt. Damit genügen 2,6 Protonen für die Synthese eines Moleküls ATP.
Energieausbeute
Die Reduktion von Kohlenstoffdioxid zu Methan durch Wasserstoff ist exergon (energiefreisetzend). Unter Standardbedingungen bei pH 7 beträgt die Änderung der Freien Energie (Gibbs-Energie) ΔG0’ je nach Literaturangabe −130[8], −131[9][3][12] oder −135[2] kJ/mol CH4. Unter solchen Bedingungen würden in der Methanogenese je Molekül gebildeten Methans drei Moleküle ATP aus ADP und Pi gebildet werden können. Die ΔG0’-Werte bei den anderen methanogenen Reaktionen sind in obiger Tabelle aufgeführt.
Für die Berechnung von ΔG0’ werden – neben einer Temperatur von 25 °C und einem pH-Wert von 7 – Konzentrationen der gelösten Gase im Gleichgewicht mit Gasdrücken von 105 Pa vorausgesetzt.[3] Dies entspricht jedoch nicht den natürlichen Bedingungen, denn solche hohen Gaskonzentrationen kommen in den Habitaten weder vor, noch könnten sie in der Zelle aufrechterhalten werden. Damit fällt die Energieausbeute unter natürlichen Bedingungen niedriger aus.
In den meisten Habitaten herrscht ein H2-Gasdruck von etwa 1–10 Pa vor.[3] Unter diesen Bedingungen und pH=7 liegt die Änderung der Freien Energie (ΔG) bei etwa −17 bis −40 kJ/mol Methan, womit weniger als durchschnittlich ein Molekül ATP pro erzeugtem Molekül Methan gebildet werden kann. Außerdem spielen für die Berechnung von ΔG der pH-Wert, der vorherrschende Druck und auch die Temperatur eine Rolle. So fällt die Änderung der Freien Energie bei der Reduktion von Kohlenstoffdioxid zu Methan durch Wasserstoff unter Standardbedingungen (25 °C) von −131 kJ/mol auf −100 kJ/mol, wenn eine Temperatur von 100 °C vorliegt.[3]
Auch bei der Verwendung anderer C1-Verbindungen ist ΔG' gering, so dass viele Methanogene knapp am thermodynamischen Limit wachsen.[9]
Bedeutung
Die Methanogenese ist ein zentraler Bestandteil des Kohlenstoffzyklus der Erde, da die entstehenden Abbauprodukte, Methan und ggf. Kohlenstoffdioxid, wieder in diesen Kreislauf gelangen. Da diese Gase, insbesondere Methan, wirksame Treibhausgase sind, hat die Methanogenese auch bei der Vermeidung der globale Erwärmung an Bedeutung gewonnen.[9] Vermutlich spielt die biogene Methanproduktion auch eine Rolle bei der Entstehung von Methanhydrat, dessen wirtschaftliche Nutzung von Interesse ist.
Eine wichtige Bedeutung hat die Methanogenese im Ablauf und Endglied der anaeroben Nahrungskette, da sie das Wachstum viele synotrophen Bakterien überhaupt erst ermöglicht. Diese sekundären Gärer gewinnen ihre Energie aus der Umsetzung von Lactat, Propionat, Butyrat und einfachen organischen Verbindungen, bei diesen Prozessen entsteht neben Kohlenstoffdioxid und Acetat auch Wasserstoff. Aus thermodynamischen Gründen sind jedoch diese Vergärungsreaktionen nur dann möglich, wenn der dabei entstehende Wasserstoff rasch wieder verbraucht wird und der H2-Partialdruck nicht über 100 Pa ansteigt. Das wird durch in enger Nachbarschaft wachsende Methanogene gewährleistet, die diesen Wasserstoff für die Methanogenese benötigen. Der Transfer von Wasserstoff zwischen syntrophen Bakterien und den Archaeen, also zwischen verschiedenen Spezies, bezeichnet man auch als Interspezies-Wasserstofftransfer.[18][2]
Evolution
Durch genomische Analysen nimmt man an, dass sich die Methanogenese früh in Euryarchaeota und erst nach Abspaltung der Thermococcales etabliert hatte.[6] Dies wird dadurch untermauert, dass alle Methanogenen die gleichen homologen Enzyme und Cofaktoren für den zentralen methanogenen Stoffwechselweg teilen. Darüber hinaus ist die Methanogenese in der Evolution wahrscheinlich nur einmal aufgetreten, da sich ein horizontaler Gentransfer (HGT) zwischen den Methanogenen nicht nachweisen lässt. Zwischen den Ordnungen Methanopyrales, Methanobacteriales, Methanococcales (Klasse I-Methanogene) sowie Methanomicrobiales und Methanosarcinales (Klasse II-Methanogene) liegen noch Ordnungen, die keine Methanogenese durchführen können, z. B. die Thermoplasmatales, Archaeoglobales und Halobacteriales. Zwar können beispielsweise in A. fulgidus noch Enzyme für die ersten Schritte der Methanogenese nachgewiesen werden. Dem Archaeon fehlen aber Enzyme für die letzten beiden Schritte, so auch für die Coenzym M-Reduktase. Wahrscheinlich haben die Archaeen in diesen drei Ordnungen die Fähigkeit zur Methanogenese im Laufe der Evolution unabhängig voneinander verloren.
Warum recht früh und „plötzlich“ die Methanogenese in Euryarchaeota aufgetreten ist, bleibt noch Gegenstand der Forschung. Über die Entstehung der Methanogenese gibt es verschiedene Theorien. Eine besagt ihr Ursprung möglicherweise in der Oxidation von Methan liegt, also dem umgekehrten Stoffwechselweg. Methanotrophe Organismen oxidieren Methan zu Kohlenstoffdioxid, wobei dies in Bakterien aerob und Archaeen anaerob geschieht. Andererseits vermutet man, dass die methanotrophen Archaeen aus methanogenen Archaeen hervorgegangen sind. Infolgedessen könnte die Methanogenese, die anaerobe Methanotrophie der Archaeen und die aerobe Methanotrophie der Bakterien aus einem gemeinsamen Stoffwechselweg hervorgegangen sein, der im letzten gemeinsamen Vorfahren (MCRA, engl. für most recent common ancestor) ursprünglich zur Entgiftung von Formaldehyd diente.
Manche Archaeen betreiben Methanogenese in Umgebungen extremen Salz- und Säuregehaltes sowie hoher Temperaturen. Da dieses Umweltbedingungen vermutlich auch nach der Entstehung der Erde vorgeherrscht haben, werden methanogene Archaeen zu den ersten Lebensformen gezählt.[9] Daher geht eine andere Theorie davon aus, dass der letzte gemeinsame Vorfahre der Archaeen selbst ein methanogener Organismus war.[6] Demzufolge müsste aber die Fähigkeit zur Methanogenese sowohl in allen Crenarchaeota als auch in allen anderen nicht-methanogenen Linien unabhängig voneinander verloren gegangen sein. Dies ist jedoch recht unwahrscheinlich.[13]
Eine neue Theorie betrachtet die Rolle Pyrrolysins (Pyl) im Methyl-Corrinoid-Weg der Methanosarcinales, durch den Methylamine in die Methanogenese eintreten können.[13] Die Methylgruppe dieser Methylamine wird durch eine spezifische Methyltransferase auf ein Corrinoid-enthaltenes Protein übertragen (vgl. Abschnitt oben). Methyltransferasen enthalten die 22. Aminosäure Pyrrolysin im katalytisch aktiven Zentrum. Pyl wurde so gut wie in keinem anderen Enzym nachgewiesen. Da die gesamte Pyl-Maschinerie stammesgeschichtlich als sehr alt gilt, vermutet man, dass diese durch horizontalen Gentransfer aus vermutlich mehreren Donorlinien stammt, die entweder inzwischen ausgestorben sind oder noch nicht entdeckt wurden. Dies setzt aber auch voraus, dass die Donorlinie, aus der die Pyl-Maschinerie stammt, bereits einen gewissen Grad an Diversität zu dem Zeitpunkt erreicht hatte, als noch ein gemeinsamer Vorfahre unserer drei Domänen existierte.
Nur in Methanosarcinales wurden Cytochrome gefunden. Sie verfügen über ein breiteres Substratspektrum als Methanogene ohne Cytochrome, sie nutzen beispielsweise Acetat. Man geht davon aus, dass die Methanogenese auf Acetat erst spät evoluiert ist. Bei Wachstum auf Kohlenstoffdioxid/Wasserstoff benötigen Methanosarcinales hohe H2-Konzentrationen, so dass sie bei geringeren Gasdrücken immer von Methanogenen ohne Cytochrome übervorteilt werden. Dies führte im Laufe der Evolution dazu, dass manche Methanosarcinales, wie beispielsweise Ms. acetivorans, Methanolobus tindarius oder Methanothrix soehngenii, die Fähigkeit verloren haben, Kohlenstoffdioxid als Substrat unter Mitverwendung von Wasserstoff zu nutzen.[3]
Anwendung
Methan enthält noch einen großen Teil der Energie, die im Ausgangsprodukt Biomasse gespeichert war. Das macht man sich in verschiedenen technischen Anwendungen zu Nutze. So wird in Fermentern von Biogasanlagen, Faultürmen von Klärwerken und in Deponiekörpern die Methanbildung zur Erzeugung von Faulgasen (Biogas, Klärgas, Deponiegas) verwendet. Die dabei eingesetzte Biomasse wäre mit anderen Verfahren nicht oder nur schwierig energetisch nutzbar.
Die Nutzung des Methans in technischen Anwendungen, wie z. B. einem an eine Biogasanlage angeschlossenes Blockheizkraftwerk (BHKW), erfolgt durch Oxidation mit Sauerstoff:
Literatur
- Lexikon der Biologie. Band 9, Spektrum Akademischer Verlag, Heidelberg 2002, ISBN 3-8274-0334-0.
- Georg Fuchs (Hrsg.): Allgemeine Mikrobiologie, begründet von Hans-Günter Schlegel, 8. Auflage. Georg Thieme Verlag, Stuttgart, New York 2007, ISBN 978-3-13-444608-1.
- Michael T. Madigan, John M. Martinko, Paul V. Dunlap, David P. Clark: Brock – Biology of Microorganisms, 12. Auflage. Pearson, San Francisco u. a. O. 2009, ISBN 0-321-53615-0.
- Rudolf K. Thauer, Anne Kristin Kaster, Meike Goenrich, Michael Schick, Takeshi Hiromoto, Seigo Shima: Hydrogenases from methanogenic archaea, nickel, a novel cofactor, and H2 storage. In: Annual Review of Biochemistry. Bd. 79, 2010, S. 507–536, PMID 20235826, doi:10.1146/annurev.biochem.030508.152103.
- G. Fournier: Horizontal gene transfer and the evolution of methanogenic pathways. In: Methods Mol Biol. 532, 2009, S. 163–179, PMID 19271184; doi:10.1007/978-1-60327-853-9.
- Rudolf K. Thauer, Anne Kristin Kaster, Henning Seedorf, Wolfgang Buckel, Reiner Hedderich: Methanogenic archaea: ecologically relevant differences in energy conservation. In: Nature Reviews Microbiology. Bd. 6, Nr.8, 2008, S. 579–591, PMID 18587410; doi:10.1038/nrmicro1931.
- U. Deppenmeier, V. Müller: Life close to the thermodynamic limit: how methanogenic archaea conserve energy. In: Results Probl Cell Differ. Bd. 45, 2008, S. 123–152, PMID 17713742; doi:10.1007/400_2006_026.
- Ferry, JG. (2010): How to make a living by exhaling methane. In: Annu Rev Microbiol. 64; 453–473; PMID 20528692; doi:10.1146/annurev.micro.112408.134051
Einzelnachweise
- ↑ Michael T. Madigan, John M. Martinko: Brock – Mikrobiologie, 11. überarbeitete Auflage, Pearson Studium, München 2006, ISBN 3-8273-7187-2 – Übersetzung von Brock – Biology of microorganisms 11. ed. ins Deutsche
- ↑ a b c d e f g h Liu, Y. und Whitman, WB. (2008): Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea. In: Ann N Y Acad Sci. 1125; 171–189; PMID 18378594; doi:10.1196/annals.1419.019
- ↑ a b c d e f g h Rudolf K. Thauer, Anne Kristin Kaster, Henning Seedorf, Wolfgang Buckel, Reiner Hedderich: Methanogenic archaea: ecologically relevant differences in energy conservation. In: Nature Reviews Microbiology. Bd. 6, Nr.8, 2008, S. 579–591, PMID 18587410; doi:10.1038/nrmicro1931.
- ↑ Sakai, S. et al. (2008): Methanocella paludicola gen. nov., sp. nov., a methane-producing archaeon, the first isolate of the lineage 'Rice Cluster I', and proposal of the new archaeal order Methanocellales ord. nov. In: Int J Syst Evol Microbiol. 58(Pt 4); 929–936; PMID 18398197; PDF (freier Volltextzugriff, engl.)
- ↑ Sakai, S. et al. (2010): Methanocella arvoryzae sp. nov., a hydrogenotrophic methanogen isolated from rice field soil. In: Int J Syst Evol Microbiol 60(Pt 12); 2918–2923; PMID 20097796; doi:10.1099/ijs.0.020883-0
- ↑ a b c Gribaldo, S. und Brochier-Armanet, C. (2006): The origin and evolution of Archaea: a state of the art. In: Philos Trans R Soc Lond B Biol Sci. 361(1470); 1007–1022; PMID 16754611; PDF (freier Volltextzugriff, engl.)
- ↑ a b c d e f Deppenmeier, U. (2002): The unique biochemistry of methanogenesis. Prog Nucleic Acid Res Mol Biol. 71; 223–283; PMID 12102556; doi:10.1016/S0079-6603(02)71045-3
- ↑ a b Deppenmeier, U. (2002): Redox-driven proton translocation in methanogenic Archaea. In: Cell Mol Life Sci. 59(9); 1513–1533; PMID 12440773; doi:10.1007/s00018-002-8526-3
- ↑ a b c d e f g h i j U. Deppenmeier, V. Müller: Life close to the thermodynamic limit: how methanogenic archaea conserve energy. In: Results Probl Cell Differ. Bd. 45, 2008, S. 123–152, PMID 17713742; doi:10.1007/400_2006_026
- ↑ Fricke, WF. et al. (2006): The genome sequence of Methanosphaera stadtmanae reveals why this human intestinal archaeon is restricted to methanol and H2 for methane formation and ATP synthesis. In: J Bacteriol. 188(2); 642–658; PMID 16385054; PDF (freier Volltextzugriff, engl.)
- ↑ Oelgeschläger, E. und Rother, M. (2008): Carbon monoxide-dependent energy metabolism in anaerobic bacteria and archaea. In: Arch Microbiol. 190(3); 257–269; PMID 18575848; doi:10.1007/s00203-008-0382-6
- ↑ a b Martin, W. und Russell, MJ. (2007): On the origin of biochemistry at an alkaline hydrothermal vent. In: Philos Trans R Soc Lond B Biol Sci. 362(1486); 1887–1925; PMID 17255002; PDF (freier Volltextzugriff, engl.]
- ↑ a b c Fournier, G. (2009): Horizontal gene transfer and the evolution of methanogenic pathways. In: Methods Mol Biol. 532; 163–179; PMID 19271184; doi:10.1007/978-1-60327-853-9_9
- ↑ z. B. Methanosphaera stadtmanae, ein im menschlichen Verdauungstrakt vorkommendes Archaeon, dessen Genom sequenziert wurde
- ↑ Ferry, JG. (2010): How to make a living by exhaling methane. In: Annu Rev Microbiol. 64; 453–473; PMID 20528692; doi:10.1146/annurev.micro.112408.134051
- ↑ a b Rudolf K. Thauer, Anne Kristin Kaster, Meike Goenrich, Michael Schick, Takeshi Hiromoto, Seigo Shima: Hydrogenases from methanogenic archaea, nickel, a novel cofactor, and H2 storage. In: Annual Review of Biochemistry. Bd. 79, 2010, S. 507–536, PMID 20235826, doi:10.1146/annurev.biochem.030508.152103
- ↑ Boguslaw Lupa, Erik L. Hendrickson, John A. Leigh, William B. Whitman: Formate-dependent H2 production by the mesophilic methanogen Methanococcus maripaludis. In: Applied and Environmental Microbiology. Bd. 74, Nr. 21, 2008, S. 6584–6590, PMID 18791018; PDF (freier Volltextzugriff, engl.)
- ↑ Georg Fuchs (Hrsg.): Allgemeine Mikrobiologie, begründet von Hans-Günter Schlegel, 8. Auflage. Georg Thieme Verlag, Stuttgart, New York 2007, ISBN 978-3-13-444608-1; S. 397
Weblinks
- Stoffwechselweg in der Übersicht (Datenbank bei KEGG)
Siehe auch
Kategorien:- Biologischer Prozess
- Stoffwechselweg
- Biochemische Reaktion
- Biogastechnik
Wikimedia Foundation.