- Eisenhammerschlag
-
Magnetit Magnetit aus Südtirol, Italien Chemische Formel Fe3O4
genauer: FeII(FeIII)2O4Mineralklasse Oxide - Metall:Sauerstoff = 3:4 und vergleichbare mit ausschließlich mittelgroßen Kationen
4.BB.05 (9. Aufl.) ; IV/B.2-20 (8. Aufl) (nach Strunz)
7.2.2.3 (nach Dana)Kristallsystem kubisch Kristallklasse kubisch-hexakisoktaedrisch Farbe schwarz Strichfarbe schwarz Mohshärte 5,5 - 6,5 Dichte (g/cm³) 5,2 Glanz matter Metallglanz Transparenz undurchsichtig, an dünnen Kanten schwach transluzent Bruch muschelig, spröde Spaltbarkeit undeutlich Habitus gedrungen Häufige Kristallflächen {111}, seltener {110} oder {100} Zwillingsbildung häufig nach dem Spinellgesetz: Durchkreuzungszwillinge nach (111) Kristalloptik Doppelbrechung
(optische Orientierung)entfällt, da optisch isotrop Weitere Eigenschaften Schmelzpunkt 1535° C Chemisches Verhalten säure- und basenstabil Radioaktivität nicht radioaktiv Magnetismus ferrimagnetisch Magnetit (auch Magneteisen, Magneteisenstein, Eisenoxiduloxid oder Eisen(II,III)-oxid) ist ein Mineral aus der Mineralklasse der Oxide und die stabilste Verbindung zwischen Eisen und Sauerstoff. Er kristallisiert im kubischen Kristallsystem mit der allgemeinen chemischen Zusammensetzung Fe3O4, die präziser als FeII(FeIII)2O4 formuliert werden kann [1]. Magnetit entwickelt bei natürlicher Entstehung meist zentimetergroße, oktaederförmige Kristalle, aber auch körnige bis massige Aggregate von graubrauner bis schwarzer, metallisch glänzender Farbe.
Aufgrund seines hohen Eisenanteils von bis zu 72,4 % und seines starken Magnetismus gehört Magnetit zu den wichtigsten Eisenerzen und Rohstoffen für die Elektroindustrie. Das Mineral kommt weltweit gesehen zwar eher selten vor, bildet aber bei lokaler Anhäufung große Erzlagerstätten. [2]
Inhaltsverzeichnis
Besondere Eigenschaften
Magnetit ist von hoher Beständigkeit gegen Säuren und Laugen. Seine Mohshärte schwankt je nach Reinheit zwischen 5,5 und 6,5 und seine Dichte zwischen 5,1 und 5,2 g/cm³. Seine Strichfarbe ist schwarz.
Magnetismus
Magnetit ist eines der am stärksten (ferri)magnetischen Mineralien. Beim Unterschreiten der Curie-Temperatur von 578 °C richtet sich die Magnetisierung größtenteils in Erdmagnetfeldrichtung aus, so dass eine remanente magnetische Polarisation in der Größenordnung von bis zu 500 nT resultiert. Magnetitkristalle können auf diese Art die Richtung des Erdmagnetfeldes zur Zeit ihrer Entstehung konservieren. Die Untersuchung der Magnetisierungsrichtung von Lavagestein (Basalt) führte Geologen zu der Beobachtung, dass sich in ferner Vergangenheit tatsächlich die magnetische Polarität der Erde von Zeit zu Zeit umgekehrt haben musste.
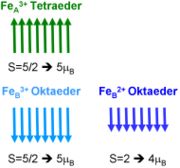
Die lange Zeit bekannten und verwendeten magnetischen Eigenschaften von Magnetit lassen sich sehr gut durch eine Betrachtung der lokalen Kristallstruktur erklären. Fe3O4 ist ein Ferrimagnet, archetypisch für die Ferrite der Spinelle. Die magnetische Ordnung in Magnetit kann man gut im Rahmen des Modells von zwei Untergittern nach Néel verstehen. In dem Modell wird angenommen, dass die Austauschwechselwirkung zwischen den oktaedrisch und tetraedrisch mit Sauerstoff koordinierten Eisenionenplätzen stark negativ, und die Wechselwirkung zwischen den Ionen auf den gleichen Untergittern schwach positiv ist. Dies bevorzugt eine antiparallele Anordnung der magnetischen Momente der Untergitter. Die Neel-, bzw. Curie-Temperatur von Magnetit ist ungewöhnlich hoch und beträgt TN = 850 K.[3] In Magnetit koppeln die effektiven Momente der A-/B-Untergitter antiferromagnetisch über Superaustausch. Das Fe2+-Ion besitzt den Spin S=2 (4µB) und das Fe3+-Ion den Spin S = 5/2 (5µB), so dass sich bei der oben erklärten antiparallelen Anordnung der Fe3+-Ionen auf dem A-Untergitter bzw. der Fe2+/3+-Ionen auf dem B-Untergitter ein effektives Sättigungsmoment von 4µB ergibt.
Verwey-Übergang
In der Leitfähigkeitskurve von Magnetit, in der die Leitfähigkeit über der Temperatur aufgetragen wird, ist das auffallendste Merkmal eine abrupte Änderung der Leitfähigkeit bei T=120K um zwei Größenordnungen. Magnetit ändert dabei seine Eigenschaften von einem schlechten Leiter in der Hochtemperaturphase (ca. 0.2 mΩm bei T > 120 K) zu einem Isolator in der Tieftemperaturphase (40 mΩm bei T < 120 K). Dieses Verhalten wurde 1939 von E. J. W. Verwey systematisch untersucht und eine erste theoretische Erklärung für den Effekt veröffentlicht.[4] Ihm zu Ehren wird dieser Übergang und alle physikalisch ähnlichen Übergänge als Verwey-Übergänge bezeichnet. Erste Hinweise auf einen Phasenübergang in einem Temperaturbereich um 120 K lieferten frühe Wärmekapazitätsmessungen an synthetisch hergestellten Proben.[5] Der Phasenübergang ist als Isolator-Isolatorübergang zu charakterisieren.[6]
Etymologie und Geschichte
Aus dem lateinischen Wortstamm magnet- (mit dem Nominativ magnes – Magnet) entstanden die Bezeichnungen Magnet, als mittelalterlicher Mineralname Magneteisenstein und der 1845 von Wilhelm Haidinger eingeführte Name Magnetit.
Bereits seit dem 11. Jahrhundert v. Chr. nutzten die Chinesen die magnetischen Eigenschaften des Minerals.
Ein Stein magnetis war Berichten des Theophrast zufolge den Griechen bekannt.[7] Bei dem römischen Schriftsteller Plinius den Älteren lässt sich der Hinweis auf einen Stein magnes, der nach einem Hirten gleichen Namens bezeichnet sein soll, finden.[8] Dieser Hirte habe den Stein auf dem Berg Ida gefunden, als die Schuhnägel und die Spitze seines Stocks am Erdboden haften blieben. Plinius unterschied mehrere Arten des magnes, vor allem aber einen "männlichen" und einen "weiblichen", von denen jedoch nur der männliche die Kraft besaß, Eisen anzuziehen, und damit dem eigentlichen Magnetit entsprach. Bei "weiblichen" magnes handelte es sich vermutlich um Manganerz, dem "männlichen" im Aussehen ähnlich, oder auch um ein Mineral von weißer Farbe, das später als Magnesit MgCO3 bezeichnet wurde.
Wahrscheinlicher ist allerdings die Deutung, dass das Mineral nach Magnesia, einer Landschaft in Thessalien oder der Stadt Magnesia am Mäander, benannt wurde. Möglich ist auch die Benennung von Magnetit nach anderen griechischen bzw. kleinasiatischen Orten gleichen Namens, in denen schon vor über 2500 Jahren Eisenerzbrocken mit magnetischen Eigenschaften gefunden wurden.
Klassifikation
Die Mineral-Systematiken von Strunz und Dana ordnen den Magnetit aufgrund seines kristallchemischen Aufbaus in die Mineralklasse der Oxide und die Abteilung Stoffmengenverhältnis Metall : Sauerstoff = 3 : 4 ein. In der neuen Systematik der Minerale nach Strunz (9. Auflage) werden die Minerale dieser Abteilung zusätzlich nach der Größe der beteiligten Kationen sortiert, wobei das positiv geladene Eisenion zu den mittelgroßen Kationen zählt.
In der Systematik nach Dana sortiert dagegen nach dem beteiligten Metallion (Fe) und der Kristallsymmetrie, sodass der Magnetit hier in der eisenhaltigen Untergruppe mit der gemeinsamen Punktgruppe
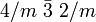 zu finden ist. [9]
zu finden ist. [9]Bildung und Fundorte
Natürliche Entstehung
Magnetit wird auf natürliche Art durch Vulkanismus gebildet. Bei großer Hitze (um 600 °C) durchdringt flüssige Lava die benachbarten Gesteine. Findet eine Druckentlastung im Gestein statt, die ja zum Vulkanausbruch führt bzw. ihn begleitet, so bilden sich große Mengen an Gasen. Hier ist vor allem Wasserdampf zu nennen, der die Gesteine chemisch angreift. Sind dies (wie auf Fuerteventura) kreidezeitliche Kalke oder Dolomit, so wird deren Kohlenstoffdioxid ausgetrieben und es bilden sich basische Hydroxide. Wenn in der Lava zusätzlich noch Eisenverbindungen enthalten sind (wie es häufig der Fall ist, was man an der oftmals braunroten Farbe erkennen kann), so reagieren diese zu verschiedenen Eisenhydroxiden. Aus diesen wiederum kristallisiert beim Erkalten Magnetit Fe3O4 oder der verwandte (aber nicht magnetische) Hämatit Fe2O3 aus. [10] Man spricht hier von pneumatolytischer Mineralbildung (pneuma, griech. Gas; lyein, griech. lösen).
Synthetische Herstellung
Für die Herstellung von Fe3O4 hat sich eine Methode, die von V.A.M. Brabers[11] erstmals zur Herstellung von einkristallinem Magnetit angewandt wurde, als die geeignetste herausgestellt. Dabei werden mit Hilfe des Zonenschmelzverfahrens in einem Spiegelofen Kristalle gezogen. Durch das Heizen eines Stabes aus α-Fe2O3 mit 99,9 % Reinheit im Spiegelofen, wird eine vertikale Schmelzzone zwischen Vorrat und Kristall erzielt, die allein durch die Oberflächenspannung gehalten wird, was eine Verunreinigung z. B. durch das Tiegelmaterial verhindert. Die so erhaltenen Kristalle, die zwischen 2 und 5 cm lang sind und einen Durchmesser von etwa 5 mm haben, wurden im Anschluss an die Kristallisation im Spiegelofen 70 h bei 1130 ºC in einer Atmosphäre aus CO2 und H2 getempert, um Gitterbaufehler auszuheilen und die richtige Stöchiometrie für Magnetit einzustellen. Die Orientierung der Kristalle längs der Stabachse entspricht grob der [100]-, [111]- und [110]-Richtung. Die Kristalle zeichnen sich durch ihre hervorragende Qualität, gemessen an dem Merkmal der Übergangstemperatur und der Schärfe des Übergangs wie er sich im Linienverlauf der Leitfähigkeitskurve (siehe Verwey-Übergang) ausdrückt, aus.
Vorkommen
Magnetit kommt in massiver oder gekörnter Form und daneben auch als Kristalle vor, welche oft oktaedrisch geformt sind, besitzen also je acht dreieckige Begrenzungsflächen. Er ist ein durchaus häufiges Mineral, das allerdings selten den Hauptbestandteil eines Gesteins stellt. Man findet Magnetit in zahlreichen magmatischen Gesteinen wie Basalt, Diabas und Gabbro, in metamorphen Gesteinen und durch Verwitterungsprozesse aufgrund seiner Härte weitgehend intakt verbracht als Magnetitsand in Flusssedimenten. Aus diesen wird er zum Teil noch heute von Hand ausgewaschen.
Magnetit kann in größeren Mengen an Sandstränden gefunden werden, wo er zu der typischen schwarzen Färbung des Sandes führt. Solche schwarzen Strände findet man z. B. in Kalifornien, an der Westküste von Neuseeland und an den Küsten von Fuerteventura und Island.
Sehr große Lagerstätten von Magnetit findet man in Kiruna (Schweden), in der Pilbara Region in (Westaustralien) und in der Adirondack Region des Staates New York (USA). Größere Vorkommen von Magnetit sind in Norwegen, Deutschland, Italien, der Schweiz, Südafrika, Indien, Mexiko und in Oregon, New Jersey, Pennsylvania, North Carolina, Virginia, New Mexico, Utah und Colorado in den USA gefunden worden. [12]
Struktur
Kristallographische Daten[13] 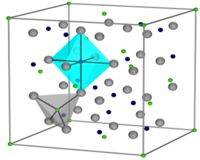
Elementarzelle von MagnetitKristallsystem kubisch Raumgruppe 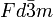
Gitterparameter
(Elementarzelle)a = 8,3985(5) Å Zahl (Z) der
FormeleinheitenZ = 8 Kristallographisch gehört Magnetit zur Spinell-Gruppe und zeigt als natürlich gewachsener Kristall Oktaederflächen {111} und seltener Rhombendodekaederflächen {110}. Häufig kommt es zu Zwillingen nach dem Spinellgesetz (Durchkreuzungszwillinge nach (111)), jedoch nur selten bei eingewachsenen Kristallen. Magnetit kristallisiert allerdings in der so genannten inversen Spinell-Struktur. Dabei ordnen sich die trivalenten Eisenionen (Fe3+) auf Plätze, die tetraedrisch von Sauerstoffionen umgeben sind (Tetraeder-Plätze). Während sich die divalenten Eisenionen (Fe2+) gleichmäßig auf die Oktaeder- und Tetraeder-Plätze verteilen.
Die Struktur von Magnetit (chemische Summenformel Fe3O4) kann nach der allgemeinen Formel für Spinelle AB2O4 als Fe3+[Fe3+Fe2+]O4 geschrieben werden. Die Bezeichnung inverse Spinell-Struktur für Magnetit trägt der Tatsache Rechnung, dass 1/3 der Eisenionen (Fe3+-Ionen) tetraedrisch und 2/3 der Eisenionen (Fe2+- und Fe3+-Ionen im Verhältnis 1:1) oktaedrisch vom Sauerstoff koordiniert sind, was gerade invers zum normalen Spinell ist. Die Symmetrie der Hochtemperaturphase (T > 120 K) von Magnetit wurde schon sehr früh (1915) hinreichend gut aufgeklärt[14] , sie ist kubisch. Genauer gesagt handelt es sich um die Raumgruppe Fd-3m bzw. O7h, wobei die Gitterkonstante a = 8,394 Å beträgt. Somit ergeben sich acht Formeleinheiten pro Elementarzelle mit insgesamt 56 Atomen.
Die Struktur der kubischen Hochtemperaturphase (T > 120 K) ist im Bild links schematisiert. Hier sind die kubisch dichteste Kugelpackung von Oxidionen (grau), die Oktaeder- (türkis) und Tetraederlücken (grau) dargestellt. Die Fe3+-Ionen in den Tetraederlücken sind grün und die Fe2+-/Fe3+-Ionen in den Oktaederlücken dunkelblau hervorgehoben. Das A-Untergitter, das von den tetraedrisch koordinierten Fe3+-Ionen aufgebaut wird bildet ein Diamantgitter, während das B-Untergitter der Fe2+-, bzw. Fe3+-Ionen der oktaedrischen Sauerstoffumgebung ein Pyrochlorgitter bildet, das bekanntermaßen geometrisch frustriert ist. Geometrische Frustration bedeutet dabei, dass eine lokale Ordnung, die durch lokale Wechselwirkungen stabilisiert wird, nicht frei durch den Kristall propagieren kann. Diese besonderen geometrischen Eigenschaften ermöglichen eine große Anzahl unterschiedlicher Wechselwirkungen mit großer oder geringer Reichweite und sehr ähnlicher Energie, oft mit einem vielfach entarteten Grundzustand. Eine der Möglichkeiten die Entartung aufzuheben, ist eine langreichweitige Ladungs- oder Spinordnung, was zu extrem komplexen Kristallstrukturen führen kann, von denen bis heute nur wenige aufgeklärt sind.
Die genaue Raumgruppe der Tieftemperaturphase (T < 120 K) war bis ins Jahr 1982 nicht eindeutig bestimmt und wird sogar bis heute kontrovers diskutiert. Erst durch eine sorgfältig durchgeführte Neutronenbeugungsanalyse an synthetischen Einkristallen, die bei gleichzeitigem Anlegen von Druck entlang der [111]-Richtung und Kühlen im Magnetfeld gemessen wurden, konnte die kristalline Ordnung unterhalb von T = 120 K aufgeklärt werden. Es handelt sich um eine Verzerrung der monoklinen Raumgruppe Cc mit pseudo-orthorhombischer Symmetrie (Raumgruppe Pmca; ac /√2 ⊗ ac /√ 2 ⊗ 2ac), wobei ac der Länge einer Achse der ungestörten kubischen Elementarzelle entspricht.
Verwendung
als Rohstoff
Magnetit ist neben dem Hämatit eines der wichtigsten Erze und hat mit 72 % Eisen den höchsten Gehalt an diesem Metall.
Magnetit dient als wichtiger Grundstoff zur Herstellung von Ferrofluid. Dabei werden im ersten Schritt Magnetit-Nanopartikel (Größenordnung ca. 10 nm) hergestellt, die dann in einer Trägerflüssigkeit kolloidal suspendiert werden. Um das Agglomerieren der Kristalle zu verhindern, werden den Nanopartikeln langkettige Tenside, wie z. B. Ölsäure zugefügt, die sich um die Magnetit-Partikel gruppieren und das erneute Sedimentieren verhindern. Die so erhaltene Flüssigkeit behält auf diese Art die Eigenschaft von Magnetit, auf Magnetfelder zu reagieren.
als Pigment
Aufgrund der hervorragenden magnetischen Eigenschaften wird Magnetit als Magnetpigment zur Daten-Speicherung eingesetzt und bis heute beim Bau von Kompassen verwendet. Feinteiliger synthetischer Magnetit wird unter der Bezeichnung Eisenoxidschwarz (Pigment Black 11)[15] (siehe auch Eisenoxidpigment) als Pigment, z. B. für Lacke eingesetzt.
in Lebewesen
Verschiedene Tierarten sind zur Orientierung im Erdmagnetfeld auf Magnetit angewiesen. Hierzu gehören Bienen und Weichtiere (Mollusca). Besonders erwähnenswert sind Tauben, die durch Einlagerung kleiner eindomäniger Magnetitkörner in den Schnabel die Deklination des Erdmagnetfeldes bestimmen und sich so orientieren können (siehe auch Magnetsinn).[16] Einige Bakterien, sogenannte magnetotaktische Bakterien, wie z. B. das Magnetobacterium bavaricum, oder auch das Magnetospirillum magnetotacticum, bilden 40 bis 100 nm große Magnetit-Einkristalle im Inneren ihrer Zellen, die von einer Membran umgeben sind. Diese Partikel werden als Magnetosomen bezeichnet und sind in Form von linearen Ketten angeordnet. Die Ketten stellen gewissermaßen Kompassnadeln dar und erlauben den Bakterien geradliniges Schwimmen entlang der Erdmagnetfeldlinien.[17][18]
als Baustoff
Magnetit wird in der Bauindustrie als natürlich gekörnter Zuschlag mit hoher Rohdichte (4,65 bis 4,80 kg/dm3) für Schwerbeton und für bautechnischen Strahlenschutz verwendet.
in der Halbleiterelektronik
Aufgrund der von der Theorie vorhergesagten 100 %-tigen Spinpolarisation[19] der Ladungsträger wird Magnetit auch als heißer Kandidat für Spinventile[20] in der Spinelektronik[21] gehandelt.
Leben auf dem Mars?
Im Jahr 1996 veröffentlichten Wissenschaftler in der anerkannten Fachzeitschrift Science einen Artikel[22] über den möglichen Nachweis von Leben in Form von Bakterien auf dem Mars anhand eines Meteoriten (ALH84001), der von dort stammt. Der Meteorit enthält kleine eindomänige Magnetitpartikel, wie sie typischerweise auch in magnetotaktischen Bakterien auf der Erde vorkommen. Die Debatte über die Interpretation der Messergebnisse hält allerdings bis heute an.
Esoterik
Schon im frühen Mittelalter wurden Eigenschaften die dem Stein Magnetit zugeschrieben werden von Hildegard von Bingen beschrieben. Nach der esoterischen Lehrmeinung sind sie: Aktivierung (geistig und körperlich), Erhöhung der Reaktionsfähigkeit sowie Anregung des Energieflusses und der Drüsentätigkeit. Magnetit ist ein Stein welcher in der Meditation insgesamt entstrahlt und eine besonders entspannende Aura bewirkt. Er soll z.B. gegen Hungergefühle, Körpergeruch und starkes Schwitzen, Verspannungen und Verkrampfungen helfen. Des Weiteren ist er angeblich entzündungshemmend, hilft bei Vergiftungen und Zellerneuerungen. Er bringt Harmonie, Wärme, löst Blockaden und macht glücklicher und unbeschwerter.
Siehe auch
Einzelnachweise
- ↑ IMA/CNMNC List of Mineral Names (PDF 1,79MB, S. 170)
- ↑ Martin Okrusch, Siegfried Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7. Auflage. Springer Verlag, Berlin, Heidelberg, New York 2005, ISBN 3-540-23812-3, S. 51-52.
- ↑ G. A. Samara, A. A. Giardini: Effect of Pressure on the Neel Temperature of Magnetite. in: The physical review. Lancaster 186.1969,2, 577-580. ISSN 0031-899x
- ↑ E. J. W. Verwey: Electronic Conduction of Magnetite (Fe3O4) and its Transition Point at Low Temperatures. in: Nature. London 144.1939, 327-328. ISSN 0028-0836
- ↑ R. W. Millar: The heat capacities at low temperatures of "Ferrous Oxide" magnetite and cuprous and cupric oxides. in: Journal of the American Chemical Society (J. Am. Chem. Soc.). Washington 51.1929, 215-224. ISSN 0002-7863
- ↑ D. Schrupp, M. Sing, M. Tsunekawa, H. Fujiwara, S. Kasai, A. Sekiyama, S. Suga, T. Muro, V. A. M. Brabers, R. Claessen: High-energy photoemission on Fe3O4: Small polaron physics and the Verwey transition. in: epl, a letters journal exploring the frontiers of physics (Europhys. Lett.). Les-Ulis 70.2005,6, 789-795. ISSN 0302-072x
- ↑ Theophrast von Eresos: Über die Steine.
- ↑ Gaius Plinius Secundus: Historia Naturalis.
- ↑ Webmineral - New Dana Classification of Multiple Oxides (engl.)
- ↑ A. J. Clark: Seeing beneath the soil. B. T. Batsford Ltd, London 1990, Routledge 2000. ISBN 0-415-21440-8
- ↑ V. A. M. Brabers: The preparation of tetragonal single crystals in the MnxFe3-xO4 system. in: Journal of crystal growth. Amsterdam 8.1971,1, 26-28. ISSN 0022-0248
- ↑ MinDat - Localities for Magnetite (engl.)
- ↑ J. Fleet: The structure of magnetite: Symmetry of cubic spinels. In: Journal of Solid State Chemistry. Bd. 62, 1986, S. 75–82.
- ↑ W. H. Bragg, F. R. S. Cavendish: The Structure of the Spinel Group of Crystals. in: The philosophical magazine. London 30.1915,176, 305-315. ISSN 1478-6435
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006
- ↑ M. Winklhofer: Vom magnetischen Bakterium zur Brieftaube. in: Physik Unserer Zeit. Wiley-VCH 35.2004,3, 120-127. ISSN 0031-9252
- ↑ M. Hanzlik: Elektronenmikroskopische und magnetomineralogische Untersuchungen an magnetotaktischen Bakterien des Chiemsees und an bakteriellem Magnetit eisenreduzierender Bakterien. Dissertation. Ludwig-Maximilians-Universität, München 1999.
- ↑ A. Scheffel, M. Gruska, D. Faivre, A. Linaroudis, J. M. Plitzko und D. Schueler: An acidic protein aligns magnetosomes along a filamentous structure in magnetotactic bacteria.Nature, Advance Online Publication (AOP), 20. November 2005 (DOI 10.1038/nature04382)
- ↑ A. Yanase, K. Siratori: Band Structure in the High Temperature Phase of Fe3O4. in: Journal of the Physical Society of Japan. Tokyo 53.1984,1, 312-317. ISSN 0031-9015
- ↑ W. Eerenstein, T. T. M. Palstra, S. S. Saxena, T. Hibma: Spin-Polarized Transport across Sharp Antiferromagnetic Boundaries. in: Physical review letters (PRL). Rige NY 88.2002,24, 247204. ISSN 0031-9007
- ↑ A. M. Haghiri-Gosnet, T. Arnal, R. Soulimane, M. Koubaa, J. P. Renard: Spintronics, perspectives for the half-metallic oxides.in: Physica status solidi. A. Applications and materials science. Berlin 201.2004,7, 1392-1397. ISSN 0031-8965
- ↑ D. S. McKay, E. K. Gibson, K. L. Thomas-Keprta, H. Vali, C. S. Romanek, S. J. Clemett, X. D. F. Chillier, C. R. Maechling, R. N. Zare: Search for past life on Mars. Possible relic biogenic activity in martian meteorite ALH 84001. in: Science. 273.1996, 924-930. ISSN 0036-8075
Weblinks
- Mineralienatlas:Magnetit und Mineralienatlas:Mineralienportrait/Magnetit (Wiki)
- Mineralogy Database - Mineral Collecting, Localities, Mineral Photos and Data
- Baulexikon online - Bauwerk Verlag GmbH, Berlin
- Rätsel um Magnetsinn von Bakterien gelöst: Forscher entschlüsseln Entstehung der Magnetosomenketten
Wikimedia Foundation.