- E920
-
Strukturformel 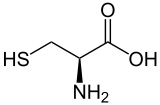
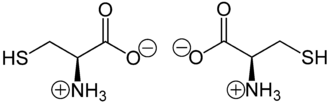
L-Cystein (links) und D-Cystein (rechts)Allgemeines Name Cystein Andere Namen - Cys (Dreibuchstabencode)
- C (Einbuchstabencode)
- (R)-2-Amino-3-mercapto-propansäure
- IUPAC: 2-Amino-3-sulfanylpropansäure (ohne Stereochemie)
- (R)-Thioserin
- α-Amino-β-mercaptopropionsäure
Summenformel C3H7NO2S CAS-Nummer - 52-90-4 (L-Enantiomer)
- 921-01-7 (D-Enantiomer)
- 34509-32-2 (L-Cystein·Hydrochlorid)
- 3374-22-9 (DL-Cystein)
- 207121-46-8 (D-Cystein·Hydrochlorid·Monohydrat)
PubChem 5862 DrugBank DB00151 Kurzbeschreibung farbloser Feststoff mit charakteristischem Geruch [1] Eigenschaften Molare Masse 121,16 g·mol−1 Aggregatzustand fest
Schmelzpunkt 220–228 °C [1]
pKs-Wert - pKCOOH: 1,71
- pKNH2: 10,78
- pKSeitenkette: 8,27 (je bei 25 °C)[2]
Löslichkeit - gut löslich in Wasser: 280 g·l−1 (20 °C) [1]
- gut in Alkohol, Essigsäure, nicht in Ether und Benzol
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: keine S-Sätze LD50 1890 mg·kg−1 (Ratte, oral) [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cystein ist eine schwefelhaltige proteinogene α-Aminosäure mit der Seitenkette –CH2–SH. Cystein kann in den enantiomeren Formen D und L vorliegen, wobei in Proteinen nur die L-Form [Synonym: (R)-Cystein] enthalten ist. Da Schwefel nach der CIP-Nomenklatur eine höhere Priorität als Sauerstoff hat, ist L-Cystein – neben dem Disulfid L-Cystin – und L-Selenocystein die einzige proteinogene Aminosäure mit (R)-Konfiguration.
L-Cystein wurde zuerst aus Nierensteinen isoliert, woraus sich auch der Name (gr. κύστζ: Harnblase) ableitet.
Zwei Cysteinreste können eine Disulfidbrücke ausbilden, wobei Cystin entsteht. Disulfidbrücken sind neben Wasserstoffbrückenbindungen, ionischen Bindungen und van-der-Waals-Kräften für die Bildung und den Erhalt der Tertiär- und Quartärstruktur von Proteine verantwortlich.
Inhaltsverzeichnis
Vorkommen
Ein Protein mit hohem L-Cystin-Gehalt ist Keratin (z. B. Haare, Borsten, Hörner).
Lebensmittel
L-Cystein kommt in vielen Lebensmitteln vor. Der Cystein-Gehalt ist hierin nur mit spezifischen Methoden genau zu bestimmen, weil sonst der Gesamtgehalt der schwefelhaltigen Aminosäuren L-Methionin und L-Cystein/L-Cystin bestimmt wird.[3]
Lebensmittel Methionin / Cystein
je 100 gLachs 700 mg Garnelen 670 mg Pute, Brustfleisch 630 mg Huhn, Brustfleisch 620 mg Sojabohnen 580 mg Rind, Filet 570 mg Cashew-Nüsse 380 mg Weizenkeime 280 mg Emmentaler 250 mg Eigenschaften
Cystein liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxylgruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Cystein auch seine geringste Löslichkeit in Wasser hat. Der isoelektrische Punkt von Cystein liegt bei 5,02.[4]
Cystein könnte zu den nicht essentiellen Aminosäuren gezählt werden, da es vom Körper gebildet werden kann. Allerdings ist dazu die essentielle Aminosäure Methionin erforderlich. Daher wird Cystein üblicherweise als semiessentiell betrachtet. Als Bestandteil vieler Proteine und Enzyme ist es oft am Katalysemechanismus beteiligt.
Technische Gewinnung
L-Cystein kann, wie fast alle anderen Aminosäuren, durch Einwirkung von Salzsäure auf Proteine wie Keratin (meist aus keratinreichen Geweben wie Menschen- oder Tierhaaren oder Federn) durch Hydrolyse gewonnen werden. Seit einiger Zeit ist die Darstellung auch durch Fermentation mit Bakterien, z. B. Escherichia coli, auch unter Einsatz gentechnisch veränderter Organismen möglich (siehe Darstellung Tryptophan). Racemisches Cystein (DL-Cystein) kann vollsynthetisch aus 2-Chloracetaldehyd, Natriumhydrogensulfid, Ammoniak und Aceton über das nach der Asinger-Reaktion gewonnene Zwischenprodukt 2,2-Dimethyl-3-thiazolin gewonnen werden. Anschließend wird Blausäure angelagert und sauer hydrolysiert. [5]
Biosynthese und Metabolismus
Cystein wird biosynthetisch aus Serin, welches das Grundgerüst liefert, und Methionin über Homocystein, das die SH-Gruppe beiträgt, aufgebaut. Dazu sind die Enzyme Cystathionin-Synthetase und Cystathionase erforderlich. Serin- oder Methioninmangel hemmen folglich die Cysteinsynthese.
Die Aminosäure kann durch α,β-Eliminierung abgebaut werden. Dabei entstehen Aminoacrylat und Schwefelwasserstoff (H2S). H2S wird zum Sulfat (SO42−) oxidiert. Aminoacrylat isomerisiert zum Iminopropionat, das hydrolytisch seine Aminogruppe abspaltet und so zum Pyruvat wird.
Durch Transaminierung kann es auch zum β-Mercaptopyruvat werden. Die Sulfit-Transferase überträgt Sulfit auf die Thiolgruppe und wandelt diese dadurch in ein Thiosulfat um. Nach Hydrolyse der Kohlenstoff-Schwefel-Bindung wird anschließend Pyruvat frei; das Thiosulfat (S2O32−) wird zum Sulfat oxidiert.
Cystein kann auch an der SH-Gruppe oxidiert werden und anschließend zum Taurin decarboxylieren.
Durch genetisch bedingte Defekte im Cystintransporter kann nach Aufnahme im Magen-Darm-Trakt und Wiederaufnahme in der Niere eine Cystinurie entstehen. Die Mutation im rBAT-Gen betrifft auch den Stoffwechsel der Aminosäuren Lysin, Arginin und Ornithin, also die Polyamino-Aminosäuren.
Funktionen
Die Aminosäure kann Schwermetall-Ionen komplexieren. Sie wird daher unter anderem als Therapeutikum für Silber-Vergiftungen eingesetzt. Da es freie Radikale an die Thiolgruppe bindet, wird Cystein auch zur Vorbeugung von Strahlenschäden eingesetzt. Es wird normalerweise in der Form von Acetylcystein (ACC bzw. NAC) verabreicht.
Lebensmittelzusatzstoff
Cystein wird als Mehlbehandlungsmittel eingesetzt. Es trägt zur beschleunigten Mehlreifung bei, was insbesondere bei automatisierten Backvorgängen, beispielsweise für Kekse, von großer Bedeutung ist. Es wird Teigen beigegeben, da es die Klebereigenschaften von Mehl verbessert. Daneben wird Cystein bei Diätzubereitungen, Futtermittel, Arzneimitteln und Kosmetika eingesetzt. Ferner ist es ein Grundstoff zur Aromaerzeugung, insbesondere für Fleisch- und Röstaromen. Als semiessentielle Aminosäure wird Cystein/Cystin adaptierter Muttermilch zugesetzt. L-Cystein ist in der EU als Lebensmittelzusatzstoff (E 920) ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel als Mehlbehandlungsmittel zugelassen. Eine Deklaration in fertigen Produkten ist nicht erforderlich.
Therapeutische Wirkung
Cystein wird, verabreicht als Acetylcystein, zur symptomatischen Therapie von Husten, insbesondere in der Akut- und Rekonvaleszenzphase nach Erkältungskrankheiten, eingesetzt. Unter der Gabe von Cystein wird der im Verlauf dieser Erkrankungen vermehrt gebildete Bronchialschleim dünnflüssiger und kann so leichter abgehustet werden.
Die prinzipiell gleiche Wirkung hat das aus der Umsetzung von L-Cystein mit Iodessigsäure hergestellte Carbocystein („Carbocistein“), das ebenfalls als Mukolytikum hergestellt und verkauft wird (beispielsweise Mucopront®, Sedotussin®, Transbronchin®).
Weitere Anwendungsgebiete
In japanischen Friseursalons ersetzt Cystein, das Disulfidbindungen im Keratin aufzubrechen vermag, die in Europa übliche, streng riechende Thioglycolsäure, wenn es darum geht, Haare für Dauerwellen zu präparieren. Auch in anderen Kosmetikprodukten wird Cystein verwendet: Es ist ein Radikalfänger, der diese zellschädigenden Stoffe unschädlich macht und für den in neueren Studien eine gewisse Vorbeugefunktion gegen neurodegenerative Erkrankungen postuliert wird. Allerdings scheint Cystein andererseits neueren Untersuchungen zufolge durch seine Eisenbindungsfähigkeit die Ablagerung von Cystein-Eisen-Komplexen im Gehirn - speziell im Globus pallidus und in der Substantia nigra pars reticulata z. B. bei NBIA - zu begünstigen.[6] Aus L-Cystein werden pharmazeutische Wirkstoffe im industriellen Maßstab hergestellt, z. B. (R)-S-Carboxymethylcystein und (R)-N-Acetylcystein. Diese beiden Pharmawirkstoffe sollen als orale Mukolytika den oft zähen Bronchialschleim bei chronischer Bronchitis und chronisch obstruktiver Lungenerkrankung verflüssigen.
Quellen
- ↑ a b c d e Herstellerangaben der Firma Merck, 7. Jan. 2008
- ↑ Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1982, ISBN 3-527-25892-2, dort Seite 40.
- ↑ Cystein und Glutathion – wichtig für Zellen, Bindegewebe und Immunsystem bei Novamex
- ↑ P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- ↑ Jürgen Martens, Heribert Offermanns und Paul Scherberich: Eine einfache Synthese von racemischem Cystein, Angewandte Chemie 93 (1981) 680 doi:10.1002/ange.19810930808; Angewandte Chemie International Edition English 20 (1981) 668. doi:10.1002/anie.198106681
- ↑ NBIA, tobias-schwarz.net, 6. November 2005.
Weblinks
- Web-Special von Wacker-Chemie zu Cystein
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.