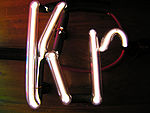- Crypton
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Krypton, Kr, 36 Serie Edelgase Gruppe, Periode, Block 18, 4, p Aussehen farblos CAS-Nummer 7439-90-9 ATC-Code V09EX01 (81mKr)
Atomar Atommasse 83,798 u Atomradius (berechnet) (88) pm Kovalenter Radius 110 pm Van-der-Waals-Radius 202 pm Elektronenkonfiguration [Ar] 3d10 4s24p6 Elektronen pro Energieniveau 2, 8, 18, 8 1. Ionisierungsenergie 1350,8 kJ/mol 2. Ionisierungsenergie 2350,4 kJ/mol 3. Ionisierungsenergie 3565 kJ/mol 4. Ionisierungsenergie 5070 kJ/mol 5. Ionisierungsenergie 6240 kJ/mol 6. Ionisierungsenergie 7570 kJ/mol 7. Ionisierungsenergie 10710 kJ/mol 8. Ionisierungsenergie 12138 kJ/mol Physikalisch Aggregatzustand gasförmig Kristallstruktur kubisch flächenzentriert Dichte 3,749 kg · m−3 bei 273 K Mohshärte - Magnetismus diamagnetisch Schmelzpunkt 115,79 K (−157,36 °C) Siedepunkt 119,93 K (−153,22 °C) Molares Volumen 22,35 · 10−3 m3/mol Verdampfungswärme 9,029 kJ/mol Schmelzwärme 1,638 kJ/mol Schallgeschwindigkeit 212 m/s Spezifische Wärmekapazität 248 J/(kg · K) Wärmeleitfähigkeit 0,00949 W/(m · K) Chemisch Oxidationszustände 0 Oxide (Basizität) - (-) Normalpotential Elektronegativität 3,00 [1][2] (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 76Kr 14,8 h ε 1,311 76Br 77Kr 74,4 min ε 3,064 77Br 78Kr 0,35 %
2,0 · 1021 a ε ε 2,868 78Se 79Kr 35,04 h ε 1,626 79Br 80Kr 2,25 %
Stabil 81Kr 229.000 a ε 0,281 81Br 82Kr 11,6 %
Stabil 83Kr 11,5 %
Stabil 84Kr 57,0 %
Stabil 85Kr 10,756 a β− 0,687 85Rb 86Kr 17,3 %
Stabil 87Kr 73,6 min β− 3,887 87Rb 88Kr 2,84 h β− 2,914 88Rb NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung [3] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Krypton (von altgriech. κρυπτός kryptós „verborgen“) ist ein chemisches Element im Periodensystem der Elemente mit dem Symbol Kr und der Ordnungszahl 36. Das farblose und ungiftige Edelgas kommt in geringer Konzentration (etwa 1:1.000.000) in der Luft vor.
Inhaltsverzeichnis
Geschichte
Krypton (griechisch krypton für versteckt) wurde am 30. Mai 1898 von William Ramsay und Morris William Travers im „Rückstand“ verdampfter Luft entdeckt.
Von 1960 bis 1983 diente die 1.650.763,73-fache Wellenlänge der orange-roten Spektrallinie des Isotops Krypton-86 als Definition der Längeneinheit Meter. Grund war, dass Krypton-86 recht einfach in hinreichend reiner Form aus Luft gewonnen werden konnte.
Vorkommen
Krypton ist Bestandteil der Lufthülle. Wegen der geringen Konzentration von ca. 1,1 ml/m³ ist die Gewinnung von reinem Krypton sehr aufwendig und langwierig. Krypton ist mit 0,1 ppb in der kontinentalen Erdkruste vertreten[4]. Es steht hinter Rhenium und vor Xenon an der 82 Stelle der Elementhäufigkeit und ist somit das zweit seltenste nicht radioaktive Element.
Gewinnung und Darstellung
Die Gewinnung erfolgt aus der höhersiedenden Sauerstofffraktion beim Linde-Verfahren.
Eigenschaften
Krypton ist im gasförmigen und flüssigen Zustand farblos, im festen Zustand weiß und kristallin. In Wasser ist es etwas löslich. In Gasentladungsröhren leuchtet Krypton je nach dem innerem Gasdruck in unterschiedlichen Farben: violett, blau, hellblau, gelbgrün.
Als Edelgas mit einer vollständig aufgefüllten Valenzschale ist es chemisch sehr träge. Mit dem stark elektronegativen Fluor konnte ein instabiles Kryptondifluorid KrF2 gebildet werden, welches das stärkste bisher bekannte Oxidationsmittel ist.
Der kritische Punkt stellt sich ein bei:
- Temperatur: −63,75 °C (=209,4 K)
- Druck: 55,0 bar
- Dichte: 0,908 g/cm3 [5].
Isotope
Von Krypton sind 25 Isotope und 4 Kernisomere mit Massezahlen von 71 bis 95 bekannt. Fünf der Kryptonisotope sind stabil. Das radioaktive Isotop 78Kr hat mit 2,0·1021 (2 Trilliarden) Jahren durch doppelten Elektroneneinfang eine so lange Halbwertszeit, dass es einen kleinen Anteil des natürlich vorkommenden Kryptons ausmacht, ohne dass dieses dadurch nennenswert radioaktiv würde. Außerdem kommt 81Kr mit 229.000 Jahren Halbwertszeit in Spuren in der Erdatmosphäre vor. Daneben hat noch 85Kr mit 10,756 Jahren eine relativ lange Halbwertszeit. Da es in Kernreaktoren als Spaltprodukt entsteht, gelangt es bei der Wiederaufarbeitung von Kernbrennstäben in die Atmosphäre. Die restlichen Isotope und Kernisomere haben Halbwertszeiten zwischen 64 ms und 35,04 Stunden.
Anwendungen
In der Technik wird es überwiegend zum Füllen von Glühlampen genutzt:
- Glühlampen (Kryptonlampen)
- Halogenlampen (in denen es grün-violett leuchtet)
- Niederdruck-Quecksilberdampflampen
- Fotoblitzbirnen
Weitere Anwendungen:
- Chemische Laser mit Kryptonfluorid (KrF)
- Krypton-Ionen-Laser
- Oxidationsmittel Kryptondifluorid (KrF2)
- Krypton wird bei Isoliergläsern anstelle von Argon im Scheibenzwischenraum [SZR] eingesetzt, weil es ein schlechter Wärmeleiter ist. Krypton hat bei 6–8 mm SZR den besten Ug-Wert (Wärmedurchgangskoeffizient, früher k-Wert) und liegt verglichen mit ca. 14 mm Argon um ca. 0,1 W/(m²K) niedriger.
- Füllung für Geiger-Müller-Zählrohre und Szintillationszähler
- als 81mKryptongas in der Nuklearmedizin als Nuklid für die Lungenszintigrafie
Verbindungen
Aufgrund der äußerst hohen Ionisierungsenergie sind Kryptonverbindungen nur durch kräftige Energiezufuhr, etwa durch elektrische Entladungen, mit dem reaktiven Fluor herzustellen und auch nur bei tiefen Temperaturen stabil. Die wichtigste Kryptonverbindung ist das Kryptondifluorid (KrF2), ein extrem starkes Oxidations- und Fluorierungsmittel, das bei Temperaturen unter −80 °C stabil ist. Bei Reaktionen von KrF2 mit oxidierbaren Stoffen zerfällt die Substanz in das Kryptonfluorid-Kation KrF+, das stärkste zurzeit bekannte Oxidationsmittel und das Fluorid-Anion (F−). 2003 gelang einem Team unter Leitung von Leonid Khriachtchev von der Universität Helsinki die Darstellung der organischen Kryptonverbindung HKrCCH, einer Wasserstoff-Krypton-Acetylen-Verbindung.[6][7]
Weitere bekannte Verbindungen:
- Kryptonbis(pentafluororthotellurat) Kr(OTeF5)2
- Klathrate, etwa mit Hydrochinon oder Wasser
Einzelnachweise
- ↑ L. C. Allen, J. E. Huheey: The definition of electronegativity and the chemistry of the noble gases. In: Journal of Inorganic and Nuclear Chemistry. 42, 1980, S. 1523-1524 (doi:10.1016/0022-1902(80)80132-1).
- ↑ T. L. Meek: Electronegativities of the Noble Gases. In: Journal of chemical education. 72, Nr. 1, 1995, S. 17-18.
- ↑ Eintrag zu Neon in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 27.4.2008 (JavaScript erforderlich)
- ↑ David R. Lide (ed.): CRC Handbook of Chemistry and Physics, 85. Auflage, CRC Press, Boca Raton, Florida, 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea.
- ↑ Römpps Chemielexikon achte Auflage 1988
- ↑ Thorsten Krome: Kryptische Chemie Edelgas Krypton geht eine organische Verbindung ein. In: Spektrumdirekt, Ausgabe 11. Juni 2003
- ↑ Journal of the American Chemical Society 125: 6876–6877 (2003)
Literatur
- V. A. Rabinovich: Thermophysical properties of neon, argon, krypton, and xenon. In: Theodore B. Selover: English-language edition ed. Washington [u.a.] Hemisphere Publ. Corp. [u.a.], 1988. – XVIII (National standard reference data service of the USSR; 10)
Weblinks
- Los Alamos National Laboratory – Krypton
- WebElements.com – Krypton
- Bild in der Sammlung von Heinrich Pniok (siehe auch bei den anderen Elementen)
- EnvironmentalChemistry.com – Krypton
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.