- E 513
-
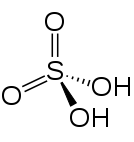
Strukturformel 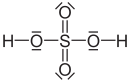
Allgemeines Name Schwefelsäure Andere Namen - Schwefel(VI)-säure
- Vitriolöl
- Dihydrogensulfat
- Monothionsäure
- E 513
Summenformel H2SO4 CAS-Nummer 7664-93-9 Kurzbeschreibung farb- und geruchlose, viskose Flüssigkeit [1] Eigenschaften Molare Masse 98,08 g·mol−1 Aggregatzustand flüssig [1]
Dichte 1,8356 g·cm−3 [1]
Schmelzpunkt 10,38 °C (100 %) [1]
Siedepunkt 279,6 °C (100 %) [1]
Dampfdruck pKs-Wert Löslichkeit vollständig mischbar mit Wasser [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Ätzend (C) R- und S-Sätze R: 35 S: (1/2)-26-30-45 MAK 0,1 mg·m−3 (gemessen als einatembarer Aerosolanteil) [1]
LD50 2140 mg·kg−1 (Ratte, oral)[4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Schwefelsäure (nach IUPAC-Nomenklatur Dihydrogensulfat, veraltet Vitriolöl) ist eine chemische Verbindung des Schwefels mit der Summenformel H2SO4. Sie ist eine farblose, ölige, sehr viskose und hygroskopische Flüssigkeit. Schwefelsäure ist eine der stärksten Säuren und wirkt stark ätzend. Die Mineralsäure bildet zwei Reihen von Salzen, die Hydrogensulfate und die Sulfate, bei denen im Vergleich zur freien Säure ein beziehungsweise zwei Protonen durch Kationen ersetzt sind.
Schwefelsäure ist eine der technisch wichtigsten Chemikalien überhaupt und zählt zu den meistproduzierten chemischen Grundstoffen. 1993 wurden etwa 135 Millionen Tonnen Schwefelsäure produziert.[5] Sie wird vor allem in der Düngemittelproduktion und zur Darstellung anderer Mineralsäuren, etwa der Salz- oder Phosphorsäure verwendet. Verwendung findet sie überwiegend als konzentrierte oder verdünnte wässrige Lösung.
Das Anhydrid der Schwefelsäure ist das Schwefeltrioxid (SO3). Ist in der Schwefelsäure über das stöchiometrische Mengenverhältnis hinausgehend zusätzliches Schwefeltrioxid gelöst, wird die Lösung als rauchende Schwefelsäure oder Oleum bezeichnet, da sie das enthaltene Schwefeltrioxid leicht als Rauch abgibt. Verwandte Säuren sind die Schwefelige Säure H2SO3, die sich vom Schwefeldioxid ableitet und die Thioschwefelsäure H2S2O3, bei der ein Sauerstoffatom durch Schwefel ersetzt ist.
Inhaltsverzeichnis
Geschichte
Schwefelsäure ist unter dem alten Namen Vitriolöl schon seit langer Zeit bekannt. Erste Hinweise finden sich in den Texten des historisch umstrittenen Alchemisten Dschābir ibn Hayyān aus dem 8. Jahrhundert. Danach werden sie und mögliche Herstellungsverfahren auch in den alchimistischen Schriften des Albertus Magnus (1200–1280) und Basilius Valentinus (um 1600) erwähnt. Diese beschreiben Verfahren, um aus natürlich vorkommenden Sulfaten – etwa Chalkanthit oder Alaun – Vitriolöl zu gewinnen. Der Name Vitriolöl leitet sich von der veralteten Bezeichnung Vitriol für diese Minerale ab. Die erste Quelle für größere Mengen Schwefelsäure war Eisenvitriol. Ab dem 16. Jahrhundert wurde in Böhmen, Sachsen und am Harz nach dem Vitriolverfahren Schwefelsäure hergestellt.[6] Nach dem ersten Produktionsort Nordhausen wurde das Produkt Nordhäuser Vitriol genannt.[7] Erste wissenschaftliche Untersuchungen mit Schwefelsäure führte Johann Rudolph Glauber durch. Er ließ die Säure auf Kochsalz einwirken und erhielt dabei die Salzsäure und das nach ihm benannte Glaubersalz Natriumsulfat.[8]
Die Verfahren, bei denen Sulfate eingesetzt wurden, waren allerdings sehr aufwändig und teuer. Um größere Mengen zu bekommen, wurde im 18. Jahrhundert ein Verfahren entwickelt, bei dem Schwefel und Salpeter in Glasgefäßen verbrannt wurden. Da die Glasgefäße sehr zerbrechlich waren, wurde 1746 durch John Roebuck die Reaktion erstmals in Bleibehältern durchgeführt. Nachdem 1793 Nicolas Clément-Désormes und Charles Bernard Désormes entdeckt hatten, dass durch den Einsatz von Luft die Salpetermenge deutlich gesenkt werden konnte, konnte das Bleikammerverfahren großtechnisch eingesetzt werden. Dies war insbesondere für das 1789[9] von Nicolas Leblanc erfundene und 1791 erstmals von ihm angewendete Leblanc-Verfahren zur Sodaproduktion wichtig. Das Verfahren wurde noch mehrmals, etwa durch die Entwicklung von Methoden zur Absorption der nitrosen Gase durch Joseph Louis Gay-Lussac, verbessert.[10] Es konnte damit eine kontinuierliche Produktionsführung erreicht werden.
Der größte Nachteil dieses Verfahrens lag jedoch darin, dass dabei eine maximale Säurekonzentration von 78 % erreichbar war und konzentriertere Lösungen sowie Oleum weiterhin über die aufwändige Destillation von Eisenvitriol hergestellt werden musste. Eine einfache Produktion höherkonzentrierter Schwefelsäure gelang erst nach Entwicklung des Kontaktverfahrens ab 1870.[11]
Vorkommen
Freie, nicht in Oxonium- und Sulfationen dissoziierte Schwefelsäure kommt in der Natur nur sehr selten vor. In der Atmosphäre bildet sie sich aus Schwefeldioxid, das bei der Verbrennung von schwefelhaltigen Substanzen oder bei Vulkanausbrüchen entsteht. Das Schwefeldioxid wird durch Hydroxyl-Radikale und Sauerstoff zu Schwefeltrioxid oxidiert. Mit Wasser bildet sich schließlich die freie Schwefelsäure. Weitere Oxidationsmittel, die eine Bildung von Schwefeltrioxid ermöglichen, sind Ozon oder Wasserstoffperoxid. Im sauren Regen gelangt sie dann in Form von verdünnter Säure (überwiegend als Hydrogensulfat und Sulfat) auf die Erde.
Eine geringe Menge freier Schwefelsäure kommt auch in manchen vulkanischen Quellen, den sogenannten Solfataren vor.
Im Gegensatz zur freien Säure sind ihre Salze, vor allem die Sulfate, in der Natur sehr viel häufiger. Es existieren viele verschiedene Sulfat-Minerale. Zu den bekanntesten und wichtigsten zählen Gips (CaSO4 · 2 H2O), Baryt (BaSO4), Chalkanthit (CuSO4 · 5 H2O) oder Glaubersalz (Na2SO4 · 10 H2O).
Außerhalb der Erde findet sich Schwefelsäure in der oberen Atmosphäre der Venus. Diese entsteht durch photochemische Reaktionen aus Schwefeldioxid und Wasser. Es bilden sich Tröpfchen, die 80–85 % Schwefelsäure enthalten. In tieferen Schichten zersetzt sich die Säure auf Grund der hohen Temperaturen in Schwefeldioxid, Sauerstoff und Wasser, die wieder aufsteigen und Schwefelsäure bilden können.[12]
Gewinnung und Darstellung
Grundstoff für die Schwefelsäureherstellung ist häufig elementarer Schwefel, der in großen Mengen (2007: 66 Millionen Tonnen[13]) bei der Entschwefelung von Erdgas und Rohöl anfällt und nach dem Claus-Prozess aufgearbeitet wird oder nach dem Frasch-Verfahren abgebaut wird. Dieser wird an der Luft verbrannt, um Schwefeldioxid als Ausgangsstoff für die eigentliche Darstellung zu gewinnen.
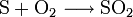
- Reaktion von Schwefel mit Sauerstoff
Eine weitere Quelle, bei der in großen Mengen Schwefeldioxid anfällt, ist die Verhüttung schwefelhaltiger Erze. Beispiele hierfür sind die Kupfer-, Zink- oder Bleigewinnung aus den entsprechenden Sulfiden. Das Schwefeldioxid bildet sich beim Rösten mit Luftsauerstoff.
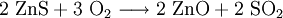
- Reaktion beim Rösten von Zinksulfid
Im Jahr 1999 wurden in Europa nur noch ca. 3 Mio. Tonnen Pyrit zur Schwefelsäuregewinnung geröstet. In Asien liegt der Anteil von Pyrit jedoch höher.[14]
Für rohstoffarme Staaten, die weder über Schwefel noch über sulfidische Erze verfügen, kommt das Müller-Kühne-Verfahren in Frage. Hierbei wird aus Gips und Kohle im Drehrohrofen Schwefeldioxid gewonnen. Der energieaufwendige Prozess kann rentabler gestaltet werden, wenn durch Zusatz von Sand und Ton als Nebenprodukt Zement anfällt. In der DDR wurde das Verfahren in großem Maßstab durchgeführt.
Für die weitere Produktion muss aus dem Schwefeldioxid Schwefeltrioxid gewonnen werden. Die direkte Reaktion von Schwefel und Sauerstoff zu Schwefeltrioxid findet nicht statt, da das Gleichgewicht in der Reaktion von Schwefeldioxid zu Schwefeltrioxid nur bei niedrigen Temperaturen auf der Seite des Schwefeltrioxids liegt. Bei diesen Temperaturen ist jedoch die Reaktionsgeschwindigkeit zu gering. Daher muss mit Hilfe geeigneter Katalysatoren die Reaktionsführung so gesteuert werden, dass eine ausreichend schnelle Reaktion bei nicht zu hohen Temperaturen gewährleistet ist.
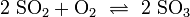
- Reaktion von Schwefeldioxid zu Schwefeltrioxid
Beim heutzutage ausschließlich angewendeten Kontaktverfahren wird Vanadiumpentoxid als sauerstoffübertragender Katalysator verwendet. Dabei wird bei der Reaktion von Schwefeldioxid zu Schwefeltrioxid zunächst das Vanadiumpentoxid zu Vanadium(IV)-oxid reduziert. Dieses wird in einem zweiten Reaktionsschritt durch Sauerstoff wieder oxidiert.
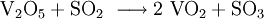
- Umsetzung von Schwefeldioxid zu Schwefeltrioxid
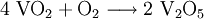
- Rückgewinnung des Katalysators
Die Temperatur während der Reaktion muss zwischen 420 und 620 °C[15] liegen, da bei tieferen Temperaturen der Katalysator inaktiv ist und er sich bei höheren Temperaturen zersetzt. Die Umsetzung wird in sogenannten Hordenkontaktöfen durchgeführt, bei denen der Katalysator in insgesamt vier Schichten (den „Horden“) übereinander angeordnet wird und das durchströmende Gas zwischen den Horden auf die passende Temperatur gekühlt wird.
Im sogenannten Doppelkontaktverfahren wird vor der letzten Horde das vorhandene Schwefeltrioxid mit konzentrierter Schwefelsäure ausgewaschen. Dies ermöglicht eine Erhöhung der Ausbeute auf 99,5 %.[15]
Nach Bildung des Schwefeltrioxids wird dieses zu Schwefelsäure umgesetzt. Dazu muss zunächst verbliebenes Schwefeldioxid mit Ammoniak oder Natriumthiosulfat entfernt werden. Da die direkte Reaktion von Schwefeltrioxid mit Wasser zu langsam ist, wird das Gas in konzentrierte Schwefelsäure geleitet. Dabei bildet sich schnell Dischwefelsäure H2S2O7. Wird diese mit Wasser verdünnt, zerfällt sie zu zwei Molekülen Schwefelsäure.
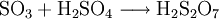
- Umsetzung von Schwefeltrioxid mit Schwefelsäure
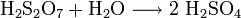
- Bildung der Schwefelsäure
Bei diesem Verfahren entsteht keine reine Schwefelsäure, sondern konzentrierte Säure mit 98 % Säuregehalt. Um reine Schwefelsäure zu erzeugen, muss die Menge Schwefeltrioxid in die konzentrierte Säure eingeleitet werden, die der Stoffmenge des überschüssigen Wassers der konzentrierten Säure entspricht.
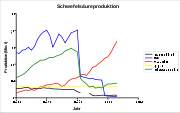
In den letzten Jahren ist die Schwefelsäureproduktion vor allem in China stark gestiegen, während in europäischen Ländern wie Deutschland die Produktion zurückgegangen ist. Die in der Graphik zu sehenden starken Umbrüche in den Jahren 1990 und 1991 sind auf die Auflösung der Sowjetunion und eine Änderung der Statistik in den Vereinigten Staaten zurückzuführen.[16]
Eigenschaften
Physikalische Eigenschaften
Schwefelsäure ist eine zähflüssige, farblose Flüssigkeit, die unterhalb von 10,37 °C erstarrt. Die häufige leicht braune Färbung von technischer Schwefelsäure beruht auf organischen Verunreinigungen. Oberhalb des Siedepunktes von 279,6 °C bilden sich Schwefelsäuredämpfe, die auch überschüssiges Schwefeltrioxid enthalten. Bei einer Temperatur von 338°C hat der Dampf einen Säuregehalt von 98 % und entspricht damit einem azeotropen Wasser-Schwefelsäure-Gemisch. Beim weiteren Erhitzen zersetzt sich die Schwefelsäure in Wasser und Schwefeltrioxid und ist bei 450 °C nahezu vollständig dissoziiert.
Als Feststoff kristallisiert Schwefelsäure im monoklinen Kristallsystem in der Raumgruppe C2/c. Die Gitterparameter sind a = 814 pm, b = 470 pm, c = 854 pm und β = 111°.[18] Die Struktur ist eine gewellte Schichtstruktur, in der jeder Sulfat-Tetraeder über Wasserstoffbrücken mit vier weiteren Tetraedern verbunden ist. Neben der kristallinen reinen Schwefelsäure sind auch mehrere Schwefelsäure-Hydrate bekannt. Ein Beispiel ist das Dihydrat H2SO4 · 2 H2O, das ebenfalls im monoklinen Kristallsystem mit der Raumgruppe C2/c kristallisiert.[19]. Insgesamt sind sechs verschiedene Hydrate mit einem, zwei, drei, vier, sechs und acht Äquivalenten Wasser bekannt, bei denen die Säure vollständig in Oxonium- und Sulfationen gespalten sind. Die Oxoniumionen sind je nach Hydrat mit einer unterschiedlich großen Anzahl Wassermolekülen assoziiert. Das Schmelzpunkt dieser Hydrate sinkt mit zunehmender Anzahl Wassermolekülen. So schmilzt das Monohyrat bei 8,59 °C, während das Octahydrat schon bei -62 °C schmilzt.[15]
Zwischen den einzelnen Molekülen wirken starke Wasserstoffbrücken, die die hohe Viskosität von 24,6 mPa·s bei 25 °C[20] bedingen. Im Vergleich dazu besitzt Wasser mit 0,89 mPa·s bei 25 °C[11] eine deutlich niedrigere Viskosität.
Ähnlich wie reines Wasser leitet reine Schwefelsäure in geringem Maße elektrischen Strom. Die spezifische Leitfähigkeit beträgt 1,044 · 10−2 S/cm.[20] Der Grund hierfür liegt in der geringen Dissoziation der Säure durch Autoprotolyse. Verdünnte Säure leitet dagegen auf Grund der enthaltenen Oxoniumionen elektrischen Strom gut.

- Autoprotolysereaktion
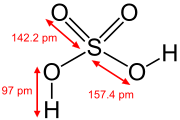
In der Gasphase liegen einzelne Schwefelsäure-Moleküle vor. Diese sind tetraedrisch aufgebaut mit Bindungswinkeln von 101,3° zwischen den OH-Gruppen und 123,3° zwischen den Sauerstoffatomen. Die Bindungslängen der Schwefel-Sauerstoff-Bindungen sind mit 157,4 pm (zu OH-Gruppen) beziehungsweise 142,2 pm (zu den Sauerstoffatomen) unterschiedlich. Die Molekülstruktur im Festkörper entspricht derjenigen in der Gasphase.[17]
Die Bindungen im Schwefelsäuremolekül können durch verschiedene mesomere Grenzstrukturen beschrieben werden. Beispiele sind die Struktur, bei der zwischen Schwefel und Sauerstoff Doppelbindungen angenommen werden und eine Struktur, bei der nur Einfachbindungen und gleichzeitig eine Ladungstrennung vorliegen. In theoretischen Berechnungen hat sich gezeigt, dass die d-Orbitale, die für die Beschreibung einer O-S-Doppelbindung nötig sind, nur sehr wenig zur Bindung beitragen. Daher wird die reale Bindungssituation im Schwefelsäuremolekül am genauesten durch diejenige Struktur beschrieben, bei der nur Einfachbindungen gezeichnet werden. Die verkürzte S-O-Bindung kann durch zusätzliche elektrostatische Wechselwirkungen zwischen den geladenen Atomen erklärt werden.[21]
Chemische Eigenschaften
Als starke Säure gibt Schwefelsäure leicht Protonen ab. Mit einem pKs-Wert von −3,9[2] (dies gilt jedoch nur für verdünnte Lösungen) oder genauer einem H0-Wert von −11,9[15] zählt Schwefelsäure in der ersten Protolysestufe zu den starken Säuren.
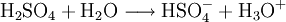
- Reaktion mit Wasser in der ersten Protolysestufe
Sie wird üblicherweise nicht zu den Supersäuren gezählt, jedoch wird sie als Ausgangspunkt für die Definition der Supersäure gewählt. Dabei werden alle Säuren, die stärker als reine Schwefelsäure sind und diese somit protonieren können, als Supersäuren bezeichnet.
Die zweite Protolysestufe von Hydrogensulfat zu Sulfat hat einen pKs-Wert von 1,96.[2] Das Hydrogensulfat-Ion ist daher eine nur mittelstarke Säure.
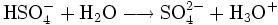
- Reaktion mit Wasser in der zweiten Protolysestufe
Aus diesem Grund liegt in verdünnter Schwefelsäure (Konzentration etwa 1 mol/l) zum größten Teil Hydrogensulfat vor. Das H2SO4-Molekül ist nahezu vollständig dissoziiert, während die Reaktion zum Sulfat nur in geringem Maße (etwa 1,3 % bei 1 mol/l[15]) stattfindet. Erst bei höheren Verdünnungen werden größere Mengen Sulfat gebildet.
Schwefelsäure besitzt eine hohe Affinität zu Wasser. Werden Säure und Wasser gemischt, entstehen unter starker Wärmeentwicklung verschiedene Hydrate der Form H2SO4 · n H2O (n = 1–4, 6, 8). Die starke Wasseraffinität der Schwefelsäure äußert sich ebenfalls darin, dass sie in der Lage ist, aus organischen Stoffen Hydroxylgruppen und Protonen abzuspalten. Durch diesen Entzug bleibt Kohlenstoff zurück, der organische Stoff wird schwarz und verkohlt. Dieser Effekt tritt vor allem bei Stoffen auf, die viele Hydroxylgruppen enthalten. Beispiele sind viele Kohlenhydrate wie Glucose oder Polysaccharide.
Konzentrierte Schwefelsäure wirkt oxidierend und ist in der Lage, beim Erhitzen auch edlere Metalle wie Kupfer, Quecksilber oder Silber zu lösen. Die Schwefelsäure wird dabei zu Schwefeldioxid reduziert.
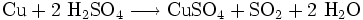
- Lösen von Kupfer in konzentrierter Schwefelsäure
Verdünnte Schwefelsäure wirkt dagegen nur in geringem Maße oxidativ, da die Reaktion zu Schwefeldioxid durch das Lösemittel Wasser gehemmt wird. Es werden nur solche Metalle oxidiert bzw. gelöst, die als unedle Elemente durch die Reaktion von Protonen zu Wasserstoff oxidiert werden können.
Verwendung
Schwefelsäure wird in sehr großen Mengen und in vielen Bereichen eingesetzt. Ihre Produktionsmenge gilt – neben der von Chlor – als Maßstab für die industrielle Entwicklung und den Leistungsstand eines Landes. Je nach Konzentration wird sie unterschiedlich bezeichnet. Zwischen 10 und 20 % spricht man von verdünnter Schwefelsäure oder Dünnsäure, die Akkumulatorsäure hat eine Säurekonzentration von 33,5 %, bis zu einem Gehalt von etwa 70 % spricht man von Kammersäure, bis zu 80 % von Gloversäure. Konzentrierte Schwefelsäure besitzt meist einen Gehalt von 98,3 % (Azeotrop).[22] Dünnsäure fällt in großen Mengen als Abfallprodukt in der Titanoxid- oder Farbstoffproduktion an.[23]
Der größte Teil wird in der Produktion von Düngemitteln verbraucht. Mit Hilfe von Schwefelsäure werden vor allem Phosphat- und Ammoniumsulfatdünger gewonnen. Letzterer wird durch Reaktion von halbkonzentrierter Schwefelsäure mit Ammoniak dargestellt.
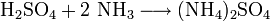
- Reaktion von Schwefelsäure mit Ammoniak
Bei der Produktion von Phosphatdüngern wird Schwefelsäure zum Aufschluss des Rohphosphates benötigt. Bei der Reaktion entsteht Superphosphat Ca(H2PO4)2/CaSO4
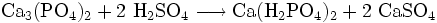
- Aufschluss von Apatit zu Superphosphat durch halbkonzentrierte Schwefelsäure
Neben Ammoniumsulfat werden auch andere Sulfate durch Umsetzung entsprechender Salze mit Schwefelsäure hergestellt. Ein Beispiel ist das aus Aluminiumhydroxid gewonnene Aluminiumsulfat, das in großen Mengen in der Papierindustrie und als Flockungsmittel in der Wasserreinigung verwendet wird.
Da zahlreiche Erze in Schwefelsäure löslich sind, kann sie als Aufschlussmittel eingesetzt werden. Beispiele sind das nasse Verfahren zur Zinkherstellung aus Zinkoxid und das Sulfatverfahren zur Gewinnung des Weißpigmentes Titandioxid. Mit Hilfe von Schwefelsäure können nicht nur oxidische Erze, sondern auch solche mit anderen Anionen wie Fluorid oder Phosphat aufgeschlossen werden. Bei der Reaktion entstehen dabei die entsprechenden Säuren. Dieses Verfahren ist für die Produktion von einigen technisch wichtigen Säuren relevant. Beispiele sind Flusssäure aus Fluorit, Phosphorsäure aus Apatit und Salzsäure aus Halit.
Als Batteriesäure ist Schwefelsäure ein wichtiger Bestandteil des Bleiakkumulators, wie er beispielsweise in Automobilen als Starterbatterie eingesetzt wird. Ebenso wie im Bleiakkumulator dient verdünnte Schwefelsäure auch in elektrolytischen Prozessen als Elektrolyt. Die Vorteile gegenüber anderen Elektrolyten liegen in der hohen Leitfähigkeit und gleichzeitig niedrigen Neigung zur Reduktion.
In der organischen Chemie kann durch rauchende Schwefelsäure die Sulfonsäuregruppe eingefügt werden (Sulfonierung). Damit werden vor allem Tenside für die Waschmittelindustrie und Farbstoffe hergestellt. Eine weitere funktionelle Gruppe, die mit Hilfe von Schwefelsäure eingeführt werden kann, ist die Nitrogruppe. Dies geschieht mit Hilfe der sogenannten Nitriersäure, einer Mischung aus Schwefel- und Salpetersäure. Verwendet wird dies vor allem zur Herstellung von Sprengstoffen, wie Trinitrotoluol oder Nitroglycerin.
In chemischen Laboratorien zählt Schwefelsäure zu den am häufigsten benutzten Chemikalien. Neben Salzsäure und Salpetersäure ist sie eine viel verwendete starke Säure. Sie wird unter anderem zur Einstellung des pH-Wertes, als Katalysator, etwa für Veresterungen und zum Abrauchen bei Aufschlüssen genutzt. Die stark wasserziehende Wirkung der Schwefelsäure wird zur Trocknung von organischen Substanzen und Gasen in Exsikkatoren und Waschflaschen genutzt.
Biologische Bedeutung
Die in der Luft aus Schwefeldioxid entstandene Schwefelsäure ist neben der aus Stickoxiden gebildeten Salpetersäure ein Bestandteil des sauren Regens. Durch den sauren Regen kann es vor allem in schwach gepufferten Böden und Gewässern zu einem Absinken des pH-Wertes kommen. Eine Auswirkung eines niedrigeren pH-Wertes ist eine Änderung der Löslichkeit einiger Metallionen. So ist das für Pflanzen schädliche Aluminium bei niedrigerem pH-Wert besser in Wasser löslich. Ebenso können biologisch wichtige Ionen, wie Kalium oder Magnesium leichter ausgewaschen werden. Aus diesen Gründen gilt Schwefelsäure als eine mögliche Ursache des Waldsterbens in den 1980er Jahren. [24] Durch technische Maßnahmen wie die Rauchgasentschwefelung bei Kohlekraftwerken und die Einführung schwefelarmer Kraftstoffe wird heute in Deutschland so wenig Schwefeldioxid freigesetzt, dass das Regenwasser hier deutlich weniger Schwefelsäure enthält.[25]
Schwefelsäure wirkt auf Fische und andere Gewässerlebewesen auf Grund ihrer Acidität toxisch. So beträgt in weichem Wasser ohne Pufferkapazität die mittlere letale Konzentration (der LC50-Wert) für Fische 100–330 mg/l.[5] Bei härterem Wasser, in dem die Säure in Sulfate umgewandelt wird, ist Schwefelsäure geringer toxisch, der LC50-Wert beträgt 15 g/l (bei Umwandlung in Natriumsulfat) beziehungsweise 2,98 g/l (Calciumsulfat).[5] In den Abraumhalden von Erzbergwerken und Braunkohletagebauen entsteht Schwefelsäure durch die Oxidation sulfidhaltiger Mineralien. Durch Regenwasser wird sie ausgewaschen und sammelt sich in Restseen, in denen wegen des niedrigen pH-Werts und hoher Schwermetallgehalte kaum Lebewesen zu finden sind. Dieser Vorgang wird als Acid Mine Drainage bezeichnet.
Sicherheitshinweise
Schwefelsäure wirkt auf Haut und Schleimhäute stark reizend und ätzend. Sie ist in der Lage, lebendes Gewebe zu zerstören (Verätzung). Die Wirkmechanismen von konzentrierter und verdünnter Schwefelsäure sind deutlich zu unterscheiden. Bei verdünnter Schwefelsäure wirkt die erhöhte Protonenkonzentration ätzend, d. h. die Wirkung ist derjenigen anderer verdünnter Säuren ähnlich. Die Wirkung besteht bei Hautkontakt, abhängig von der Konzentration, vorwiegend in lokalen Reizungen.[1] Sie ist damit deutlich ungefährlicher als konzentrierte Schwefelsäure. Diese wirkt auf Grund ihrer stark wasserziehenden Wirkung verkohlend und schädigt schon in kleinen Mengen Haut und Augen stark. Es bilden sich nur langsam heilende, schmerzhafte Wunden.[1] Schwefelsäure kann auch über Dämpfe aus der Luft aufgenommen werden, der MAK-Wert beträgt 0,1 mg/m3[1], der LC50-Wert beträgt bei Ratten über zwei Stunden inhalativ aufgenommen 510 mg/m3.[26]
Da bei der Reaktion von konzentrierter Schwefelsäure mit Wasser viel Wärme entsteht, darf sie nur durch Eingießen in Wasser und nicht durch Hinzufügen von Wasser zur Säure verdünnt werden. Wird Wasser zu Schwefelsäure hinzugegeben, kann diese leicht spritzen und so umstehende Personen verätzen.
Nachweis
Konzentrierte Schwefelsäure wird durch die Reaktion mit organischen Substanzen nachgewiesen. Wird etwa ein Holzspan in konzentrierte Schwefelsäure getaucht, wird er langsam schwarz. Es ist möglich, durch unterschiedliche Reaktionen verdünnte und konzentrierte Schwefelsäure zu unterscheiden. Dabei wird die unterschiedliche Reaktivität der beiden Säuren mit unedlen Metallen, wie Zink oder Eisen, ausgenutzt. Während sich bei verdünnter Säure schon bei Raumtemperatur Wasserstoff bildet, reagiert die konzentrierte Säure, die fast keine freien Oxoniumionen enthält, erst beim Erwärmen unter Bildung von Schwefeldioxid und Schwefel.[27]
Da in wässriger Lösung die Schwefelsäure dissoziiert ist, lässt sie sich darin nicht direkt nachweisen. Stattdessen kann man die Protonenkonzentration und damit den sauren pH-Wert über geeignete Indikatoren oder mit dem pH-Meter bestimmen. Das Sulfation lässt sich beispielsweise durch Fällung als schwerlösliches Bariumsulfat bestimmen.[27]
Einzelnachweise
- ↑ a b c d e f g h i j k Eintrag zu Schwefelsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 7. März 2008 (JavaScript erforderlich)
- ↑ a b c d Tabelle von Säurekonstanten von der ETH Zürich
- ↑ Eintrag zu CAS-Nr. 7664-93-9 im European chemical Substances Information System ESIS
- ↑ Sicherheitsdatenblatt (Carl Roth) 96 %ige Schwefelsäure
- ↑ a b c Schwefelsäure in: Roempp Chemie Lexikon, Thieme Verlag, 2007, online
- ↑ Schwefelsäure in: Meyers Großes Konversations-Lexikon. Leipzig 1905–1909, Band 18, S. 160–163.
- ↑ Claus Priesner: Johann Christian Bernhardt und die Vitriolsäure, in: Chemie in unserer Zeit, 1982, 16, 5, S. 149–159
- ↑ Walter Jansen: Zum Gedenken: Johann Rudolph Glauber, in: Chemikon, 2004, 11, 3, S. 15
- ↑ William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5
- ↑ Hermann Müller: Sulfuric Acid and Sulfur Trioxide, in: Ullmanns's Encyclopedia of Industrial Chemistry, 4. Auflage, 1984, doi:10.1002/14356007.a25_635
- ↑ a b N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, 1988, ISBN 3-527-26169-9
- ↑ V. A. Krasnopolsky, V. A. Parshev: Chemical composition of the atmosphere of Venus, in: Nature, 1981, 292, 610–613, doi:10.1038/292610a0
- ↑ U.S. Geological Survey, Mineral Commodity Summaries: Sulfur, January 2008
- ↑ E. R. Riegel und J. A. Kent: Riegel's Handbook of Industrial Chemistry. Springer 2003. ISBN 0-306-47411-5. p. 503
- ↑ a b c d e Holleman-Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, Berlin 2007. ISBN 978-3-11-017770-1.
- ↑ Schwefelsäureproduktion 1970–2003 der United Nations Statistics Division
- ↑ a b Robert L. Kuczkowski, R. D. Suenram, und Frank J. Lovas: Microwave Spectrum, Structure, and Dipole Moment of Sulfuric Acid, in: J. Am. Chem. Soc. 1981, 103, 2561–2566.
- ↑ C. Pascard-Billy: Structure Précise de l'Acide Sulfurique, in: Acta Cryst., 1965, 18, 827–829
- ↑ Inger Taesler, Ivar Olovsson: Hydrogen Bond Studies. XXXVII. The Crystal Structure of Sulfuric Acid Dihydrate (H3O+)2SO42−, in: J. Chem. Phys., 1969, 51, 4213; doi:10.1063/1.1671781
- ↑ a b Th. M. Klapötke, I. C. Tornieporth-Oetting: Nichtmetallchemie, Wiley-VCH, Weinheim, 1994, ISBN 3-527-29052-4
- ↑ Thorsten Stefan and Rudolf Janoschek: How relevant are S=O and P=O Double Bonds for the Description of the Acid Molecules H2SO3, H2SO4, and H3PO4, respectively? in: J. Mol. Model. 2000, 6, 282–288 doi:10.1007/PL00010730
- ↑ Hans Breuer: Allgemeine und anorganische Chemie. dtv-Atlas Chemie. Bd 1. dtv, München 2000 (9. Aufl.), ISBN 3-423-03217-0
- ↑ Dünnsäure bei umweltlexikon-online.de
- ↑ Saurer Regen in Umweltlexikon-online, Stand 8. Mai 2001
- ↑ Umweltbundesamt (D): Boden – Einträge aus der Atmosphäre, Stand 2. April 2008
- ↑ Sicherheitsdatenblatt (Merck), 96 %ige Schwefelsäure
- ↑ a b Jander, Blasius: Einführung in das anorganisch-chemische Praktikum; S.Hirzel, Leipzig 1995 (14. Aufl.), ISBN 3-7776-0672-3
Literatur
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage, Wiley-VCH, Weinheim, 1988, ISBN 3-527-26169-9.
- Th. M. Klapötke, I. C. Tornieporth-Oetting: Nichtmetallchemie. Wiley-VCH, Weinheim, 1994, ISBN 3-527-29052-4
- Schwefelsäure in: Roempp Chemie Lexikon, Thieme Verlag, 2007, online
- Hermann Müller: Sulfuric Acid and Sulfur Trioxide, in: Ullmanns's Encyclopedia of Industrial Chemistry, 4. Auflage, Wiley-VCH, 1984, doi:10.1002/14356007.a25_635
Weblinks
Wikimedia Foundation.