- Borgruppe
-
Gruppe 13 Hauptgruppe 3 Periode 2 5
B3 13
Al4 31
Ga5 49
In6 81
Tl7 113
UutAls Borgruppe bezeichnet man die 3. Hauptgruppe (nach neuer Nummerierung der IUPAC Gruppe 13) des Periodensystems. Sie enthält die Elemente Bor (B), Aluminium (Al), Gallium (Ga), Indium (In) und Thallium (Tl). Das künstlich hergestellte radioaktive Element Ununtrium (Uut), auch „Eka-Thallium“ genannt, zählt ebenfalls dazu.
Früher wurde z.T. die gesamte Borgruppe als „Erdmetalle“ bezeichnet, abgeleitet von der Tonerde, einem Aluminiumoxid (Al2O3). Dies war jedoch irreführend bzw. falsch, da Bor zu den Halbmetallen gerechnet wird. Heute werden als Erdmetalle, gemäß ihren Reaktionseigenschaften, stets nur die Elemente Aluminium (Al), Gallium (Ga), Indium (In), Thallium (Tl) und Ununtrium (Uut) bezeichnet.
Inhaltsverzeichnis
Eigenschaften
Das erste Element der Gruppe, Bor, unterscheidet sich aufgrund seiner halbmetallischen Eigenschaften wesentlich von den weiteren Elementen der Borgruppe, die allesamt Metalle sind und in ihren Eigenschaften den Erdalkalimetallen ähneln.
Physikalische Eigenschaften
Mit zunehmender Ordnungszahl wachsen Atommasse, Atomradius und Ionenradius. Den höchsten Schmelzpunkt hat Bor mit 2076 °C, den niedrigsten Gallium mit nur 29,76 °C (Körpertemperatur: ~37 °C). Dazwischen liegen Indium (156,6 °C), Thallium (304 °C) und Aluminium (660,32 °C). Die Siedepunkte nehmen von oben nach unten ab: Bor hat mit 3927 °C den höchsten Wert, danach folgen Aluminium (2467 °C), Gallium (2204 °C), Indium (2072 °C) und schlussendlich Thallium (1473 °C).
Mit steigender Ordnungszahl wächst die Dichte, während die Härte abnimmt. Bor hat mit 2,460 kg/dm3 die geringste Dichte und mit 9,3 die höchste Mohshärte, bei Thallium ist es mit einer Dichte von 11,850 kg/dm3 und einer Mohshärte von nur 1,2 genau umgekehrt.
Die höchste elektrische Leitfähigkeit hat Aluminium mit 37,7 MS/m (etwa ein Drittel weniger als Kupfer (58 MS/m)), die geringste weist Bor mit 10 mS/m auf.
Die 1. Ionisierungsenergie sinkt mit wachsender Ordnungszahl von 8,298 eV bei Bor auf 5,786 eV bei Indium ab, wobei Gallium jedoch mit 5,999 eV (anstatt des Aluminiums mit 5,968 eV) an zweiter Stelle steht. Thallium hat mit 6,108 eV einen erhöhten Wert.
Die Elektronegativität ist bei Bor mit 2,0 am größten, erreicht mit 1,5 bei Aluminium einen vorläufigen Tiefpunkt und steigt dann wieder auf 1,8, den Wert von Gallium, an. Im weiteren Verlauf sinkt die Elektronegativität wieder auf den Wert 1,4 (Thallium).
Bei sehr niedrigen Temperaturen leiten Aluminium, Gallium, Indium und Thallium elektrischen Strom ohne Widerstand. Sie werden zu Supraleitern.
Element Schmelzpunkt in K Siedepunkt in K Dichte in kg/m3 Mohshärte El. Leitfähigkeit in S/m Bor 2349 4200 2460 9,3 1 · 10−4 Aluminium 933,47 2740 2700 2,75 37,7 · 106 Gallium 302,91 2477 5904 1,5 6,76 · 106 Indium 429,75 2345 7310 1,2 11,6 · 106 Thallium 577 1746 11850 1,2 6,17 · 106 Elektronenkonfiguration
Die Elektronenkonfiguration lautet [X] ys2yp1. Das X steht hierbei für die Elektronenkonfiguration des eine Periode höher stehenden Edelgases, und für das y muss die Periode eingesetzt werden, in der sich das Element befindet. Ab Gallium ist auch ein (y-1)d10-Orbital vorhanden; und ab Thallium findet sich auch ein (y-2)f14-Orbital.
Für die einzelnen Elemente lauten die Elektronenkonfigurationen:
- Bor: [ He ] 2s22p1
- Aluminium: [ Ne ] 3s23p1
- Gallium: [ Ar ] 3d104s24p1
- Indium: [ Kr ] 4d105s25p1
- Thallium: [ Xe ] 4f145d106s26p1
- Ununtrium (berechnet): [ Rn ] 5f146d107s27p1
Der Oxidationszustand ist +3. Nur Thallium und Indium kommen auch mit der Oxidationszahl +1, die bei Thallium sogar häufiger als +3 auftritt, vor.
Chemische Reaktionen
In den folgenden Gleichungen steht das Me für ein Element aus der dritten Hauptgruppe (Borgruppe).
- Reaktion mit Sauerstoff:

- Thallium bildet auch Tl2O
- Reaktion mit Wasserstoff (nicht spontan):

- Nur Bor und Aluminium reagieren zu (immer kovalenten) Wasserstoffverbindungen. Bei Bor entstehen durch Dreizentrenbindung die strukturell vielfältigen Borane mit Diboran (B2H6) als einfachstem Vertreter, das hypothetische Monomer BH3 existiert nicht. AlH3-Moleküle sind durch Wasserstoffbrücken verbunden.
- Reaktion mit Wasser:

- Nur Aluminium setzt aus Wasser Wasserstoff frei, bildet jedoch eine Passivierungsschicht.

- Thallium bildet auch TlCl.
Verbindungen
- Oxide (III), Hydroxide und Säuren
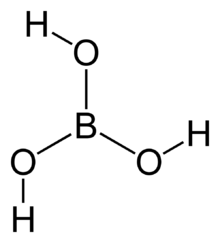
- In Bortrioxid (B2O3) („Wasserfreie Borsäure“) ist der Sauerstoff kovalent gebunden. Die hygroskopische Substanz bildet mit Wasser die sehr schwache Borsäure (H3BO3).
- Aluminiumoxid (Al2O3) („Tonerde“) ist eine ebenfalls hygroskopische, in Säuren und Basen lösliche Substanz. Mit Wasser bildet es Aluminiumhydroxid (Al(OH)3), eine amphotere Verbindung.
- Gallium(III)-oxid (Ga2O3) bildet mit Wasser Galliumhydroxid (Ga(OH)3).
- Indium(III)-oxid (In2O3) bildet mit Wasser Indiumhydroxid (In(OH)3), eine basisch reagierende Verbindung.
- Thallium(III)-oxid (Tl2O3) reagiert mit Wasser zur ebenfalls basischen Verbindung Thallium(III)-hydroxid (Tl(OH)3).
- Wasserstoffverbindungen
- Borane ((BH3)n) sind flüssig oder gasförmig und haben einen unangenehmen Geruch. Sie sind meist giftig, explosionsgefährlich und sehr reaktiv. Zwei Boratome und zwei Wasserstoffatome werden dabei durch nur zwei Elektronenpaare zusammengehalten, wodurch zwei Dreizentrenbindungen der Form B-H-B erkennbar sind.
- Aluminiumhydrid ((AlH3)n) („Alan“) ist ein hochpolymeres, gegen Luft und Feuchtigkeit empfindliches Pulver, das oberhalb von 100 °C zerfällt. Über Wasserstoffbrücken sind die AlH3-Moleküle koordinativ verbunden.
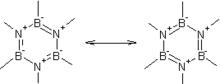 Bornitrid hat eine aromatische Struktur
Bornitrid hat eine aromatische Struktur
- sonstige:
- Carborane sind kohlenstoffhaltige Borane (meist B10C2H12)
- Borcarbid (B13C2) hat eine höhere Ritzhärte als Diamant und wird als Schleifmittel oder als Material für verschleißfeste Objekte verwendet.
- BN: Verbindungen von Bor mit Stickstoff im Verhältnis 1:1 ähneln in ihrem Aufbau stark den Modifikationen des Kohlenstoffs, da das beim Bor fehlende Elektronenpaar vom Stickstoff beigesteuert wird.
-
-
- Bornitrid hat eine graphitähnliche Schichtstruktur.
- Borazon (Anorganischer Diamant) ist eine sehr harte Verbindung mit Diamantgitter.
- Daneben existiert noch eine fullerenartige Modifikation.
-
-
- Aluminiumchlorid (AlCl3) ist hygroskopisch und raucht an feuchter Luft. Der Rauch besteht aus den Hydrolyseprodukten Salzsäure (HCl) und Aluminiumhydroxid (Al(OH)3)
- Aluminiumsulfat (Al2(SO4)3 · 12 H2O) bildet farblose Kristalle. Die wasserfreie Form ist ein weißes Pulver.
- Aluminiumlegierungen verbessern die werktechnischen Eigenschaften von Aluminium. Die bekannteren sind Dural (4 % Cu, 0,3 % Mg, 1 % Mn und 0,5 % Si), Magnalium (3–9 % Mg) und Silumin (max. 14 % Si)
- Galliumchlorid (GaCl3) bildet farblose Kristalle.
- Gallium(III)-Verbindungen mit Elementen der 5. Hauptgruppe sind Halbleiter.
-
-
- Galliumnitrid (GaN)
- Galliumphosphid (GaP)
- Galliumarsenid (GaAs)
- Galliumantimonid (GaSb)
-
-
- Einige Galliumlegierungen sind Supraleiter.
-
-
- V3Ga (Sprungtemperatur 16,8 K)
- Nb3Ga (Sprungtemperatur 14 K)
- ZrGa3 (Sprungtemperatur 10 K)
-
-
- Indium(III)-chlorid (InCl3) bildet hygroskopische Kristallplättchen. In der Gasphase liegt es (wie alle Indiumhalogenide) als dimeres Molekül vor. Die Verbindung bildet oft Doppelsalze mit dem Chlorido-Komplex InCl63−.
- Legierungen mit den Elementen der 5. Hauptgruppe dienen als Halbleiter. In Transformatoren und Spulen werden sie als Ferromagnete eingesetzt.
- Thallium(I)-sulfat (Tl2SO4) bildet farblose, hochgiftige Kristalle.
- Im Natriumthallid (NaTl) bilden die Tl−-Ionen ein Diamantgitter, in dessen Zwischenräume Na+-Ionen eingelagert sind (siehe auch Zintl-Phasen).
- Thallium(I)-alkoxide entstehen aus Alkoholen und Thallium und bilden würfelförmigen Tetramere.
- Thallium(I)-oxid und Thallium(I)-hydroxid
Vorkommen
Die Erdkruste besteht zu 7,3 % aus Elementen der Borgruppe, die meist als Oxide vorliegen. Davon entfallen 99,94 % auf Aluminium, das häufigste Metall in der Erdkruste. Die übrigen Elemente der Borgruppe sind selten.
Diese 0,06 % teilen sich wie folgt auf:
-
- 51 % Bor
- 46 % Gallium
- 3 % Indium
- 0,2 % Thallium.
Aluminiumhaltige Mineralien:
Kein Element der Borgruppe tritt gediegen auf.
Weblinks
- Beschreibung der 3. Hauptgruppe auf www.rutherford.de
- Eigenschaften (Tabelle)
- Beschreibung der Borgruppe mit Abbildungen und Reaktionsmechanismen
Literatur
- Hans Breuer: dtv-Atlas Chemie (Band 1: Allgemeine und anorganische Chemie). S. 114-129 (2000), ISBN 3-423-03217-0
Alkalimetalle | Erdalkalimetalle | Scandiumgruppe | Titangruppe | Vanadiumgruppe | Chromgruppe | Mangangruppe | Eisengruppe | Cobaltgruppe | Nickelgruppe | Kupfergruppe | Zinkgruppe | Borgruppe | Kohlenstoffgruppe | Stickstoffgruppe | Chalkogene | Halogene | Edelgase
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Borgruppe — Bor|grup|pe; Syn.: Bor Aluminium Gruppe: Sammelbez. für die Elemente der 13. Gruppe (früher: 3. Hauptgruppe) des Periodensystems, nämlich Bor, Aluminium, Gallium, Indium u. Thallium … Universal-Lexikon
Erdmetalle — … Deutsch Wikipedia
Gruppe-13-Element — … Deutsch Wikipedia
Elementfamilie — Unter einer Gruppe des Periodensystems versteht man in der Chemie jede Spalte des Periodensystems. Alle Elemente einer Gruppe besitzen die gleiche Anzahl an Valenzelektronen und haben daher ähnliche chemische Eigenschaften. Es gibt insgesamt 18… … Deutsch Wikipedia
Gruppe (Chemie) — Unter einer Gruppe des Periodensystems versteht man in der Chemie jede Spalte des Periodensystems. Alle Elemente einer Gruppe besitzen die gleiche Anzahl an Valenzelektronen und haben daher ähnliche chemische Eigenschaften. Es gibt insgesamt 18… … Deutsch Wikipedia
Superactinide — Unter einer Gruppe des Periodensystems versteht man in der Chemie jede Spalte des Periodensystems. Alle Elemente einer Gruppe besitzen die gleiche Anzahl an Valenzelektronen und haben daher ähnliche chemische Eigenschaften. Es gibt insgesamt 18… … Deutsch Wikipedia
3-5-Halbleiter — Gruppe 13 14 15 Periode Schale 2 … Deutsch Wikipedia
3-5-Verbindungshalbleiter — Gruppe 13 14 15 Periode Schale 2 … Deutsch Wikipedia
4. Hauptgruppe — … Deutsch Wikipedia
Gruppe-12-Element — … Deutsch Wikipedia