- Benigne Prostatahyperplasie
-
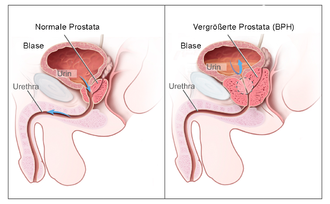
Klassifikation nach ICD-10 N40 Prostatahyperplasie ICD-10 online (WHO-Version 2011) Als benigne Prostatahyperplasie (BPH), früher auch als Prostataadenom (PA) oder fälschlich benigne Prostatahypertrophie genannt, wird eine gutartige Vergrößerung der Prostata (Vorsteherdrüse) durch Vermehrung ansonsten unauffälliger Zellen bezeichnet. Zu einer BPH kommt es gewöhnlich bei Männern im mittleren bis höheren Lebensalter. Es handelt sich um eine Vergrößerung von Prostatadrüse und Anteilen des Zwischengewebes, die zumeist von der sogenannten zentralen Zone ausgeht, welche die Harnröhre umgibt. Dieser gutartigen Drüsenvergrößerung kommt nur bei gleichzeitigem Auftreten von Symptomen wie beispielsweise nächtlichem Wasserlassen, Harnverhalt oder abgeschwächtem Harnstrahl bei gleichzeitig massiv erhöhten Blasenentleerungsdruck ein Krankheitswert zu. Das Krankheitsbild ist mittels moderner Methoden gut behandelbar, unbehandelt kann die Prostata aber grundsätzlich so lange wachsen, bis sie den Blasenauslass völlig verschließt und der Betroffene dann einer Urämie infolge Harnstau erliegt.
Der Begriff benigne Prostatahyperplasie beschreibt die Volumenzunahme der Prostata als solche, nicht durch sie bedingte klinische Befunde oder Symptome. Gleichbedeutend findet sich in der Literatur auch der Anglizismus Benign Prostatic Enlargement (BPE). Führt die BPH zu einer Erhöhung des Blasenauslasswiderstandes, so wird dies als benigne Prostataobstruktion (BPO) oder auch mit dem englischen Begriff Bladder outlet obstruction (BOO) bezeichnet. Ist die BPH beispielsweise Ursache entsprechender Beschwerden bei der Miktion, den sogenannten Symptomen des unteren Harntraktes (Lower Urinary Tract Symptoms, LUTS), wird von einem benignen Prostata-Syndrom (BPS) gesprochen.[1] Noch heute finden sich die veralteten Begriffe Prostataadenomträger für beschwerdefreie Patienten mit BPH und Prostataadenomkranke für Patienten mit BPS in der Literatur.[2]
Inhaltsverzeichnis
Verbreitung
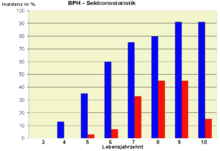
Die BPH ist der häufigste gutartige Tumor beim Mann. In den ersten Lebensjahrzehnten des Mannes ist sie sehr selten, ab dem 6. Lebensjahrzehnt findet sich jedoch bei 50 % aller Männer eine Vergrößerung der Prostata. Die Prävalenz steigt bis auf über 90 % im 9. Lebensjahrzehnt. Das Risiko daran zu erkranken, liegt bei 10–20 % in der Altersgruppe 50 bis 59 Lebensjahre und 25–35 % in der Altersgruppe von 60 bis 69 Jahre.[4] Aufgrund ihrer hohen Krankheitshäufigkeit gilt die BPH als Volkskrankheit.
Das Auftreten einer BPH ist jedoch nicht nur auf den Menschen beschränkt. Auch bei (nicht kastrierten) Rüden kann sie vorkommen.[5] Bei anderen Haustieren spielt sie allerdings keine Rolle.[6]
Ursache und Entstehung
→ Zum anatomischen Aufbau siehe Hauptartikel: Prostata
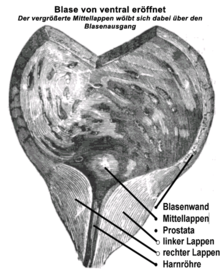
Die Harnröhre verläuft unterhalb der Blase ein Stück weit durch die Vorsteherdrüse. Diese besteht aus einem linken und rechten Lappen, sowie einem hinter der Harnröhre gelegenen Anteil der als Isthmus prostatae oder als Mittellappen bezeichnet wird. Eine BPH entsteht durch eine Zellvermehrung in der sogenannten Übergangszone und den um die Harnröhre herum angelegten (periurethralen) Drüsen. Dabei vermehren sich jedoch nicht ausschließlich die Drüsenzellen, sondern auch Bindegewebe und Muskelzellen – deshalb ist auch der früher geläufige Begriff Prostataadenom fachlich nicht korrekt. Bei entsprechend ausgeprägter Vergrößerung wird dabei die „periphere Zone“ der Prostata – sie macht normalerweise drei Viertel der Organmasse aus – nach außen abgedrängt und dabei soweit gedehnt, dass sie im Schnittbild das Organ nur noch als dünne Schicht, die sogenannte chirurgische Kapsel umgibt. Der Isthmus prostatae (Lobus medius, Mittellappen) kann sich zudem weit in das Blaseninnere vorwölben. Das normale Gewicht der Prostata beträgt normalerweise etwa 20 bis 25 Gramm. Bei Vorliegen einer BPH wiegt die Prostata 30 bis 150 Gramm. In der Summe stellt die BPH ein Hindernis für den Harnabfluss aus der Blase dar (subvesikale Obstruktion, also unterhalb der Harnblase). Bei normalem Miktionsdruck (Druck, den die Blasenwand aufbaut, um den Harn auszutreiben) ist dann die Harnflussrate reduziert. Ein kompensatorisch erhöhter Miktionsdruck kann zu einer Balkenblase oder autonomen Detrusorkontraktionen (Overactive Bladder, OAB) führen[7][8] Zusätzliche Bedeutung kommt dem sich in das Innere der Harnblase vorwölbenden (daher im klinischen Sprachgebrauch auch als intravesikal gelegen bezeichnet[9]) vergrößerten Mittellappen zu, der den Blasenausgang verlegen kann. Dieser Effekt kann unabhängig von der unterhalb der Blase bestehenden Einengung der Harnröhre auftreten.
Seit der ersten Hälfte des 20. Jahrhunderts ist bekannt, dass für die Entstehung einer BPH das männliche Geschlechtshormon Testosteron wesentlich ist. Männer, die kein Testosteron bilden, entwickeln auch keine BPH. Die genaue Ursache dafür ist jedoch bislang noch Gegenstand der wissenschaftlichen Forschung. Die Testosteronwerte im Blutserum korrelieren beispielsweise nicht mit der Entwicklung einer BPH,[4][10] zumal nicht Testosteron, sondern Dihydrotestosteron das essentielle Steroid der Prostata ist. So kommt diesem auch als Wachstumsfaktor der Vorsteherdrüse besondere Bedeutung zu. Gebildet wird es im Drüsenkörper durch Umwandlung mittels 5-alpha-Reduktase aus Testosteron.[11][12]
Klinische Erscheinungen
Entscheidend für den Krankheitswert sind Symptome, die anfangs meist „nur“ die Lebensqualität beeinträchtigen und objektivierbare krankhafte Befunde. Im weiteren Verlauf kann eine unbehandelte BPH dann zu Harnverhalt und Aufstau des Urinabflusses und damit verbunden Schädigungen der Nieren und so letztlich im Endstadium auch zum Tod durch Urämie führen.
Typisch für die BPH sind Reizbeschwerden und Entleerungsstörungen beim Wasserlassen (Miktion). Typische Reizbeschwerden sind Schmerzen beim Wasserlassen, häufiger, nächtlicher sowie plötzlich auftretender Harndrang – also Symptome ähnlich einer Blasenentzündung. Entleerungsstörungen sind gekennzeichnet durch erschwertes, lang andauerndes und durch Bauchpresse unterstütztes Wasserlassen. Als Symptome treten verzögerter Miktionsbeginn, ein schwacher, häufig unterbrochener Harnstrahl, verlängerte Miktionszeit, Nachträufeln bis hin zur Restharnbildung in der Blase auf.
Die BPH wird (nach Alken) in drei Stadien eingeteilt:
- Im Stadium I, das auch als Reizstadium bezeichnet wird, finden sich klinische Symptome wie ein abgeschwächter Harnstrahl, Nachträufeln nach der Miktion, auffällig häufiges (Pollakisurie) auch nächtliches Wasserlassen (Nykturie). Eine Restharnbildung fehlt jedoch. Bereits in diesem Stadium können die Beschwerden beim Wasserlassen am Arbeitsplatz und im Privatleben stören, auch das seelische Wohlbefinden und Sexualität können erheblich eingeschränkt sein. Die Symptome können so belastend sein, dass die betroffenen Männer soziale Kontakte so weit wie möglich einschränken (soziales Rückzugsverhalten). Eine Untersuchung von Wissenschaftlern der Universität Witten/Herdecke an 469 Patienten dokumentierte einen klaren Zusammenhang zwischen den BPH-spezifischen Symptomen und der gesundheitsbezogenen Lebensqualität; unter anderem zeigte sich eine deutlich verschlechterte allgemeine Lebensqualität und eine starke Beeinträchtigung der sozialen Aktivitäten, wozu auch das Sexualleben zählt.[13]
- Im Stadium II (Stadium der kompensierten Harnretention) nehmen die klinischen Beschwerden zu und die Restharnmenge beträgt 50–100 ml, bei gleichzeitiger Abnahme der funktionellen Blasenkapazität.
- Für das Stadium III (Stadium der dekompensierten Harnretention) sind Harnverhalt und Überlaufblase (Ischuria paradoxa) typisch. Zudem können eine zunehmend verminderte Nierenfunktion (bis hin zur Urämie), Stauungsnieren, Balkenblase und Blasenpseudodivertikel auftreten.
Untersuchung
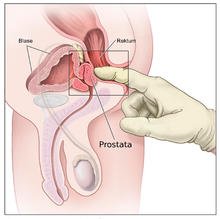
Eine Vergrößerung der Prostata wird bei der rektal-digitalen Untersuchung ertastet und kann, sofern notwendig, mittels rektaler Ultraschalluntersuchung ausgemessen werden. Beschwerden sind mittels urodynamischer Untersuchung objektivierbar, wobei ein erniedrigtes Harnstrahlvolumen und eine relevante Restharnbildung typisch sind. Ein Aufstau der Harnwege kann, sofern die Notwendigkeit dazu besteht, mittels Ultraschall oder Urogramm dargestellt werden. Ziel der Untersuchung ist es herauszufinden, inwieweit die Beschwerden des Patienten mit der BPH in Zusammenhang stehen. Des Weiteren wird abgeklärt, ob ein Behandlungsbedarf besteht und wenn ja, welche Therapieform die geeignetste ist. Kommen zudem dabei von der BPH unabhängige, auffällige Befunde zutage (Screening), wie beispielsweise ein auffälliger Tastbefund, ein PSA-Wert über 4 oder unklare, sonographische Inhomogenität der Drüse, sind weiterführende Untersuchungen zum Ausschluss eines Prostatakrebses angezeigt.
Anamnese und körperliche Untersuchung
Bei entsprechenden Beschwerden wird eine Anamnese unter besonderer Berücksichtigung von Miktion, Makrohämaturie (sichtbares Blut im Urin), Voroperationen, Harnwegsinfektionen, Diabetes mellitus, Herzinsuffizienz und vorbestehender neurologischer Krankheitsbilder und Medikamenteneinnahme (bezüglich potenziell miktionsbeinflussender Stoffe wie Anticholinergika, Psychopharmaka oder Antidepressiva) durchgeführt.
Der Leidensdruck wird meist mit dem internationalen Prostatasymptomenscore (IPSS) klassifiziert. Dabei werden für sieben Symptome jeweils null bis fünf Punkte vergeben: Restharngefühl, erneuter Harndrang zwei Stunden nach dem letzten Toilettengang, Harnstottern, Unfähigkeit, das Wasserlassen hinauszuzögern, schwacher Strahl, Pressen beim Wasserlassen und Häufigkeit von nächtlichem Wasserlassen. In manchen Fragebögen wird zusätzlich noch eine Frage zur Lebensqualität gestellt. Nach diesem Punktesystem werden die Patienten in solche mit milder (IPSS < 8), mittlerer (8 ≤ IPSS ≤ 19) und schwerer (20 ≤ IPSS ≤ 35) Symptomatik eingeteilt. Eine Therapie wird in der Regel ab einem Wert von größer 7 und bestehendem Leidensdruck begonnen.[1]
Die körperliche Untersuchung besteht insbesondere aus der rektal-digitalen Tastuntersuchung, bei der nicht nur die Prostata beurteilt wird, sondern auch der Analsphinktertonus (Spannung des Schließmuskels des Afters) und der Bulbo-cavernosus-Reflex. Ergänzend wird ein orientierender motorischer und sensorischer Status des Dammes, der Genitale und der unteren Extremitäten erhoben.
Laboruntersuchungen
Der Urin wird auf Blut und Zeichen eines Harnwegsinfektes untersucht. Der PSA-Spiegel im Blut wird insbesondere im Hinblick auf den weitgehenden Ausschluss eines Prostatakarzinoms (unter 4,0 ng/ml) bestimmt.[14] Ergänzend kann daraus auch die Progression der BPH abgeschätzt werden.[1] Eine Bestimmung des Serumkreatinins gibt Hinweise auf eine stauungsbedingte Niereninsuffizienz und ist vor einem Urogramm obligat.
Apparative Untersuchung
Mithilfe der Harnstrahlmessung (Ermittlung des Harnstrahlvolumens pro Zeiteinheit – Uroflowmetrie) können, sofern das Miktionsvolumen über 150 ml liegt, bei Screeninguntersuchungen Hinweise auf Störungen der Blasenentleerung erkannt werden. Die maximale Harnflussrate sollte dabei in der Regel nicht unter 10 ml/s liegen. Der Einsatz der Methode zu Erkennung einer BPH bedingten Obstruktion ist unsicher.[1]
Sonographisch werden insbesondere Restharn- und Prostatavolumen beurteilt. Sie ermöglicht auch die Erkennung eines (meist urodynamisch besonders relevanten) vergrößerten Mittellappens. Die Ultraschalluntersuchung wird meist transrektal ausgeführt, ermöglicht aber auch transabdominal eine gute Bestimmung des Restharnvolumens und bei voller Blase auch von Prostatavolumen und endovesikalem Mittellappen. Die erhobenen Befunde werden zur Beurteilung des Progressionsrisikos und der Notwendigkeit einer Behandlung verwendet. Eine pathologisch erhöhte Restharnmenge alleine ist nicht beweisend für eine den Harnfluss behindernde BPH. Mittels Sonographie des oberen Harntraktes kann eine relevante Harnstauung ausgeschlossen werden.
Die Durchführung eines Urogramms ist bei Verdacht auf eine Erkrankung der Nieren angezeigt.
Fakultative Untersuchungen
Diese Untersuchungen werden in Fällen durchgeführt, bei denen es nach Abschluss der oben dargestellten Diagnostik noch einer weiterführenden differentialdiagnostischen Abklärung bedarf. In einem Miktionsprotokoll werden die Trinkmenge sowie Miktionsfrequenz und -volumen festgehalten. Dadurch kann beispielsweise eine Pollakisurie von einer Polyurie unterschieden werden. Mit Hilfe der Urodynamik kann die Harnflussrate mit dem zeitlichen Verlauf des in der Blase aufgebauten Miktionsdruckes abgeglichen werden. Diese Untersuchung ermöglicht beispielsweise die Abgrenzung bei abgeschwächtem Harnstrahl zwischen einem subvesikalen Hindernis (BPH) und einer Schwäche der Blasenmuskulatur. Mittels sonographischer Messung der Detrusordicke kann die obstruktive Wirkung der BPH abgeschätzt werden. Bei besonderen Fragestellungen werden auch noch weitere Verfahren wie die Urethrozystoskopie eingesetzt.
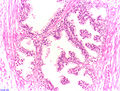
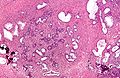
- Histologische Schnitte
Feingewebliche Untersuchung
Die feingewebliche Untersuchung von Prostatagewebe erfolgt entweder aus einem Operationspräparat oder aus einer zum Ausschluss eines Prostatakrebses gewonnenen Gewebeprobe. Bei der BPH finden sich keine malignen Zellen, dagegen weist das Gewebe im Vergleich zur gesunden Prostata einen knotigen Umbau durch die Proliferation von Stroma und Drüsenepithel auf. Typisch sind wirbelförmige Muskelknoten und mit einem einschichtigen Epithel ausgekleidete, herdförmige Drüsengänge. Diese knotigen Veränderungen sind meist relativ groß und daher in kleinvolumigen Gewebeproben nicht erkennbar. Die Variationsbreite der Veränderungen ist weit, bei der BPH findet sich aber immer ein einschichtiges Epithel, dagegen fehlen Zellatypien.[15][16]
Behandlung und Heilungsaussichten
Ohne Behandlung schreitet die BPH in aller Regel langsam fort. Therapieziel kann es daher sein, ein Fortschreiten der Erkrankung zu verhindern; bestehende, die Lebensqualität beeinträchtigende Symptome zu verringern oder eine Rückführung der BPH anzustreben. Bei fehlenden Symptomen kann auf eine Behandlung primär verzichtet werden (kontrolliertes Zuwarten). Von einem Fortschreiten wird jedoch in diesem Falle ausgegangen.[1] Die gutartige Vergrößerung der Vorsteherdrüse und ihre Folgen sind grundsätzlich mit dauerhaftem Erfolg behandelbar, Rezidive kommen jedoch vor.
Medikamentöse Therapie
Eine medikamentöse Behandlung ist im Stadium I und in manchen Fällen auch in einem frühen Stadium II der Erkrankung indiziert. Sie wird vom Arzt individuell abgestimmt, wobei auch Begleiterkrankungen Berücksichtigung finden. Sie ist nicht indiziert, wenn Komplikationen wie rezidivierender Harnverhalt oder Harnwegsinfekte, Harnblasenkonkremente, konservativ nicht beherrschbare, rezidivierende Makrohämaturien oder auch eine stauungsbedingte Erweiterung des oberen Harntraktes mit eingeschränkter Nierenfunktion oder Niereninsuffizienz vorliegen.
Die medikamentöse Therapie kann verschiedene Therapieziele verfolgen. Dazu gehören die Verminderung störender Symptome, die Verhinderung des Fortschreitens von Prostatawachstum oder Symptomatik und den damit verbundenen Komplikationen. Die Behandlung muss, soll sie ein Voranschreiten der Erkrankung verhindern, dauerhaft erfolgen. Generell stehen zur medikamentösen Therapie der BPH Phytopharmaka (pflanzliche Arzneimittel), α1-Adrenozeptorantagonisten, 5α-Reduktasehemmer, Muskarinrezeptorantagonisten und Kombinations-Präparate zur Verfügung.[17][18][19] Auch der PDE-5-Hemmer Tadalafil wird zur Behandlung der BPH-Symptomatik eingesetzt, der Wirkungsmechanismus ist unbekannt.[20]
Phytopharmaka und biogene Arzneistoffe
Bei leichteren Beschwerden (Stadium I oder Stadium II nach Alken) werden auch pflanzliche Extrakte beispielsweise aus Sägepalmenfrüchten (Serenoa repens, Sabal serrulata), dem Afrikanischen Pflaumenbaum (Prunus africana), Brennnesselwurzeln (Urtica dioica), Roggenpollen (Secale cereale) und Kürbissamen (Cucurbita pepo) verwendet.[19][21] Der Einsatz erfolgt entweder allein (Monopräparate) oder kombiniert (Kombinationspräparate). Als Gründe für eine pflanzliche Therapie werden meist Verträglichkeit und Therapietreue (Compliance) der Patienten genannt. Extrakte der gleichen Pflanze können aufgrund unterschiedlicher Extraktionsverfahren der Hersteller andere Zusammensetzungen und Dosierungsvorschriften aufweisen.
Wesentlicher wirksamer Bestandteil vieler pflanzlicher Arzneimittel ist β-Sitosterin. Die Substanz wird auch in isolierter Form therapeutisch eingesetzt. Es gibt Hinweise, dass β-Sitosterin antiandrogen wirkt und die Prostaglandin- und Leukotriensynthese hemmt.[22] Die Präparate beheben nicht die Vergrößerung der Prostata, sondern sollen Beschwerden beim Wasserlassen lindern, indem sie relevante Messparameter beeinflussen (Erhöhung des Miktionsvolumens und des maximalen Harnflusses, Erniedrigung der Restharnmenge). Aufgrund geringerer Arzneimittelrisiken (Nebenwirkungen, Wechselwirkungen, Kontraindikationen) unterliegen Phytopharmaka, die zur Behandlung einer BPH eingesetzt werden, nicht der Rezeptpflicht. Die therapeutische Wirksamkeit gilt als unzureichend nachgewiesen,[23][24] da die Evidenz für eine langfristige, klinisch relevante Wirksamkeit noch nicht erbracht wurde.[19] Es fehlen ausreichende Daten über einen Einfluss auf das Risiko für das Fortschreiten des benignen Prostata-Syndroms und auf die Vorbeugung vor Komplikationen. In den USA wurde 1990 der Verkauf rezeptfrei erhältlicher Phytopharmaka verboten, um den Patienten nicht in falscher Sicherheit zu wiegen oder eine weitere Abklärung zu verzögern.[25] In Deutschland enthalten die Mittel einen entsprechenden Hinweis in der Gebrauchsinformation.
Laut der AWMF-Leitlinie gibt es für vier phytotherapeutische Präparate Hinweise auf eine Wirksamkeit aus randomisierten, kontrollierten Studien. Weitere Studien nach internationalen Kriterien seien allerdings erforderlich.[19] Nach einer Analyse der Cochrane Collaboration verbessert etwa Sägepalmenfrüchte-Extrakt gering bis mäßig Harnstrahl und Probleme beim Wasserlassen. Die Beschwerdebesserung durch den Extrakt sei mit der von Finasterid, einem verschreibungspflichtigen Arzneistoff, vergleichbar. Weitere Forschung über die langfristigen Auswirkungen von Sägepalmenfrüchte-Extrakt sei jedoch notwendig[26] Die Anwendung einer Extraktkombination aus Sägepalmenfrüchten und Brennnesselwurzeln hatte sich in einer Studie als ebenso symptomatisch wirksam erwiesen wie der rezeptpflichtige Alpharezeptorenblocker Tamsulosin.[27] Auch Roggenpollenextrakt scheint die Beschwerden beim Wasserlassen etwas zu bessern.[28] Zubereitungen aus Kürbiskernen und aus Brennnesselwurzel sind auf Basis eines bibliografischen Wirksamkeitsnachweises, d. h. ohne Vorlage präparatespezifischer klinischer Studien, zugelassen („allgemeiner medizinischer Gebrauch“).
α1-Adrenozeptorantagonisten
Die Wirkung der α1-Adrenozeptorantagonisten (α-Blocker) beruht auf einer Entspannung der glatten Muskulatur an Prostata und Harnröhre, wodurch der Harnfluss verbessert und damit verbundene Symptome gelindert werden. Sie haben aber nur einen geringen Einfluss auf die durch die Vergrößerung der Prostata bewirkte mechanische Abflussbehinderung aus der Blase, werden jedoch zur Reduzierung und Verzögerung des Fortschreitens der Symptome empfohlen. Eingesetzt werden beispielsweise Alfuzosin, Doxazosin, Tamsulosin und Terazosin. Bei geeigneter Dosierung sind alle α-Blocker ähnlich wirksam.[29][19][30] Sie haben einen relativ prompten Wirkeintritt und scheinen bei der Behandlung störender Symptome den 5α-Reduktasehemmern überlegen. Auf das Wachstum der Prostata und das Risiko eines akuten Harnverhaltes haben α-Blocker langfristig keinen Einfluss.[19]
α-Blocker waren ursprünglich 1969 zur Therapie des Bluthochdruckes eingeführt worden (Minipress). Daher ist es leicht verständlich, dass sie, insbesondere auch bei entsprechend ungünstig gewählter Begleitmedikationen, zu erheblichen Nebenwirkungen im Herz-Kreislauf-Systemführen können. Darüber hinaus gelten Abgeschlagenheit, Schwindel, Kopfschmerz, Durchfall, Schwellung der Nasenschleimhaut und grippale Symptome als typische unerwünschte Wirkungen. Sie sind jedoch prinzipiell nach Absetzen des Medikamentes reversibel. Vor allem unter Tamsulosin kann es zusätzlich zu abnormalen Ejakulationen kommen. Aufgrund der Arzneimittelrisiken unterliegen α-Blocker der Rezeptpflicht.[19]
5α-Reduktasehemmer
5α-Reduktasehemmer hemmen durch die Blockade des Enzyms 5α-Reduktase die Umwandlung von Testosteron in Dihydrotestosteron. Letzteres wirkt selektiv an der Prostata und ist wesentlich für deren Wachstum verantwortlich. Verwendet werden Dutasterid und Finasterid, die sich pharmakologisch leicht unterscheiden. Ziel der Behandlung mittels dieser Präparate ist es, eine Schrumpfung der Vorsteherdrüse zu erreichen. Für Finasterid wurde die Wirksamkeit bezüglich der Symptome und des Fortschreitens der BHP nachgewiesen. Als Nebenwirkungen wurden dabei beispielsweise Libidominderung und Impotenz sowie vermindertes Wachstum hormonabhängiger Körperbehaarung festgestellt.[29][30]
Muskarinrezeptorantagonisten
Muskarinrezeptorantagonisten (Anticholinergika) bewirken eine Abnahme des Tonus der glatten Blasenwandmuskulatur (Musculus detrusor vesicae). Ihr Einsatz beschränkt sich daher auf von einer Überaktivität dieses Muskels ausgelöste Miktionsbeschwerden, wie sie bei einer BPH auftreten können (Harndrang, Dranginkontinenz, Pollakisurie; entspricht der OAB-Symptomatik). Jedoch ist der Einsatz dieser Medikamente kritisch abzuwägen, kann er doch durch die Schwächung der Blasenmuskulatur bei BPH-bedingter relevanter Obstruktion zum Harnverhalt führen. Bei Harnverhalt sind Muskarinrezeptorantagonisten kontraindiziert. Als typische Nebenwirkungen der Muskarinrezeptorantagonisten gelten Schlaf- und Gedächtnisstörungen sowie Verwirrtheit und vermehrte Sturzneigung.[31]
Operation
Eine operative oder invasive Behandlung ist nach den aktuellen Leitlinien der Deutschen Gesellschaft für Urologie bei klinisch relevanter BPO indiziert oder bei Vorliegen von Komplikationen (absolute Operationsindikationen) wie rezidivierender Harnverhalt, rezidivierende Harnweginfektionen, konservativ nicht beherrschbare, rezidivierende Makrohämaturien, Harnblasenkonkremente, Dilatation des oberen Harntraktes, eingeschränkte Nierenfunktion oder Niereninsuffizienz angezeigt. Als relative Operationsindikation gilt auch eine ausgeprägte BPH, wenn alle verfügbaren Medikamente keinen oder nur geringen Einfluss haben. Grundsätzlich werden zwei Arten von Eingriffen unterschieden. Entweder wird das Gewebe der Prostata dabei direkt entfernt (primär ablativ), oder aber es wird auf die eine oder andere Weise derart geschädigt, dass sich das Volumen der Drüse nach dem Eingriff reduziert (sekundär ablativ). Eine feingewebliche Untersuchung ist dabei natürlich nur im ersten Fall möglich.
Transurethrale Resektion der Prostata
Die transurethrale Resektion der Prostata (TURP) gilt auch heute noch als der so genannte Goldstandard in der operativen Therapie des BPS. Es gibt kein operatives Verfahren, dessen langfristiger Erfolg hinsichtlich subjektiver und objektiver Parameter (Urodynamik) so gut belegt ist. Wie bei jedem operativen Verfahren kann es aber auch bei der TURP zu Komplikationen kommen. Hierbei spielen Blutungen sowie die Einschwemmung von Spülflüssigkeit (TUR-Syndrom) während der Operation und Nachblutungen die entscheidende Rolle. Die Häufigkeit wird je nach Studie mit bis zu fast neun Prozent angegeben.[32] Die Mortalität, vor 40 Jahren mit 2,5 % noch recht hoch, liegt heute bei unter 0,1 bis 0,25 Prozent. Im Hinblick auf die Komplikationsrate wurde die TURP in der Vergangenheit vielfach technisch modifiziert. Dazu gehören Veränderungen des Hochfrequenzgenerators (koagulierendes intermittierendes Schneiden), des Stromflusses (bipolare Resektion), der Elektroden (Bandschlinge, Vaporisation) und der Resektionstechnik. Für einzelne Modifikationen ist dokumentiert, dass das perioperative Blutungsrisiko verringert werden kann.[19] Die postoperative Häufigkeit des Auftretens dauerhafter Harninkontinenz liegt bei etwa 0,5 % (0,1–1,8).[33]
Transurethrale Inzision der Prostata
Die transurethrale Inzision der Prostata (TUIP) ist ebenfalls eine Form der transurethralen Resektion, bei der es allerdings nicht das Ziel ist, die Vorsteherdrüse zu entfernen, sondern sie nur einzuschneiden, um damit den Auslasswiderstand der Blase zu reduzieren. Sie ist für jüngere Männer mit einer relativ kleinen Prostata (< 30 Gramm) geeignet. Die Wirksamkeit scheint der der TURP vergleichbar, die Nebenwirkungsrate ist geringer, allerdings müssen mit 15,9 % nach 10 Jahren wesentlich mehr Patienten als nach einer TURP (8–15 %) nachoperiert werden.[19]
Offene Prostataoperation
Die offene Prostataoperation wird auch als Prostataenukleation oder Adenomenukleation bezeichnet ist die älteste Methode zur operativen Behandlung der BPH. Dabei wird die Prostata nach Eröffnung der Blase von intravesikal aus manuell vom umgebenden Gewebe gelöst und entfernt. Diese Methode ist auch heute noch beispielsweise bei sehr großen Vorsteherdrüsen (>70 cm3) oder Begleitveränderungen wie Leistenhernien, Blasendivertikeln oder -steinen indiziert. Die anhaltende Wirksamkeit der Methode ist gut dokumentiert als typische Komplikationen gelten Blasenhalssklerose, Harnröhrenstriktur und Meatusengen.[19] Zum postoperativen Risiko des Auftretens dauerhafter Harninkontinenz gibt es unterschiedliche Zahlen. Diese reichen von "geringer als bei der TURP" bis zu 9,5 %.[33]
Laserverfahren
Klinische Relevanz unter den Laserverfahren haben bislang die interstitielle Laserkoagulation (ILC), Holmiumlaserenukleation (HoLEP) sowie die Laservaporisation der Prostata erlangt.[19]
Mittels ILC kann das Volumen der Prostata zwar in relevantem Maße reduziert werden, ihre Effektivität ist dabei jedoch der der TURP unterlegen. Als wesentlicher Nachteil der Methode gilt auch die koagulationsbedingte initiale Zunahme des Blasenauslasswiderstandes. Sie hat bislang keine weitgehende Verbreitung gefunden.[19]
Auch für die HoLEP (Laserresektion bzw. -enukleation) konnte ein deutlicher Einfluss auf die BPH nachgewiesen werden. Dabei wird das Gewebe der Prostata nicht koaguliert, sondern mittels eines Laserstrahles „herausgeschnitten“ und anschließend abgesaugt. Dieses Verfahren ist der TURP bezüglich der Wirkung ebenbürtig, postoperativ weist es sogar eine geringere Morbidität (beispielsweise Blutung, Katheterverweil- und Hospitalisierungszeit) auf. Es ist jedoch sehr schwer zu erlernen und daher bislang nicht weit verbreitet.[34], [19]
Die Laservaporisation ist ebenfalls ein schwer zu erlernendes Verfahren. Ihre Ergebnisse sind vom Operateur abhängig. Langzeitdaten dazu fehlen bislang. Zur KTP-Laser-Vaporisation (Verdampfung) des überschüssigen, einengenden Prostatagewebes benutzt man einen mittels KTP-Kristall frequenzverdoppelten Nd:YAG-Laser, der Licht einer Wellenlänge von 532 nm generiert. Diese Wellenlänge liegt im grünen, sichtbaren Bereich des Farbspektrums (Greenlight-Verfahren). Die Lichtpulse sind in der Lage, Prostatagewebe annähernd blutungsfrei zu entfernen. Ihr Einsatz scheint daher bei Hochrisikopatienten (beispielsweise Gerinnungsstörungen oder Antikoagulation) möglich zu sein.[19]
Transurethrale Mikrowellenthermotherapie
Bei der transurethralen Mikrowellenthermotherapie (TUMT) wird das Gewebe der Prostata erhitzt. Dabei unterscheidet man zwischen der Niedrigenergie- (≤ 55 °C) und der Hochenergietechnik (> 55 °C). Die Linderung der Symptome ist bei beiden Verfahren vergleichbar. Die TUMT Behandlung kann im Vergleich mit den bisher genannten Verfahren ambulant und unter lokaler Betäubung durchgeführt werden.
Die Niedrigenergietechnik (NE-TUMT) wirkt aufgrund der geringeren Temperaturentwicklung nicht ablativ, d.h. das Prostatagewebe wird nicht zerstört. Dieses Verfahren konnte sich daher nicht durchsetzen und wird nur noch sehr selten angewendet.[19]
Im Gegensatz dazu ist bei der Hochenergietechnik (HE-TUMT) die Effektivität nur geringfügig schlechter als bei der klassischen TURP, wohingegen die Morbiditätsrate niedriger ist. Die Weiterentwicklung der Hochenergietechnik ist die sog. HE-TUMT mit integriertem Temperaturfeedback. Dieses Verfahren arbeitet mit mehreren Temperatursonden welche eine verbesserte Kontrolle und gezieltere Energieeinbringung ermöglichen. Hierbei können vergleichbare Ergebnisse zur TURP erzielt werden.[19]
Typischerweise tritt nach dem Eingriff ein Hitzeödem des behandelten Gewebes auf, das eine temporäre Harnableitung (Katheter) notwendig machen kann. Vor allem bei „Hochrisikopatienten“ mit Harnverhalt kann die HE-TUMT als Alternative zur TURP eingesetzt werden. [19]
Transurethrale Nadelablation
Bei der transurethralen Nadelablation (TUNA) wird das Prostatagewebe mittels Radiofrequenzwellen erhitzt. Es kann ohne Narkose durchgeführt werden. Es besteht kein Blutungsrisiko, auch andere Komplikationen sind selten, zudem bleiben Erektion und Ejakulation unbeeinträchtigt, Fälle persistierender Harninkontinenz sind bislang nicht beschrieben. Die Erfolgsrate ist der der TURP vergleichbar, allerdings müssen sich 13,8–23,3 % der Patienten innerhalb 5 Jahren einer erneuten Therapie unterziehen. "Die TUNA eignet sich besonders für Patienten mit mäßiger bis ausgeprägter Symptomatik und geringgradiger Obstruktion." (zitiert nach[19]).
Prostatische Stents
Dabei werden Stents in den prostatischen Anteil der Harnröhre ohne Narkose temporär oder permanent eingebracht. Zweck der temporären Implantate ist es dabei, einen transurethralen oder suprapubischen Blasenkatheter zu ersetzen. Sie bedürfen regelmäßiger Wechsel. Permanente Stents epithelialisieren und können dauerhaft belassen werden. Die Komplikationsrate ist relativ hoch, typisch sind eine primäre Fehlanpassung, sekundäre Verschiebung, Inkrustation, anhaltende Dranginkontinenz sowie sekundäre Miktions- und Symptomenverschlechterung. 20 % der permanenten Stents müssen innerhalb des ersten Jahres und 50 % innerhalb der ersten 10 Jahre entfernt werden. Stents eignen sich bei strenger Indikationsstellung (beispielsweise kein großer Prostatamittellappen) für polymorbide Patienten und solche mit begrenzter Lebenserwartung.[19]
Sonstige Verfahren
Andere Verfahren wie die wasserinduzierten Thermotherapie (WIT), die Hoch Intensiven Fokussierten Ultraschall (HIFU), die das Gewebe erhitzt[35], sowie Ethanol- oder Botulinumtoxininjektionen in die Prostata sind bislang wenig verbreitet. Daher fehlen für dieses Verfahren ausreichend valide Erfahrungswerte bezüglich der Nebenwirkungen und Studien für einen Wirknachweis.[19] Bei der WIT wird über einen speziellen transurethralen Katheter auf 60 Grad erhitztes Wasser in den prostatischen Teil der Harnröhre geführt. Dort erhitzt es das Prostatagewebe. Die HIFU wird mittels transrektal platzierter Ultraschallsonde ausgeführt.
Vorbeugung und Prognose
Die BPH hängt zwar primär mit dem Alterungsprozess zusammen, ihre Ausprägung kann aber auch durch begleitende Faktoren wie Adipositas beeinflusst werden.[36] Vorbeugend wird empfohlen, auf eine ausgewogene, ballaststoffreiche Ernährung zu achten und ausreichend Wasser zu trinken. Eine solche Ernährung verhindert Übergewicht, einen wichtigen Faktor bei der Vorbeugung dieser Prostataerkrankung. Als weiterer Risikofaktor wird starkes Rauchen angesehen.[37] Ausreichende Bewegung und regelmäßige sportliche Betätigung sind wichtige positive Einflussfaktoren.[38] Auch bei einer bereits klinisch manifesten Erkrankung durch eine BPH ist die Prognose bei entsprechender Behandlung sehr günstig, der aus vergangenen Jahrhunderten bekannte, letale Ausgang der Erkrankung ist heutzutage kein Thema mehr.
Geschichtliche Aspekte
In früheren Jahrhunderten wurde die "chronische Schwellung" der Prostata nach dem 50. Lebensjahr als Folge einer Entzündung betrachtet.[39] Grundlegende Erkenntnisse auf diesem Gebiet im Sinne der modernen Medizin wurden 1761 von Giovanni Battista Morgagni erstveröffentlicht. Diese Arbeiten wurden in den Folgejahren von John Hunter und seinem Schwager Everard Home wieder aufgenommen und fortgeführt.
Die Anfänge der Prostatachirurgie im 19. Jahrhundert orientierten sich eng an den, zu dieser Zeit bereits vorhandenen Erfahrungen aus Steinschnitten (operative Blasensteinentfernung). Ende des 19., Anfang des 20. Jahrhunderts konkurrierten perineale, retropubische und transvesikale Verfahren, also Zugänge durch den Damm, über dem Schambein oder durch die Blase. Letztere wurden in der ersten Hälfte des 20. Jahrhunderts so weit verfeinert, dass ein Verfahren (die transvesikale Prostataenukleation) noch heute regelmäßig eingesetzt wird. 1926 wurde dann das erste Instrumentarium zur Elektroresektion, ein Vorläufer der heute als Goldstandard geltenden transurethralen Prostataresektion (TURP) in den USA vorgestellt.[40][41]
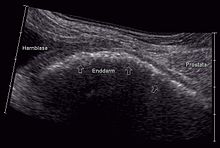 Sonographische Darstellung einer durch BPH bedingten Koprostase beim Hund
Sonographische Darstellung einer durch BPH bedingten Koprostase beim Hund
Tiermedizin
Eine bedeutende Rolle spielt die BPH beim Hund. Hier tritt die Erkrankung bei älteren Rüden regelmäßig auf. Da sich die Vergrößerung der Prostata symmetrisch und über das ganze Organ gleichmäßig verteilt vollzieht, sind Kotabsatzbeschwerden infolge einer Verlegung des Beckenausganges das am häufigsten beobachtete Symptom. Zusätzlich können sich multiple Prostatazysten zeigen, welche den spontanen Abgang eines serösen blutigen Sekretes aus der Harnröhre zur Folge haben können. Therapeutische Optionen liegen in der Kastration sowie in der medikamentösen Ausschaltung der Hodenfunktion[42]; für diese Anwendung sind Osateron und Delmadinon zugelassen; daneben liegen positive Erfahrungen mit Cyproteron und Finasterid vor, die aber tiermedizinisch nicht zugelassen sind.
Literatur
- Ulrike Zwergel, Jürgen Sökeland: Benigne Prostatahyperplasie: Grundlagen und Therapie. Springer Verlag, 1999, ISBN 3540652698.
- D. Jocham, C. Doehn: Benigne Prostatahyperplasie. In: M. Böhm, F. Jockenhövel, W. Weidner: Männersprechstunde: das Praxishandbuch zu Beratung, Prävention und Therapie. Springer Verlag, 2004, ISBN 3540009159 (Eingeschränkte Vorschau in der Google Buchsuche).
- Klaus Höfner, C. G. Stief, Udo Jonas: Benigne Prostatahyperplasie: Leitfaden für die Praxis. Springer Verlag, 2000, ISBN 3540629688.
Einzelnachweise
- ↑ a b c d e S2-AWMF-Leitlinie: Diagnostik und Differentialdiagnostik des Benignen Prostata-Syndroms (BPS), Registernummer 043/034, pdf
- ↑ Beispiele für die Verwendung der veralteten Begriffe: Hartmut Link u.a.: Supportivtherapie bei malignen Erkrankungen: Prävention und Behandlung von Erkrankungssymptomen und therapiebedingten Nebenwirkungen. Deutscher Ärzteverlag, 2006, S. 435, ISBN 3769104668; Peter Dosch (Hrsg.): Lehrbuch der Neuraltherapie nach Huneke. (Regulationstherapie mit Lokalanästhetika). Georg Thieme Verlag, 1995, S. 315, ISBN 3776014512 (Eingeschränkte Vorschau in der Google Buchsuche); Hans-Joachim Schmoll, Klaus Höffken, Kurt Possinger (Hrsg.): Kompendium Internistische Onkologie. Springer, 2005, S. 1418, ISBN 3540206574.
- ↑ Altwein J.: Urologie. Enke-Verlag, 1979, S. 279, ISBN 3432899319.
- ↑ a b Y. Gat: Reversal of benign prostate hyperplasia by selective occlusion of impaired venous drainage in the male reproductive system: novel mechanism, new treatment. In: Andrologia, 2008 40 (5): 273–81. PMID 18811916
- ↑ Mischke R.: Zytologisches Praktikum für die Veterinärmedizin. Schlütersche, 2005, S. 162, ISBN 3899930134 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Dahme E., e.a.: Grundriss der speziellen pathologischen Anatomie der Haustiere. Georg Thieme Verlag, 2007, S. 208, ISBN 3830410484 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ U. Zwergel: Facharztprüfung Urologie: In Fällen, Fragen und Antworten. Urban & Fischer Verlag, 2008, ISBN 3437245104, S. 246 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ M. J. Kang, et al.: Non-invasive Parameters Predicting Bladder Outlet Obstruction in Korean Men with Lower Urinary Tract Symptoms. In: J Korean Med Sci. 2010, S. 272–275, PMID 2811296
- ↑ Pfeiffer D., e.a.: HIFU-Technik zur primären interventionellen Behandlung des Prostatakarzinoms – Frühergebnisse, Hamburger Ärzteblatt, 5/2006, S.277 pdf
- ↑ Huggins C., e.a.: The effect of castration on benign prostatic hypertrophy in men. In: Urologist, 1940, 43:705-11; zitiert nach: Zwergel U., e.a.: Benigne Prostatahyperplasie: Grundlagen und Therapie, Springer, 1999, ISBN 3540652698.
- ↑ Ganten D., e.a.: Molekularmedizinische Grundlagen von altersspezifischen Erkrankungen, Springer, 2004, ISBN 3540008586, S. 306 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ C. Dadak: Sexualität, Reproduktion, Schwangerschaft, Geburt. Facultas Verlag, 2009, ISBN 3708905350, S. 30 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ J. Grüger und L. Pientka: Symptomatik und Lebensqualität bei Patienten mit benigner Prostatahyperplasie im ambulanten Bereich in Deutschland. In: Aktuel Urol 27, Nr. 5, 1996, S. 260–266, {{DOI:10.1055/s-2008-1055604}}.
- ↑ AWMF- Leitlinie: PSA-Bestimmung in der Prostatakarzinomdiagnostik, (S3), 2005, pdf
- ↑ Bubendorf L., e.a: Pathologie: Zytopathologie, Springer, 2010, S. 212, ISBN 3642045618, (Eingeschränkte Vorschau in der Google Buchsuche)
- ↑ Zwergel U.: Benigne Prostatahyperplasie: Grundlagen und Therapie, Springer, 1999, S. 4, ISBN 3540652698, (Eingeschränkte Vorschau in der Google Buchsuche)
- ↑ S. Madersbacher und M. Marszalek: Benigne Prostatahyperplasie: Erfolge und Grenzen der Pharmakotherapie In: Der Internist 2007, {{DOI:10.1007/s00108-007-1843-8}}
- ↑ M. Oelke et al. Medikamentöse Therapie der benignen Prostatahyperplasie In: Der Urologe 2009, {{DOI:10.1007/s00120-009-2141-y}}
- ↑ a b c d e f g h i j k l m n o p q r s t S2-AWMF-Leitlinie: Therapie des Benignen Prostata-Syndroms (BPS), 043/035, 02/2009, pdf
- ↑ Drugs@FDA: Label Information Cialis, 7. Oktober 2011.
- ↑ T. Dingermann, K. Hiller, G. Schneider, I. Zündorf: Schneider Arzneidrogen. 5. Auflage, Elsevier 2004, ISBN 3-8274-1481-4. S. 14 ff.
- ↑ Zwergel U., e.a.: Benigne Prostatahyperplasie: Grundlagen und Therapie, Springer, 1999, S. 60 ff., ISBN 3540652698 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Stiftung Warentest Online: „Prostatavergrößerung“, Stand 2010.
- ↑ Ernst Mutschler, Gerd Geisslinger, Heyo K. Kroemer, Peter Ruth, Monika Schäfer-Korting: Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 9. Auflage. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2008, ISBN 3-80-471952-X, S. 710.
- ↑ MEDIKAMENTÖSE BEHANDLUNG DER BENIGNEN PROSTATAHYPERPLASIE. arznei-telegramm (1991). Abgerufen am 26. November 2010.
- ↑ Tacklind J., e.a.: Serenoa repens for benign prostatic hyperplasia. Cochrane Database of Systematic Reviews 2009, Issue 2. Art. No.: CD001423., hier deutsche Kurzfassung online
- ↑ U. Engelmann u.a.: Efficacy and safety of a combination of sabal and urtica extract in lower urinary tract symptoms. A randomized, double-blind study versus tamsulosin. Arzneimittel-Forschung 2006; 56 (3): 222–229
- ↑ Wilt T, MacDonald R, Ishani A, Rutks I, Stark G.: Cernilton for benign prostatic hyperplasia. Cochrane Database of Systematic Reviews 2000, Issue 2. Art. No.: CD001042. {{DOI: 10.1002/14651858.CD001042}} (hier deutsche Kurzfassung online).
- ↑ a b Tacklind J., e.a.: Finasteride for benign prostatic hyperplasia. Cochrane Database of Systematic Reviews 2010, Issue 10. Art. No.: CD006015. hier online
- ↑ a b Perabo F., e.a.: Inkontinenz: Fragen und Antworten, Deutscher Ärzteverlag, 2009, S. 148 ff., ISBN 3769112520 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Arisco A. M., e.a.: Oxybutynin extended release for the management of overactive bladder: a clinical review. In: Drug Des Devel Ther. 2009; 3: 151–161, hier online
- ↑ Reich O.: Benignes Prostatasyndrom. In: Der Urologe A. Volume 49, Nr. 1, 2010, S. 113–126, {{DOI: 10.1007/s00120-009-2183-1}}.
- ↑ a b Bichler K.-H.: Das urologische Gutachten, Springer, 2004, S. 338, ISBN 3540427570 (Eingeschränkte Vorschau in der Google Buchsuche)
- ↑ Karin Lehrich: Vergleich der transurethralen Holmium-Laser-Enukleation der Prostata (HoLEp) und der transvesikalen Adenomenukleation der Prostata: eine prospektive Studie. Dissertation, Freie Universität Berlin 2002, http://d-nb.info/966392221
- ↑ J. R. L. Denis: Prostate cancer. Springer, 2007, S. 207, ISBN 3540408975 (Eingeschränkte Vorschau in der Google Buchsuche)
- ↑ J. K. Parsons, A. V. Sarma, K. McVary, J. T. Wei: Obesity and benign prostatic hyperplasia: clinical connections, emerging etiological paradigms and future directions. In: The Journal of urology Band 182, Nummer 6 Suppl, ISSN 1527-3792, Dezember 2009, S. S2 7–S3 1, doi:10.1016/j.juro.2009.07.086, PMID 19846130, PMC 10.1016/j.juro.2009.07.086. (Review).
- ↑ E. A. Platz, E. B. Rimm, I. Kawachi, G. A. Colditz, M. J. Stampfer, W. C. Willett, E. Giovannucci: Alcohol consumption, cigarette smoking, and risk of benign prostatic hyperplasia. In: American journal of epidemiology Band 149, Nummer 2, Januar 1999, S. 106–115, ISSN 0002-9262. PMID 9921955.
- ↑ J. Sea, K. S. Poon, K. T. McVary: Review of exercise and the risk of benign prostatic hyperplasia. In: The Physician and sportsmedicine, Band 37, Nummer 4, Dezember 2009, S. 75–83, PMID 20048544.
- ↑ Vidal Auguste-Théodore: Lehrbuch der Chirurgie und Operationslehre, Verlag Reimer, 1859, S. 129 ff. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Zwergel U., e.a.: Benigne Prostatahyperplasie: Grundlagen und Therapie, Springer, 1999, S. 130, ISBN 3540652698.
- ↑ Dietrich H. G.: Illustrierte Geschichte der Urologie, Springer, 2004, S. 122 ff., ISBN 3540087710 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Grünbaum, E.-G., Schimke E (Hrsg.): Klinik der Hundekrankheiten, Enke, 2007: 775

Bitte den Hinweis zu Gesundheitsthemen beachten! 
Dieser Artikel wurde am 9. April 2011 in die Liste der exzellenten Artikel aufgenommen. Kategorien:- Wikipedia:Exzellent
- Gutartige Tumorbildung
- Krankheitsbild in der Urologie
- Prostata
Wikimedia Foundation.