- CO₂
-
Strukturformel 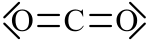
Allgemeines Name Kohlenstoffdioxid Andere Namen - Kohlendioxid
- Kohlenstoff(IV)-oxid
- Dioxidokohlenstoff
Summenformel CO2 CAS-Nummer 124-38-9 Kurzbeschreibung farbloses, geruchloses Gas Eigenschaften Molare Masse 44,0099 g/mol Aggregatzustand gasförmig
Dichte 1,9767 kg·m−3 (0 °C, 1013 mbar)[1]
Schmelzpunkt −56,57 °C (5,3 bar)[1]
Siedepunkt keiner bei Normaldruck (Sublimation bei −78,5 °C)[1]
Dampfdruck 57,258 bar[1] (20 °C)
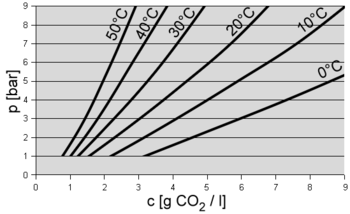
Löslichkeit 3,3 g/l bei 0 °C, 1,7 g/l bei 20 °C, jeweils bei 1013 hPa[2]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: 9-23 MAK 9100 mg·m−3[1]
GWP 1 (per Definition) Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kohlenstoffdioxid (im normalen Sprachgebrauch auch Kohlendioxid, oft fälschlich Kohlensäure genannt) ist eine chemische Verbindung aus Kohlenstoff und Sauerstoff und ist damit neben Kohlenstoffmonoxid (auch Kohlenmonoxid), Kohlenstoffsuboxid und dem instabilen Kohlenstofftrioxid eines der Oxide des Kohlenstoffs. Die chemische Summenformel lautet CO2.
Kohlenstoffdioxid ist ein farb- und geruchloses Gas. Es ist mit einer Konzentration von ca. 0,04 % (im Jahr 2008 385 ppm, jährliche Zunahme ca. 2 ppm)[3] ein natürlicher Bestandteil der Luft. Es entsteht sowohl bei der vollständigen Verbrennung von kohlenstoffhaltigen Substanzen unter ausreichendem Sauerstoff als auch im Organismus von Lebewesen als Kuppelprodukt der Zellatmung. Das CO2 wird dabei über den Atem abgegeben. Umgekehrt sind Pflanzen, manche Bakterien und Archaeen in der Lage, CO2 durch die Kohlenstoffdioxid-Fixierung in Biomasse umzuwandeln. So produzieren Pflanzen beispielsweise bei der Photosynthese aus anorganischem CO2 Glukose.
Inhaltsverzeichnis
Herstellung
Abfallprodukt der Energiewirtschaft
Kohlenstoffdioxid entsteht bei der Verbrennung kohlenstoffhaltiger Brennstoffe, z.B. der fossilen Energieträger. Bei einem gegebenen Energieträger ist die Menge des erzeugten CO2 direkt von der Menge des Brennstoffs und damit der umgesetzten Energie abhängig. Moderne Anlagen und Betriebsverfahren können zwar die im Brennstoff enthaltene Energie besser nutzen als früher, aber die Entstehung des Gases nicht verhindern.
Diese Produktion beträgt etwa 36 Mrd. Tonnen im Jahr weltweit. Da noch kein wirksames und wirtschaftliches Verfahren zur Kohlenstoffdioxidabtrennung zur Verfügung steht, entweicht diese Menge in die Atmosphäre und trägt zur globalen Erwärmung bei (siehe unten).
Technisch
Technisch gewinnt man Kohlenstoffdioxid durch Verbrennen von Koks mit überschüssiger Luft oder als Nebenprodukt beim Kalkbrennen (~530 Mio. t pro Jahr) und anschließende Reinigung (z. B. Binden an Kaliumcarbonat zu Hydrogencarbonat und anschließendes Freisetzen durch Erhitzen).
Riesige Mengen sehr reinen Kohlenstoffdioxids erhält man durch die sogenannte CO2-Wäsche bei der Ammoniak-, sowie der Methanol-Synthese. Entsprechend aufbereitet wird es für die Säuerung von Limonaden verwendet.
Auch natürliche Gasquellen (Mineralwasser) werden zur Gewinnung genutzt.
Im Labormaßstab
Im Labor wird Kohlenstoffdioxid durch Freisetzung aus Carbonaten durch Säuren erzeugt.
Nachweis und quantitative Bestimmung
Ein einfacher Nachweis von Kohlenstoffdioxid gelingt mit einer wässrigen Calciumhydroxidlösung (Kalkwasser). Dazu wird das zu untersuchende Gas in die Lösung eingeleitet. Enthält das Gas CO2, dann fällt Calciumcarbonat (Kalk) als weißlicher Feststoff aus und die Lösung trübt sich. (siehe hierzu auch: Kalkwasserprobe)
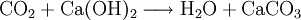
- Kohlenstoffdioxid reagiert mit Calciumhydroxid zu Wasser und Calciumcarbonat.
In wässriger Lösung kann CO2 bestimmt werden
- durch Titration mit 0,1 n Natronlauge bis zum pH-Wert von 8,3 bzw. zum Farbumschlag des Indikators Phenolphthalein;
- durch Bestimmung des Säurebindungsvermögens (SBV), des pH-Wertes und der elektrischen Leitfähigkeit (wahlweise Ionenstärke) und Berechnung des CO2 aus diesen Parametern nach dem Dissoziationsgleichgewicht der Kohlensäure;
- durch Messung mit einer Severinghaus-Elektrode.
Physikalische Eigenschaften
Das Kohlenstoffdioxid-Molekül ist linear aufgebaut. Obwohl die Kohlenstoff-Sauerstoff-Bindungen polar sind, heben sich deren elektrische Dipolmomente durch die Molekülsymmetrie nach außen hin gegenseitig auf, so dass das Molekül selbst kein elektrisches Dipolmoment aufweist. Dennoch ist Kohlenstoffdioxid aufgrund der inneren Dipolmomente gut in Wasser löslich und absorbiert einige schmale Teile des elektromagnetischen Spektrums im Bereich der Infrarotstrahlung.
Das Lösungsvermögen ist ca. 40-mal höher als beispielsweise das von Sauerstoff. Bei Raumtemperatur unter Normaldruck liegt die Sättigung bei 1700 mg/l, während sie bei O2 bereits bei 9 mg/l und bei N2 bei 20 mg/l erreicht wird.
Kohlenstoffdioxid findet im festen Aggregatzustand unter der Bezeichnung Trockeneis Anwendung in der Technik. Es schmilzt nicht, sondern sublimiert bei −78 °C. Allerdings kann man es unterhalb der kritischen Temperatur von 31 °C durch Drucksteigerung zu einer farblosen Flüssigkeit verdichten. Bei Raumtemperatur ist dazu ein Druck von ca. 60 bar nötig, der kritische Druck bei der kritischen Temperatur ist etwa 73,7 bar[1]. In flüssiger Form wird Kohlenstoffdioxid in Druckgasflaschen gehandelt. Dabei gibt es zwei Typen: Steigrohrflaschen zur Flüssigentnahme und Flaschen ohne Steigrohr zur Entnahme gasförmigen Kohlenstoffdioxids.[4] Beide müssen zur Entnahme senkrecht stehen. Die Steigrohrflasche wird grundsätzlich ohne, die andere mit Druckminderventil betrieben.
Solange sich noch flüssiges Kohlenstoffdioxid in der Druckflasche befindet, ist der Innendruck lediglich von der Temperatur abhängig. Eine Messung des Füllstandes ist deshalb bei beiden Flaschentypen ausschließlich über Wägen möglich. Die Entnahmegeschwindigkeit ist dadurch begrenzt, dass durch Wärmeaufnahme aus der Umgebung erst wieder flüssiges Kohlenstoffdioxid in der Flasche verdampfen muss, um den der Temperatur entsprechenden Druck wieder aufzubauen.
Chemische Eigenschaften
In Wasser gelöstes Kohlenstoffdioxid bildet Kohlensäure, H2CO3, wobei aber mehr als 99 % des Kohlenstoffdioxids nur physikalisch gelöst sind. Die Kohlensäure als solche liegt vor in einem Gleichgewicht mit ihren Dissoziationsprodukten (Spezies) Hydrogencarbonat ("Bicarbonat", HCO3–) und Carbonat (CO32–), die in einem vom pH-Wert abhängigen Mengenverhältnis zueinander stehen. Fängt man die bei der Dissoziation gebildeten Oxonium-Ionen (H+, eigentlich H3O+) durch Zugabe einer Lauge mit Hydroxidionen (OH–) ab, so verschiebt sich das Mengenverhältnis zu Gunsten von Carbonat.
Verwendung
Bei der Sublimation von Trockeneis entsteht ein weißer Nebel aus dem kalten CO2-Luft-Gemisch und kondensierender Luftfeuchtigkeit, der früher als Effekt in der Bühnentechnik Einsatz fand. Heute gibt es zum Beispiel Nebelkühl-Vorsätze für normale Verdampfer-Nebelmaschinen, die mit flüssigem CO2 betrieben werden.
Viele Getränke enthalten Kohlenstoffdioxid ('Kohlensäure'), um beim Trinken einen besseren Erfrischungseffekt zu erzielen. Bei manchen Getränken entsteht es durch Gärung (Bier, Sekt), bei anderen wird es künstlich zugesetzt (Limonade, Sodawasser) oder es wird kohlenstoffdioxidhaltiges, natürliches Mineralwasser verwendet. Als Lebensmittelzusatzstoff trägt es die Bezeichnung E 290. Bei der Herstellung wird Kohlenstoffdioxid unter hohem Druck in das Getränk gepumpt, wobei es zu etwa 0,2 % mit Wasser zu Kohlensäure reagiert; der größte Teil ist als Gas im Wasser gelöst. Bei einem Druckabfall durch Öffnen des Gefäßes kommt es zu einer Nukleation, so dass das nun überschüssig gelöste Gas bläschenförmig austritt und aufsteigt. Die Bläschenbildung des Gases und der säuerliche Geschmack der Kohlensäure auf der Zunge beim Trinken stimulieren die Geschmackssinneszellen, was einen Erfrischungseffekt zur Folge hat.
Kohlenstoffdioxid kommt wegen seiner sauerstoffverdrängenden Eigenschaften auch zu Feuerlöschzwecken zum Einsatz, vor allem in Handfeuerlöschern und automatischen Löschanlagen (siehe auch CO2-Löscher, Brandbekämpfung, Löschmittel).
Kohlenstoffdioxid wird als Dünger in Gewächshäusern eingesetzt. Grund ist der durch den photosynthetischen Verbrauch entstehende CO2-Mangel bei ungenügendem Nachschub an Frischluft, besonders im Winter bei geschlossener Lüftung, weil Pflanzen CO2 als Grundsubstanz benötigen. Dabei wird das Kohlenstoffdioxid entweder direkt als reines Gas (relativ teuer) oder als Verbrennungsprodukt aus Propan oder Erdgas eingebracht (Kopplung von Düngung und Heizung). Die mögliche Ertragsteigerung ist abhängig davon, wie stark der Mangel an CO2 ist und wie stark das Lichtangebot für die Pflanzen ist. Kohlenstoffdioxid wird auch in der Aquaristik als Dünger für Wasserpflanzen eingesetzt (CO2-Diffusor). Auch durch Zufuhr von organischer Substanz kann der CO2-Gehalt im Wasser erhöht werden (Veratmung, aber auf Kosten des Sauerstoff-Gehalts). (Siehe auch: Kohlenstoffdioxid-Düngung)
Überkritisches Kohlenstoffdioxid besitzt eine hohe Löslichkeit für unpolare Stoffe und kann giftige organische Lösemittel ersetzen. Es wird als Extraktionsmittel, zum Beispiel zur Extraktion von Naturstoffen wie Koffein (Herstellung von koffeinfreiem Kaffee durch Entkoffeinierung), und als Lösemittel zum Reinigen und Entfetten, zum Beispiel von Wafern in der Halbleiterindustrie und neuerdings auch von Textilien (Chemische Reinigung), verwendet. Aktuell wird auch intensiv daran geforscht, überkritisches Kohlenstoffdioxid als Reaktionsmedium für die Feinchemikalienherstellung (z. B. für die Herstellung von Aromastoffen) zu verwenden, da isolierte Enzyme hierin vielfach aktiv bleiben und keine Lösemittelrückstände (im Gegensatz zu organischen Lösemitteln) in den Produkten verbleiben.
Kohlenstoffdioxid kommt als Kältemittel unter der Bezeichnung R744 oder R-744 in Fahrzeug- und stationären Klimaanlagen, bei industrieller Kältetechnik, Supermarkt- und Transportkühlung sowie in Getränkeautomaten zum Einsatz. Es hat eine große volumetrische Kälteleistung (höhere Effizienz in einem gegebenen Volumen), eine hohe Umweltverträglichkeit (Treibhauspotenzial im Vergleich zu heute verwendeten Kältemitteln etwa 1/1000 pro kg; kein Ozonabbau-Potenzial; Gewinnung aus industriellem Abfallgas) und kann gleichzeitig in Wärmekreisläufen wie in Warmwasserpumpen und Fahrzeugheizungen genutzt werden.[5]
Kohlenstoffdioxid wird auch als Schutzgas in der Schweißtechnik eingesetzt – entweder in reiner Form oder häufiger als Zusatz zu Argon und/oder Helium. Da Kohlenstoffdioxid bei hohen Temperaturen thermodynamisch instabil ist, wird es nicht als Inertgas, sondern als Aktivgas bezeichnet.
CO2 wird auch in Abführmitteln (Zäpfchen) verwendet. Durch eine chemische Reaktion während der Auflösung des Zäpfchens wird CO2 freigesetzt und dehnt den Darm, was wiederum den Stuhlreflex auslöst.
In zunehmendem Maße wird CO2 in Verbindung mit einem automatisierbaren Strahlverfahren verwendet, um hochreine Oberflächen zu erzeugen. Mit seiner Kombination aus mechanischen, thermischen und chemischen Eigenschaften kann beispielsweise CO2-Schnee verschiedenste Arten von Oberflächen-Verunreinigungen rückstandsfrei lösen und abtragen.
In so genannten CO2-Anlagen werden in jüngster Zeit auch Schweine vor der Schlachtung betäubt. Dazu werden sie in Gruppen in einem Paternosteraufzug in eine Grube hinab gelassen, die mindestens 90 % CO2 enthält und verlieren dabei das Bewusstsein.
CO2 in der Atmosphäre und Treibhauseffekt
- Hauptartikel: Treibhauseffekt
Kohlenstoffdioxid absorbiert einen Teil der Wärmestrahlung (Infrarotstrahlung), während kurzwelligere Strahlung, d. h. der größte Teil der Sonnenstrahlung, passieren kann. Diese Eigenschaft macht Kohlenstoffdioxid zu einem so genannten Treibhausgas. Nach Wasserdampf ist Kohlenstoffdioxid entsprechend seinem Mengenanteil das zweitwirksamste der Treibhausgase, wenngleich die spezifischen Wirksamkeiten von Methan und Ozon höher sind. Alle Treibhausgase zusammen erhöhen die mittlere Temperatur auf der Erdoberfläche von ca. −18 °C auf +15 °C (natürlicher Treibhauseffekt). Kohlenstoffdioxid hat einen Anteil von ca. 9 bis 26 % an diesem Gesamteffekt und ist somit in einem nicht unerheblichen Maß für das lebensfreundliche Klima der Erde mitverantwortlich.
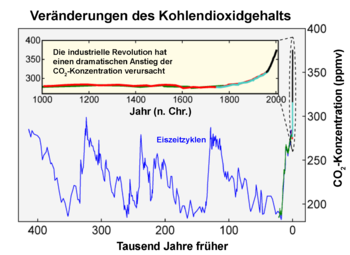
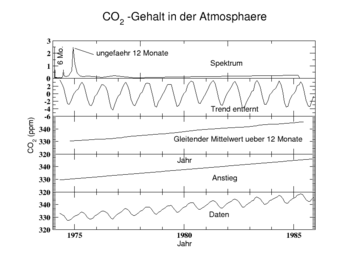
Der CO2-Anteil in der Erdatmosphäre war im Verlauf der Erdgeschichte beträchtlichen Schwankungen unterworfen, die verschiedene biologische, chemische und physikalische Ursachen haben. Seit wenigstens 650.000 Jahren lag der Anteil jedoch immer unterhalb von 280 ppm.[6] Die CO2-Konzentration in den letzten 10.000 Jahren blieb relativ konstant bei 280 ppm. Die Bilanz des Kohlenstoffdioxidkreislaufes war somit in dieser Zeit weitgehend ausgeglichen. Mit Beginn der Industrialisierung im 19. Jahrhundert stieg der CO2-Anteil in der Atmosphäre auf bislang 385 ppm (2008). In den Jahren von 1960 bis 2005 stieg der CO2-Anteil im Mittel um 1,4 ppm pro Jahr.[7] In den 10 Jahren von 1995 bis 2005 betrug die jährliche Anstiegsrate 1,9 ppm.[8] Einer Untersuchung des Global Carbon Projects aus dem Jahr 2008 zufolge ist in den Jahren 2000 bis 2007 der CO2-Ausstoß viermal schneller gestiegen als noch im Jahrzehnt davor. Damit wird das schlimmste Szenario des Weltklimarates übertroffen.[9]
Die anthropogenen, d. h. vom Menschen verursachten, CO2-Emissionen von jährlich ca. 36,3 Gt bzw. ca. 9,9 Gt Kohlenstoff (8,4 GtC durch die Verbrennung fossiler Rohstoffe sowie 1,5 ± 0,5 GtC durch Landnutzung)[7] sind nur ein kleiner Anteil des überwiegend aus natürlichen Quellen stammenden Kohlenstoffdioxids von jährlich etwa 550 Gt CO2 bzw. 150 Gt Kohlenstoff.[10] Die anthropogenen CO2-Emissionen werden durch die globale Entwaldung nur etwa zu 45 % von den natürlichen Kohlenstoffdioxidsenken aufgenommen, sodass sich das Kohlendioxid in der Atmosphäre akkumuliert. Die Verbrennung von Biomasse und daraus gewonnenen Kraftstoffen setzt unter Vernachlässigung des landwirtschaftlichen Energieverbrauchs in der Bilanz nur CO2-Mengen frei, die vorher photosynthetisch gebunden worden waren.
Allgemein ist in der Wissenschaft spätestens seit den 1990er Jahren anerkannt, dass es einen statistisch signifikanten anthropogenen Einfluss auf das Klima gibt und dass eine der Ursachen der Anstieg der Konzentration an Kohlenstoffdioxid in der Atmosphäre ist. Dieser anfänglich noch mit größeren Unsicherheiten verbundene Verdacht hat sich im Laufe der Forschungen und nach heftiger Kontroverse um die globale Erwärmung immer mehr erhärtet und ist heute weitgehend wissenschaftlicher Konsens.[11] Ohne Berücksichtigung der Treibhausgase sind die beobachteten Temperaturdaten nach Meinung der überwiegenden Mehrheit der Wissenschaftler nicht zu erklären.[12] Die Folgen der globalen Erwärmung sollen durch Klimaschutz gemindert werden.
Physiologische Wirkungen und Gefahren
CO2-Konzentrationen (Vol-%) in Luft und Auswirkungen auf den Menschen:
- 0,038 %: Derzeitige Konzentration in der Luft
- 0,15 %: Hygienischer Innenraumluftrichtwert für frische Luft
- 0,3 %: MIK-Wert, unterhalb dessen keine Gesundheitsbedenken bei dauerhafter Einwirkung bestehen
- 0,5 % (9 g/m³): MAK-Grenzwert für tägliche Exposition von acht Stunden pro Tag
- 1,5 %: Zunahme des Atemzeitvolumens um mehr als 40 %.
- 4 %: Atemluft beim Ausatmen
- 5 %: Auftreten von Kopfschmerzen, Schwindel und Bewusstlosigkeit
- 8 %: Bewusstlosigkeit, Krämpfe[13][14], Eintreten des Todes nach 30–60 Minuten
Immer wieder kommt es zu Unfällen mit CO2. In Weinkellern, Futtersilos, Brunnen und Jauchegruben können sich durch Gärprozesse beträchtliche Mengen an CO2 bilden. Bei der Vergärung von einem Liter Most entstehen etwa bis zu 50 Liter Gärgas. Wenn nicht für ausreichende Entlüftung gesorgt ist, bilden sich gefährliche Konzentrationen, und zwar aufgrund der höheren Dichte von CO2 im Vergleich zu Luft vor allem in Bodennähe (Kohlenstoffdioxid-See). Auch in bestimmten Höhlen (die sogenannte Hundsgrotte in Italien hat eine CO2-Konzentration von zirka 70 %!) und in Bergwerksstollen des Kohleabbaus können mitunter hohe Kohlendioxidkonzentrationen vorliegen.
Die direkte Schadwirkung auf Tier und Mensch kann im Einzelfall auf der Verdrängung des Sauerstoffes in der Luft beruhen. Die weit verbreitete Ansicht, CO2 sei an sich unschädlich und wirke nur durch Verdrängen des lebensnotwendigen Sauerstoffs, ist jedoch falsch. Daher ist auch die alte Kerzenprobe zum Erkennen von gefährlicher Sauerstoffknappheit nicht sinnvoll. Durch die Verdrängung der Luft (Absinken des O2-Partialdrucks auf weniger als 130 mbar) durch das schwerere Kohlenstoffdioxid kann es aber zusätzlich zu den schädlichen Wirkungen des CO2 auch zum Ersticken durch Sauerstoffmangel kommen.
Im Blut gelöstes CO2 aktiviert in physiologischer (natürlicher) und leicht gesteigerter Konzentration das Atemzentrum des Gehirns, in deutlich höherer Konzentration führt es jedoch zur Verminderung oder sogar Aufhebung des reflektorischen Atemanreizes (Atemdepression, Atemstillstand). Diese Wirkungen treten viel rascher ein als eine Erstickung. Der anregende CO2-Reiz auf das Atemzentrum wird bei ärztlichen Hilfsmaßnahmen nach einem Atemstillstand zur Wiederbelebung genutzt. Dazu wird reiner Sauerstoff gemischt mit ca. 4-5% Kohlendioxid dem Patienten verabreicht. Dies entspricht auch ungefähr dem Kohlendioxidgehalt der ausgeatmeten Luft, die einem Patienten durch einen Ersthelfer bei der Atemspende verabreicht wird.
Ab etwa 5 Prozent CO2 in der eingeatmeten Luft treten Kopfschmerzen und Schwindel auf, bei höheren Konzentrationen beschleunigter Herzschlag (Tachykardie), Blutdruckanstieg, Atemnot und Bewusstlosigkeit (die so genannte CO2-Narkose). CO2-Konzentrationen von 8 Prozent und mehr führen innerhalb von 30 bis 60 Minuten zum Tod.
Zusätzlich hat Kohlenstoffdioxid eine indirekte Wirkung auf den Sauerstoffhaushalt des Blutes. Befindet sich vermehrt Kohlenstoffdioxid in der Luft oder im Frischwasser, so wird im Blut über das Dissoziationsgleichgewicht der Kohlensäure der pH-Wert vermindert – das Blut wird „saurer“. Von diesem Absinken des pH-Werts ist das Hämoglobin betroffen. Bei niedrigerem pH-Wert verringert sich seine O2-Bindungskapazität. Das heißt bei gleichem O2-Gehalt der Luft kann vom Hämoglobin weniger Sauerstoff gebunden und transportiert werden. Dieser Sachverhalt wird durch den Bohr-Effekt und den Haldane-Effekt beschrieben. Im Gewebe, wo der Sauerstoff abgegeben werden soll, ist die Konzentration von CO2 höher (= niedriger pH-Wert, geringere O2-Bindungskapazität) und erleichtert damit die O2-Abgabe. In der Lunge sind die Verhältnisse umgekehrt und begünstigen so das „Beladen“ des Hämoglobins mit Sauerstoff.
Dieser indirekte Effekt über den pH-Wert des Blutes ist von der weitaus stärkeren Giftigkeit des Kohlenstoffmonoxids zu unterscheiden. Kohlenstoffmonoxid maskiert als Komplexbildner den Eisenkern des Hämoglobins und verhindert dadurch die Bindung von Sauerstoff in den roten Blutkörperchen. Dies ist ein anderer (wirksamerer) molekularer Mechanismus als beim Kohlenstoffdioxid.
Immer wieder fallen ganze Familien einer Gärgasvergiftung zum Opfer, weil mehrere Personen bei der Rettung eines Familienmitglieds selbst Kohlenstoffdioxid einatmen und bewusstlos werden. Der Ersthelfer begibt sich mit einem Rettungsversuch nur selbst in Gefahr – niemand kann mit angehaltenem Atem einen Bewusstlosen aus einem Keller tragen. Stattdessen ist eine Belüftung (falls vorhanden) einzuschalten und ein Notruf abzusetzen.
Die Rettung eines Verunglückten aus CO2-verdächtigen Situationen (Weinkeller usw.) ist nur durch professionelle Einsatzkräfte (Feuerwehr) mit umluftunabhängigem Atemschutz möglich.
In seltenen Fällen kommt es auch zu Naturkatastrophen mit Kohlenstoffdioxid; die bekannteste ereignete sich 1986 am Nyos-See in Kamerun.
Der Richtwert der CO2-Konzentration in Innenräumen von 0,15 Vol.-% Kohlendioxid kann überschritten werden, wenn sich mehrere Personen längere Zeit in einem kleinen, verschlossenen und gut isolierten Raum aufhalten. Falls sich in einem Raum mit einer Grundfläche von 68 m² und einem Raumvolumen von 203 m³ sieben Erwachsene aufhalten, ist – je nach Beschaffenheit der Raumisolierung – die Konzentration von 0,15 Vol.-% Kohlendioxid nach etwa zwei Stunden erreicht. Gesundheitliche Bedenken gibt es jedoch nur wenn der MAK-Wert längere Zeit überschritten wird.
Ökologische Bedeutung
Kohlenstoffdioxid ist der Rohstoff bei jeglicher Bildung von Biomasse in der Primärproduktion der Ökosysteme. Von pflanzlichen Organismen oder von photosynthesefähigen Bakterien wird CO2 unter Nutzung der Lichtenergie mit Wasser zu Kohlehydraten verbunden, in der Regel zu Glucose. Diese dient in weiteren Verlauf sowohl als Energieträger als auch als Baustoff für alle anderen biochemischen Substanzen.
Der Abbau von Biomasse durch Atmung ist, in Umkehrung zum Prozess der Photosynthese, wieder mit der Bildung von CO2 verbunden.
Alle Organismen eines Ökosystems sind andauernd mit Atmung beschäftigt, während die Photosynthese an die Verfügbarkeit von Licht in den Tagstunden gebunden ist. Deshalb kommt es zu einem Tageszyklus der Bilanz zwischen beiden Vorgängen, so dass in der Regel am Tag das CO2 verbraucht und in der Nacht freigesetzt wird. Ebenso unterliegt diese Bilanz zwischen CO2-Zehrung und CO2-Produktion auch einem jahreszeitlichen Rhythmus wegen der unterschiedlichen Lichtintensitäten und Tageslängen zwischen Sommer und Winter.
In Gewässern schwankt die CO2-Konzentration ebenfalls entsprechend den genannten Tages- und Jahreszeit-Rhythmen. CO2 ist aber mit den anderen gelösten Kohlensäure-Spezies zu einem Gleichgewichtssystem verknüpft, welches den im Wasser herrschenden pH-Wert wesentlich bestimmt. Von diesem pH-Wert hängen dann ihrerseits wieder die Gleichgewichtslagen der Dissoziationen von Ammonium/Ammoniak, Nitrit/Salpetrige Säure und Sulfid/Schwefelwasserstoff und vieler anderer Säure-Basen-Paare ab, die sich ihrerseits in Toxizitäten für die Organismen im Gewässer bemerkbar machen.
Ist in einem Gewässer der Vorrat an CO2 durch Photosynthese erschöpft, was sich durch einen pH-Wert nahe 8,3 bemerkbar macht, dann sind manche Arten von Algen und Wasserpflanzen befähigt, aus dem gelösten Hydrogencarbonat das benötigte CO2 zu gewinnen, wobei sie OH-Ionen abgeben müssen. Dadurch kann in besonders nährstoffreichen Gewässern (z.B. Karpfenteiche) der pH-Wert gefährlich hohe Werte (bis 12) erreichen, mit entsprechenden gesundheitlichen Folgen z.B. für die Fische (z.B. Kiemennekrose der Karpfen). [15]
Im Jahr 2008 publizierten US Forscher die Ergebnisse einer mehrjährigen Untersuchung, wonach ein ungewöhnlich warmes Jahr bei Gräsern aus der Prärie von Oklahoma zu einer verminderten CO2-Aufnahme führt. Nach der Rückkehr von durchschnittlichen Temperaturen dauert es dann noch ein weiteres Jahr, bis sich die CO2-Aufnahme wieder normalisiert.[16]
Siehe auch
- Boudouard-Gleichgewicht
- CO2-Neutralität
- CO2-Partialdruck siehe Partialdruck
- CO2-Sequestrierung
- Emissionsrechtehandel
- Treibstoffverbrauch (CO2-Anteil)
- Versauerung der Meere
Literatur
- Pörtner: Auswirkungen von CO2-Eintrag und Temperaturerhöhung auf die marine Biosphäre (PDF; 1,3 MB, 85 S.)
Weblinks
- Kohlenstoff: Kohlenstoffdioxid, Kohlensäure – Vortrag von Kai Hager im Rahmen der „Übungen im Vortragen mit Demonstrationen – AC“, WS 1998/99 (Didaktik der Chemie, Universität Bayreuth)
- Kohlenstoffdioxid–Daten der englischen Wikipedia (engl.)
- Seilnacht – Naturwissenschaftliche Medien – Infoseite zu CO2
- Umweltbundesamt – Deutsche Emissionshandelsstelle (DEHSt)
- Carbon Dioxide Information Analysis Center des U.S. Department of Energy
- European Energy Exchange
- 12.000 CO2-emittierende Industrieanlagen (EU25) (interaktive Karte)
- Der Treibhauseffekt aus chemischer Sicht
- Carbon Monitoring for Action (CARMA) – Datenbank mit Informationen zu den Kohlenstoffdioxidemissionen von über 50.000 Kraftwerken und 4.000 Energieunternehmen weltweit.
Quellen
- ↑ a b c d e f g Eintrag zu Kohlenstoffdioxid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31.8.2007 (JavaScript erforderlich)
- ↑ Carbon Dioxide Solubility in Water
- ↑ Dr. Pieter Tans, NOAA/ESRL: Current Trends in CO2 (ESRL-Website)
- ↑ http://vorschriften.portal.bgn.de/files/5841/ASI_6-80-08.pdf
- ↑ The natural refrigerant R744 (CO2)
- ↑ Urs Siegenthaler, Thomas F. Stocker, Eric Monnin, Dieter Lüthi, Jakob Schwander, Bernhard Stauffer, Dominique Raynaud, Jean-Marc Barnola, Hubertus Fischer, Valérie Masson-Delmotte, Jean Jouzel: Stable Carbon Cycle–Climate Relationship During the Late Pleistocene. In: Science Vol. 310, No. 5752, 2005, S. 1313–1317. Siehe Abstract online
- ↑ a b Josep Canadella, Corinne Le Quéré, Michael Raupacha, Christopher Fielde, Erik Buitenhuisc, Philippe Ciaisf, Thomas Conwayg, Nathan Gillettc, R. Houghtonh und Gregg Marland: Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks. In: Proceedings of the National Academy of Sciences. 2007 online (PDF)
- ↑ IPCC, 2007: Summary for Policymakers. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change [Solomon, S., D. Qin, M. Manning, Z. Chen, M. Marquis, K.B. Averyt, M.Tignor and H.L. Miller (eds.)]. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA. Online (pdf)
- ↑ Josep G. Canadell, Corinne Le Quéré, Michael R. Raupach, Christopher B. Field, Erik T. Buitenhuis, Philippe Ciais, Thomas J. Conway, Nathan P. Gillett, R. A. Houghton, Gregg Marland: Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks, PNAS November 20, 2007 vol. 104 no. 47 18866-18870 doi:10.1073/pnas.0702737104 online
- ↑ Intergovernmental Panel on Climate Change: Climate Change 2001 – IPCC Third Assessment Report 2001 CO2-Kreislauf
- ↑ Naomi Oreskes: The Scientific Consensus on Climate Change. In: Science. Band 306, 2004 (PDF)
- ↑ Meehl, Gerald A., Warren M. Washington, Caspar M Ammann, Julie M. Arblaster, T. M. L. Wigleiy und Claudia Tebaldi (2004): Combinations of Natural and Anthropogenic Forcings in Twentieth-Century Climate, in: Journal of Climate, Vol. 17, 1. Oktober, S. 3721–3727 (PDF)
- ↑ DRK: Erste Hilfe bei CO2-Vergiftung
- ↑ SenseAir AB, Schweden: What is CO2? (PDF)
- ↑ Kurt Bauer: Zur Bedeutung der Kohlensäure in Karpfenteichen. Österreichs Fischerei 44/1991, S. 49–64
- ↑ J. Arnone et al.: Prolonged suppression of ecosystem carbon dioxide uptake after an anomalously warm year, Nature, Bd. 455, S. 383
Wikimedia Foundation.