- SIDA
-
Acquired Immune Deficiency Syndrome, auch Acquired immunodeficiency syndrome (englisch für „erworbenes Immundefektsyndrom“), zumeist abgekürzt als AIDS oder Aids benannt, bezeichnet eine spezifische Kombination von Symptomen, die beim Menschen in Folge der durch Infektion mit dem Humanen Immundefizienz-Virus induzierten Zerstörung des Immunsystems auftreten.[1] Bei den Erkrankten kommt es zu lebensbedrohlichen opportunistischen Infektionen und Tumoren. Bereits während der mehrjährigen, symptomfreien Latenzphase können antiretrovirale Medikamente eingesetzt werden, die die Lebenserwartung von Infizierten steigern. Eine Heilung ist jedoch nicht möglich, da die HI-Viren nicht vollständig aus dem Körper entfernt werden können.
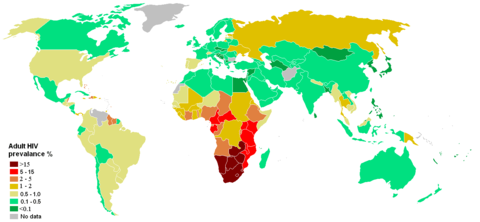
AIDS wurde am 1. Dezember 1981 als eigenständige Krankheit erkannt und tritt in Gestalt einer Pandemie auf. Laut UNAIDS lebten Ende 2007 weltweit etwa 33 Millionen HIV-positive Menschen. 2007 kam es zu etwa 2,7 Millionen HIV-Neuinfektionen, und etwa zwei Millionen Menschen starben an den Folgen von HIV/AIDS.[2] Der Anteil der HIV-Infizierten liegt weltweit durchschnittlich bei etwa ein Prozent der 15- bis 49-jährigen, erreicht in einzelnen afrikanischen Staaten jedoch Werte um zwanzig Prozent.[3]
Definition und Klassifikation
Klassifikation im ICD-10
Klassifikation nach ICD-10 B20 Infektiöse und parasitäre Krankheiten infolge HIV-Krankheit B21 Bösartige Neubildungen infolge HIV-Krankheit B22 Sonstige näher bezeichnete Krankheiten infolge HIV-Krankheit B23 Sonstige Krankheitszustände infolge HIV-Krankheit B24 Nicht näher bezeichnete HIV-Krankheit Z21 Asymptomatische HIV-Infektion ICD-10 online (WHO-Version 2006) Im ICD-10 können zahlreiche Krankheiten als Folge einer HIV-Infektion codiert werden, beziehungsweise auch die HIV-Infektion ohne Symptome. Die genaue Art der Folgeerkrankung wird in der zuletzt 2006 von der Weltgesundheitsorganisation aktualisierten Version des ICD-10 in einer vierten Stelle verschlüsselt, zum Beispiel: B20.6 Pneumocystis-Pneumonie infolge HIV-Krankheit.
Der ICD wurde ursprünglich geschaffen, um die weltweite Erforschung von Morbidität und Mortalität mit einer international einheitlichen Systematik zu ermöglichen. In vielen Ländern dient der ICD-10 – zum Teil in nationaler Anpassung – zusätzlich als Grundlage für die Vergütung von medizinischen Leistungen.
CDC-Definition
Die international anerkannteste und am weitesten verbreitete Definition von AIDS ist die Klassifikation der Centers for Disease Control and Prevention. Sie berücksichtigt klinische Befunde und Laborparameter.
HIV-Infektionen werden hiernach in drei Kategorien unterteilt, A bis C. Die Kategorien A und B enthalten asymptomatische HIV-Infektionen beziehungsweise HIV-assoziierte, jedoch nicht-AIDS-definierende Krankheitsbilder. Die Kategorie C enthält die AIDS-definierenden Erkrankungen. Es handelt sich um opportunistische und maligne Erkrankungen, die bei einem gesunden Immunsystem nicht oder nicht in der vorliegenden Weise auftreten.
AIDS-definierende Erkrankungen sind:
- Candidose von Bronchien, Trachea oder Lungen
- Candidose, ösophageal
- CMV-Infektionen (außer Leber, Milz, Lymphknoten)
- CMV-Retinitis (mit Visusverlust)
- Enzephalopathie, HIV-bedingt
- Herpes simplex-Infektionen: chronische Ulzera (> ein Monat bestehend; oder Bronchitis, Pneumonie, Ösophagitis)
- Histoplasmose, disseminiert oder extrapulmonal
- Isosporiasis, chronisch, intestinal, > ein Monat bestehend
- Kaposi-Sarkom
- Kokzidioidomykose, disseminiert oder extrapulmonal
- Kryptokokkose, extrapulmonal
- Kryptosporidiose, chronisch, intestinal, > ein Monat bestehend
- Lymphom, Burkitt
- Lymphom, immunoblastisches
- Lymphom, primär zerebral
- Mycobacterium avium complex or M. kansasii, disseminiert oder extrapulmonal
- Mycobacterium, andere oder nicht identifizierte Spezies disseminiert oder extrapulmonal
- Pneumocystis-Pneumonie
- Pneumonien, bakteriell rezidivierend (> zwei innerhalb eines Jahres)
- Progressive multifokale Leukenzephalopathie
- Salmonellen-Septikämie, rezidivierend
- Tuberkulose
- Toxoplasmose, zerebral
- Wasting-Syndrom
- Zervixkarzinom, invasiv
Daneben gibt es eine Einteilung von Laborwerten nach CD4-Zellen/µl:
- Kategorie 1: >= 500 CD4-Zellen/µl
- Kategorie 2: 200 – 499 CD4-Zellen/µl
- Kategorie 3: < 200 CD4-Zellen/µl
Nach CDC-Definition müssen immer ein positiver HIV-Test und ein Bestätigungs-Test vorliegen.
In der CDC-Definition werden einige opportunistische Infektionen nicht berücksichtigt. In Südostasien ist beispielsweise eine Infektion mit Penicillium marneffei bei HIV-Patienten häufig. Auch andere Erkrankungen (Aspergillosen, Mikrosporidiosen, Leishmaniosen, Morbus Hodgkin, …) sind bislang unberücksichtigt. Dagegen sind Histoplasmosen oder Isosporidiosen in unseren Breiten Raritäten. Ein großes Problem der eng gefassten Definition ist, dass in vielen Ländern der Zugang zu Medikamenten nur mit einer AIDS-Diagnose nach CDC-Klassifikation möglich ist.
Bangui-Definition
Punktesystem der Bangui-Definition Symptome/Erkrankungen Punktzahl Wichtige Symptome Ungewollter Gewichtsverlust über 10% 4 Asthenie (Kraftlosigkeit) 4 Häufige Symptome Fieber für mehr als einen Monat (durchgängig oder unterbrochen) 3 Durchfall für mehr als einen Monat 3 Andere Symptome Husten 2 Lungenerkrankungen 2 Juckende Dermatitis 4 Ösophageale Candidose 4 Chronische oder generalisierte Herpes simplex Infektion 4 Herpes Zoster 4 Generalisierte Lymphadenopathie 2 Neurologische Symptome 2 Kaposi-Sarkom 12 Kryptokokkenmeningitis 12 Im Gegensatz zur CDC-Definition basierte die afrikanische Bangui-Definition der WHO aus dem Jahr 1985 ausschließlich auf einer klinischen Diagnose.[4]
In Afrika ist bis heute ein HIV-Test in der Regel weder bezahlbar, noch allumfassend durchführbar. In der ersten Fassung der Bangui-Definition wurde der positive HIV-Test als notwendige Bedingung deshalb weggelassen. Statt dessen wurden mehrere nach einem Punktesystem bewertete klinische Symptome herangezogen. Ausschlusskriterien für eine Diagnose nach der Bangui-Definition waren starke Unterernährung, Krebs oder eine immunsuppressive Behandlung. Sobald 12 oder mehr Punkte erreicht waren und kein Ausschlusskriterium vorlag, galt die Diagnose AIDS als gesichert.[5] Für Kinder galt eine leicht angepasste Definition.
Die WHO gab 1994 eine erweiterte AIDS-Definition für Afrika heraus.[6] Es wurde nun empfohlen einen HIV-Test zu machen. Zusätzlich wurde die Liste der Symptome gekürzt und spezifiziert. Gleichzeitig wurde festgelegt, dass immer dann, wenn kein HIV-Test durchgeführt werden kann, weiterhin die Bangui-Definition gelten soll.
Übertragung
Das HI-Virus wird mit den Körperflüssigkeiten Blut, Sperma, Vaginalsekret, Liquor cerebrospinalis und Muttermilch übertragen. Potentielle Eintrittspforten sind frische, noch blutende Wunden in Schleimhäuten (Bindehaut, Mund-, Nasen-, Vaginal- und Analschleimhaut) bzw. nicht ausreichend verhornte, leicht verletzliche Stellen der Außenhaut (Eichel, Innenseite der Vorhaut). Die häufigsten Infektionswege sind der Vaginal- oder Analverkehr ohne Verwendung von Kondomen, der aufnehmende Oralverkehr (Schleimhautkontakt mit Sperma bzw. Menstruationsblut; bei unverletzter Mundschleimhaut stellt der Kontakt mit Präejakulat oder Vaginalsekret ein vernachlässigbares Infektionsrisiko dar, ebenso der passive Oralverkehr) und die Benutzung kontaminierter Spritzen bei intravenösem Drogenkonsum. Homosexuelle Männer gelten als Risikogruppe, da häufige Partnerwechsel und Analverkehr in der Szene weit verbreitet sind. Wie hoch das Risiko beim Geschlechtsverkehr ist, hängt vor allem von der Viruslast in der Samenflüssigkeit, im Scheidensekret und im Blut ab. Diese ist unmittelbar nach der Infektion, bevor sich Antikörper gebildet haben, besonders hoch, nimmt dann ab und steigt in späten Stadien der Erkrankung wieder an.
Bluttransfusionen bergen ebenfalls das Risiko einer HIV-Infektion, Routineüberwachung der Blutspender – wie sie in Deutschland seit 1985 durchgeführt wird – reduziert dieses jedoch stark. Aufgrund des durchschnittlich etwa 25 Tage andauernden Zeitfensters, während dessen eine Neuinfektion noch nicht durch einen Test nachgewiesen werden kann, verbleibt jedoch eine Restgefahr.[7]
Das Risiko einer Infektion eines Kindes durch eine HIV-infizierte Mutter während der Schwangerschaft oder während der Geburt wird auf 10 bis 30 Prozent[8] geschätzt. Bei bekannter HIV-Infektion der Mutter kann das Risiko einer Übertragung auf das Kind durch die Gabe antiretroviraler Medikamente und die Geburt durch Kaiserschnitt auf ca. zwei Prozent vermindert werden.
Vor allem in der Anfangszeit der Epidemie infizierten sich viele intravenös-Drogenabhängige durch die gemeinsame Nutzung von Injektionsnadeln. Auch Ärzte und pflegerisches Personal haben ein gewisses Risiko der Ansteckung bei Nadelstichverletzungen im OP oder nach Punktionen an infizierten Patienten.
Die HIV-Konzentration in Tränen, Schweiß, Speichel und Urin reicht für eine Ansteckung nach heutigem Erkenntnisstand nicht aus. Zudem erscheint aufgrund der AIDS-Epidemiologie eine Infektion über Insekten oder Tröpfcheninfektion als unwahrscheinlich. [9]
Mittels postexpositioneller Prophylaxe (PEP) kann nach einem Vorfall einer möglichen Infektion entgegengewirkt werden. Die 28 Tage andauernde, medikamentöse PEP bietet nur dann vollständigen Schutz, wenn die Behandlung innerhalb von zwei Stunden nach Exposition begonnen wird und kann bis zu 24 nach intravenöser und bis zu 72 Stunden nach Exposition über die Schleimhäute noch immer wirksam sein.[8]
Des Weiteren besteht ein Ansteckungsrisiko (bei Patienten mit AIDS-Vollbild, also bei einer CD4-Konzentration <200 mlU/ml) mit den typischen opportunistischen Erregern: Viren der Herpes-Gruppe, Candida, Streptokokken, Pneumokokken. Partner von Patienten mit AIDS-Vollbild sollten sich auch über diese Erreger und deren Infektionswege informieren.
Ansteckungswahrscheinlichkeit
- Hauptquelle dieses Abschnitts: Leitlinie „Postexpositionelle Prophylaxe der HIV-Infektion“ der AWMF[10] (hierbei ist die Grundlage aus neun Studien: drei amerikanische Studien aus der Schwulen-Szene, drei aus heterosexuellen Infektionsstudien aus Afrika, zwei Wahrscheinlichkeitsstudien und diese Studie).[11]
Übertragung Mutter/Kind
Die Infektionswahrscheinlichkeit von der unbehandelten Mutter auf das Kind während der natürlichen Geburt wird, je nach Studie, mit zehn bis vierzig Prozent angegeben[12]. Die Wahrscheinlichkeit solch einer vertikalen Transmission während und nach der Geburt lässt sich durch antiretrovirale Therapie der Mutter ab dem 3. Trimester, Kaiserschnitt und Verzicht aufs Stillen auf unter zwei Prozent senken.
Übertragung durch Bluttransfusionen
Das Infektionsrisiko beim Erhalt einer verseuchten Bluttransfusion liegt bei 95 Prozent. In den 1980er Jahre traten daher weltweit tausende Infektionen durch HIV-kontaminierte Blutprodukte auf. Mittlerweile wird das Risiko für eine HIV-Übertragung durch eine Bluttransfusion im Allgemeinen in Deutschland auf unter ein auf drei Millionen Transfusionen geschätzt.[13]
Übertragung durch Nadeln/Kanülen/Nadelstiche
Das Infektionsrisiko durch Nadelstiche hängt sehr von der Situation ab. Das Infektionsrisiko wird durchschnittlich mit 0,3 Prozent angegeben und steigt mit folgenden Faktoren: sehr tiefe Verletzungen (16-fach erhöht), sichtbare Blutspuren auf der Nadel oder Nadel war vorher in einer Vene oder Arterie des Überträgers (jeweils fünffach erhöht), bei hoher Viruslast des Überträgers (sechsfach erhöht). Das Risiko bei Hohlnadeln ist höher als bei geschlossenen Nadeln.
Das Risiko, sich bei gemeinsamer Benutzung einer Kanüle, meist beim Spritzen von Heroin, zu infizieren, liegt um 0,7 Prozent und sinkt mit dem zeitlichen Abstand zwischen den Injektionen, allerdings nur langsam, da in der Kanüle eingeschlossene Viren lange infektiös bleiben können, teilweise auch noch nach Tagen. Ein Auskochen der Nadeln ist zwar generell möglich, wenn es lange genug durchgeführt wird, allerdings sind handelsübliche Nadeln nicht dafür geeignet, weil die verwendeten Kunststoffe nicht entsprechend hitzefest sind. Eine chemische Desinfektion (Alkohol oder andere Desinfektionsmittel) ist nicht ausreichend, weil nicht gewährleistet ist, dass die Substanzen ganz in die Kanüle eindringen.
Übertragung durch Geschlechtsverkehr
Das individuelle Risiko einer Infektion mit HIV durch Geschlechtsverkehr ist sehr variabel und hängt von vielen Faktoren ab. Eine Infektion ist nach einmaligem Geschlechtsverkehr möglich, es sind jedoch auch Fälle bekannt, in denen trotz mehrjährigen Sexualkontaktes mit einem infizierten Partner keine Ansteckung erfolgte. Eine gleichzeitig vorliegende andere Geschlechtserkrankung erhöht das Infektionsrisiko um das 5- bis 10-fache, eine hohe Viruslast des Überträgers sogar um das 10- bis 30-fache. Frischinfizierte weisen eine hohe Viruslast auf, da der Körper in diesem Stadium über keine spezifischen Antikörper verfügt. Geschlechtsverkehr während der Regelblutung der Frau ist mit einem erhöhten Infektionsrisiko für beide Partner verbunden, beschnittene Männer haben ein geringeres Infektionsrisiko. Insgesamt scheint das Infektionsrisiko nicht konstant über die Anzahl der Kontakte zu sein, so dass das Risiko einzelner Kontakte womöglich erheblich zu niedrig angegeben ist. Mit besseren Medikamenten sinkt möglicherweise das Übertragungsrisiko durch die sinkende Viruslast in Blut und Sekreten.
- Vaginalverkehr: Ungeschützter vaginaler Geschlechtsverkehr ist mit hohem Risiko behaftet.
- Bei Analverkehr treten häufig kleine Risse an der Schleimhaut auf, daher ist das Risiko im Vergleich zum Vaginalverkehr nochmals signifikant erhöht.
- Fellatio, Oralverkehr mit Spermaaufnahme durch den Mund: Das Infektionsrisiko ist sehr gering, eine Infektion ist jedoch nicht ausgeschlossen.
- Eine Infektion durch Vorflüssigkeit (Präejakulat) ist eher unwahrscheinlich.
- Cunnilingus, Oralverkehr bei der Frau: Das Risiko wird ebenfalls äußerst gering eingeschätzt, solange kein Kontakt mit Menstruationsblut stattfindet.
- Rimming: Das Risiko wird als äußerst gering eingeschätzt.
- Andere Sexualpraktiken, bei denen kein Kontakt zu Schleimhäuten, Blut, Sperma oder Vaginalsekret besteht, haben ein extrem geringes Infektionsrisiko.
Postexpositionelle Prophylaxe
Teilweise besteht die Möglichkeit einer Postexpositionsprophylaxe. Diese besteht aus allgemeinen Maßnahmen (Waschen des Penis nach dem Verkehr, Ausdrücken der Stichwunden und Behandlung mit Desinfektionsmittel) und spezifischen Maßnahmen wie der Gabe von antiretroviralen Medikamenten.
Nach einem Ansteckungsverdacht sollte immer sofort ein Arzt aufgesucht werden, der über mögliche Maßnahmen informiert und diese auch einleiten kann. Im Idealfall sollte mit der Postexpositionsprophylaxe bereits zwei Stunden nach der Risikosituation begonnen werden. Die Medikation entspricht im Wesentlichen der antiretroviralen Tritherapie eines HIV-positiven Patienten.
HIV-Tests
Siehe auch Hauptartikel: HIV-Test
HIV-Tests unterteilen sich in Suchtests und Bestätigungstests. Ziel eines Suchtests (z. B. ELISA-Suchtest) ist es, möglichst alle infizierten Personen zu erkennen – um den Preis, dass auch einige nicht-infizierte fälschlicherweise positiv getestet werden. Wird eine Person im Suchtest positiv getestet, so ist in vielen Ländern ein Bestätigungstest (in Deutschland und den USA: Western-Blot-Bestätigungstest) vorgeschrieben, um eine falsch positive Diagnose zu verhindern. HIV-Tests werden meist in einem Labor durchgeführt. Es existieren jedoch auch Schnelltests, die ohne technische Hilfsmittel teilweise bereits nach fünf Minuten ein Ergebnis anzeigen können. [14]
Ein HIV-Test darf nur mit ausdrücklicher Zustimmung des Betroffenen durchgeführt werden, eine Testung ohne Wissen des Patienten ist rechtlich unzulässig und kann dementsprechend geahndet werden. In Deutschland muss ein positiver HIV-Test gemäß Infektionsschutzgesetz in anonymisierter Form an das Robert-Koch-Institut in Berlin gemeldet werden. In Österreich ist nur die AIDS-Erkrankung, nicht aber die bloße HIV-Infektion meldepflichtig.
Krankheitsverlauf
Eine HIV-Infektion verläuft in vier Phasen:
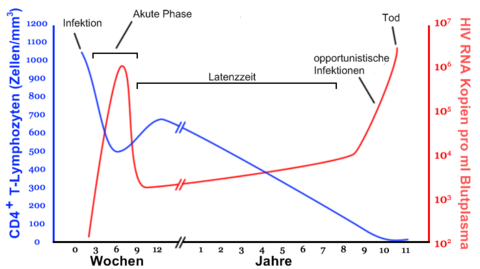
Akute Phase (vier bis sechs Wochen)
Zwei bis sechs Wochen nach einer Infektion können grippeähnliche Symptome wie Fieber, Nachtschweiß, geschwollene Lymphknoten, Übelkeit usw. auftreten.
Die häufigsten Symptome einer akuten HIV-Infektion sind (angegeben nach der Wahrscheinlichkeit des Auftretens)[15]
- 80 % Fieber
- 78 % Abgeschlagenheit, Müdigkeit
- 68 % Unwohlsein, Krankheitsgefühl
- 54 % Kopfschmerzen
- 54 % Appetitverlust
- 54 % Arthralgien (Gelenkschmerzen)
- 51 % Hautausschlag
- 51 % Nachtschweiß
- 49 % Myalgien (Muskelschmerzen)
- 49 % Übelkeit
- 46 % Diarrhoe (Durchfall)
- 46 % Fieber und Ausschlag (als Kombination)
- 44 % Pharyngitis oder Schluckschmerzen
- 37 % orale Ulzerationen (Geschwüre im Mund)
- 34 % Steifer Nacken (vermutlich aufgrund der auch dort befindlichen und angeschwollenen Lymphknoten)
- 32 % Gewichtsverlust größer als 2,5 kg
- 24 % Lichtempfindlichkeit
Manche Patienten bemerken obige Symptome jedoch nicht oder sie haben keine.
Zur Diagnostik einer akuten HIV-Infektion dient ein positiver HIV-RNA-Test durch eine RT-PCR und ein negativer oder „grenzwertiger“ Bestätigungstest.[15]
Latenzphase
In dieser Zeit vermehrt sich das Virus im Körper. Betroffene, sofern sie von ihrer Infektion wissen, leiden allenfalls psychisch darunter, körperliche Symptome treten hingegen keine auf. Die Latenzzeit dauert im Durchschnitt neun bis elf Jahre. Es gibt sowohl Patienten, die innerhalb von Monaten nach der Ansteckung AIDS entwickeln, als auch solche, bei denen trotz Ansteckung in den 80er Jahren und ohne HAART bis heute keine Progression zu AIDS festzustellen ist.[16]
(A)ids (R)elated (C)omplex
Es treten die gleichen Beschwerden wie in der Akutphase auf. Sie gehen jedoch nicht mehr zurück.
Krankheitsphase
Die Diagnose AIDS wird gestellt, wenn bei einem HIV-Positiven bestimmte Infektionen oder bösartige Tumoren, die sogenannten AIDS definierenden Erkrankungen, festgestellt werden. Die Infektionen werden als opportunistische Infektionen bezeichnet. Für das (intakte) Immunsystem eines gesunden Menschen sind sie oft harmlos. Durch das kompromittierte Immunsystem eines HIV-Positiven kann sich der Organismus jedoch nicht ausreichend wehren; es treten die oben genannten Infektionen auf. Als Maß für die Zerstörung des Immunsystems dient die T-Helfer-Zellen-Zahl im Blut eines HIV-Infizierten. Unter der Schwelle von 200–400 / µl Blut ist die Therapie indiziert.
Therapie
Highly Active Antiretroviral Therapy (HAART)
Mit Highly active antiretroviral therapy (HAART) wird die medikamentöse Kombinationstherapie aus mindestens drei antiretroviralen Wirkstoffen bezeichnet. Ziel von HAART ist, den Ausbruch des Krankheitsbildes AIDS hinauszuzögern. Eine erfolgreiche HAART drückt die Viruslast (Konzentration des HI-Virus im Blut) unter die Nachweisgrenze und erhöht die CD4-Zellwerte, d. h. das Immunsystem wird gegen opportunistische Infektionen und andere AIDS-definierende Erkrankungen gestärkt. Es ist nicht möglich, das HI-Virus durch HAART aus dem Körper zu eliminieren.
Aufgrund neuer medizinischer Studienergebnisse sowie der Entwicklung und Zulassung neuer antiretroviraler Arzneistoffe und Substanzklassen befindet sich HAART in einem kontinuierlichen Entwicklungsprozess. Dennoch gibt es eindeutige Leitlinien auf nationaler[17][18][19], europäischer [20] und internationaler[21] Ebene zu den verschiedenen Aspekten der antiretroviralen Therapie.
Startzeitpunkt einer HAART
Die Kriterien für den besten Startzeitpunkt einer HAART sind in den jeweiligen nationalen Leitlinien definiert. Diese wägen die Gefahr an AIDS zu erkranken gegen die Risiken der Langzeittoxizität und Resistenzbildung ab. Während Mitte der 1990er Jahre die Mutationsgeschwindigkeit des Virus und die Annahme einer möglichen Eradikation zu einer „Hit hard and early!“-Strategie bei der Behandlung verleiteten, führte die Entdeckung mitochondrialer Toxizität zur Zurückhaltung. Heute beginnt eine HAART erst bei deutlicher Schwächung des Immunsystems.
Die Europäische Empfehlung zum Therapiebeginn berücksichtigt drei Faktoren: Das klinische Bild des Patienten, seinen CD4-Wert und die Viruslast.
Patienten, die bereits AIDS-definierende Erkrankungen haben (CDC C), wird eine HAART dringend empfohlen. Auch beim Auftreten von Erkrankungen, die auf ein geschwächtes Immunsystem hindeuten, jedoch nicht AIDS-definierend sind (CDC B), wird eine HAART empfohlen. Dies gilt auch für Patienten, die symptomfrei sind, aber einen CD4+ Wert unter 200 haben, da es dann meist eine Frage der Zeit ist, bis AIDS auftritt. Als im Allgemeinen ratsam wird eine Therapie bei Patienten angesehen, die einen CD4+ Wert zwischen 200 und 350 haben. Ebenso angeraten ist der Beginn der HAART laut der Empfehlung bei Patienten mit einem CD4+ Wert zwischen 350 und 500, wenn eine hohe Viruslast vorliegt (> 100.000).
Aufgrund der für den Patienten weitreichenden Konsequenzen, wird die Entscheidung individuell getroffen, so dass der Patient zuvor über Risiken und Nebenwirkungen ausreichend informiert und psychisch auf diese Therapie eingestellt ist.
Durch eine antiretrovirale Therapie (ART), das heißt, die Einnahme von HIV-unterdrückenden Medikamenten, und Behandlung von Sekundärinfektionen kann der Krankheitsverlauf verlangsamt werden. Da das Virus schnell Resistenzen gegenüber einzelnen Medikamenten entwickelt, hat sich die Therapie durch gleichzeitige Einnahme mehrerer Medikamente durchgesetzt, die so genannte „Highly Active Antiretroviral Treatment“ (HAART).
Antiretrovirale Therapie kann die Lebenserwartung HIV-Infizierter deutlich verlängern, jedoch keine vollständige Eradikation des Virus – und damit eine Heilung – bewirken. Zudem können schwerwiegende Nebenwirkungen auftreten. Eine einmal begonnene ART sollte nicht mehr abgesetzt werden, um Resistenzbildung zu verhindern. Aus demselben Grund ist eine regelmäßige Tabletteneinnahme unumgänglich (siehe Adherence). Daraus ergibt sich eine hohe Belastung für den Patienten.
Zur Zeit werden drei Wirkstoffklassen angewandt: Nukleosid- und Nukleotidanaloga (NRTI), Nichtnukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI) und Protease-Inhibitoren (PI). Eine weitere Wirkstoffklasse stellen Fusionsinhibitoren wie die Substanz T-20 dar.
Wirkstoffe
Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI)
Nukleosid-Analoga, auch Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI, umgangssprachlich „Nukes“) genannt, setzen an der reversen Transkriptase an, einem Enzym des HI-Virus, das das virale RNA-Genom in doppelsträngige DNA „übersetzt“. Anschließend baut ein weiteres virales Enzym, die Integrase, diese Virus-DNA in die DNA der Wirtszelle ein. Die NRTI stellen hierbei ein alternatives Substrat dar, die mit den physiologischen Nukleosiden konkurrieren, sich von diesen jedoch durch ein verändertes Zuckermolekül unterscheiden. Der Einbau der NRTI behindert die Struktur der Doppelstrangbindung und führt daher zu Kettenabbrüchen in der Virus-DNA.
Hierbei entsprechen die Wirkstoffe Zidovudin (Azidothymidin, AZT) und Stavudin (d4T) dem DNA-Baustein Thymidin, Lamivudin (3TC) dem Cytidin, während Didanosin (DDI) analog zu Inosin und Abacavir ein Guanosin-Anologon ist. Eine Kombination von Analoga mit gleichem Ansatzpunkt (etwa AZT und d4T) ist nicht sinnvoll.
Zahlreiche Nebenwirkungen können bei der Therapie mit NRTI auftreten. Häufig sind Kopfschmerzen, gastrointestinale Beschwerden, Völlegefühl oder Übelkeit, Erbrechen und Diarrhoeen sowie allgemeine Müdigkeit. Als Folge längerer Anwendung kann es zur Laktatazidose (Ansammlung von Milchsäure im Blut), Myelotoxizität (Knochenmarksschädigung), Schädigung peripherer Nerven und Bauchspeicheldrüsenentzündungen kommen. Auch eine Lipodystrophie, eine auch bei Therapie mit Protease-Inhibitoren zu beobachtende Umlagerung von Körperfett, kann bei längerer Einnahme von NRTI auftreten.
Viele dieser Nebenwirkungen sind eine Folge der mitochondralen Toxizität: Mitochondrien, die lebenswichtigen Kraftwerke der Zellen, benötigen ebenfalls Nukleoside. Durch den Einbau von NRTI statt Nukleosiden kommt es zu Stoffwechselstörungen und zur Degeneration der Mitochondrien.[22] Bei der Toxizität der einzelnen Substrate gibt es erhebliche Unterschiede.
NRTI werden unverändert in die Zelle aufgenommen und dort durch Phosphorylierung aktiviert. Sie werden überwiegend über die Niere (renal) eliminiert und haben daher wenig Wechselwirkung mit Medikamenten, die in der Leber verstoffwechselt werden.
Nicht-Nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI)
Während NRTIs als „falsche“ Bausteine die reverse Transkriptase hemmen, binden Nicht-Nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI) direkt an dieses Enzym, nahe der Substratbindungsstelle für Nukleoside. Zurzeit gibt es drei NNRTIs auf dem Markt: Nevirapin, Delavirdin und Efavirenz. Während Nevirapin und Efavirenz etwa gleich effektiv sind, spielt Delaviridin in der Therapie kaum eine Rolle und ist in Deutschland (noch) nicht zugelassen.
Als Einzelsubstanz zeigen NNRTIs nur eine begrenzte Wirkung, in Kombinationstherapie mit zwei NRTIs sind sie aus immunologisch-virologischer Sicht mit Proteaseinhibitoren gleichwertig. Bisher konnte keine Studie nachweisen, dass die Überlebenszeit verbessert wurde und die Krankheit langsamer fortschreitet als mit HAART.[23] Jedoch wurde eine Verbesserung der Lebensqualität beschrieben.[24] Zur Zulassung wurden ausschließlich Studien zu verbesserten CD4+ Zellzahlen und zur niedrigeren Viruslast benutzt (Surrogat-Marker-Studien). Durch ihre gute Verträglichkeit und die geringere Pillenzahl werden sie häufig den Proteaseinhibitoren vorgezogen. NNRTIs sind recht empfindlich: Schon eine Punktmutation genügt, um eine Resistenz des Virus gegen den Wirkstoff zu erzeugen. Zudem bestehen Kreuzresistenzen: Zeigt ein Virus Resistenzen gegen einen NNRTI, so sind meist alle NNRTIs wirkungslos. NNRTIs werden in der Leber verstoffwechselt (Cytochrom P450-System).
Die Nebenwirkungsprofile der einzelnen Wirkstoffe unterscheiden sich erheblich. Bei der Therapie mit Nevirapin stehen vor allem allergische Reaktionen und Lebertoxizität im Vordergrund. Ein Ausschlag tritt bei bis zu zwanzig Prozent der Patienten auf und führt bei sieben Prozent zum Abbruch der Nevirapineinnahme. Um die Gefahr von Allergien zu mindern, wird Nevirapin zu Beginn der Therapie in niedriger Dosierung gegeben. Anschließend wird die Dosis schrittweise erhöht. Lebertoxizität ist eine seltene, aber unter Umständen lebensbedrohliche Nebenwirkung von Nevirapin. Daher sollten zu Beginn der Therapie die Leberwerte (vor allem die Transaminasen) engmaschig kontrolliert werden.
Die Nebenwirkungen von Efavirenz betreffen hingegen vor allem das zentrale Nervensystem. Sie treten meist zur Beginn der Therapie auf und schwächen sich danach ab. In den ersten vier Wochen in einer Studie traten bei zwei Drittel der Patienten Schwindel, nahezu der Hälfte Albträume und bei etwa einem Drittel der Patienten Benommenheit und Schlafstörungen auf. Diese nahmen aber meist nach einiger Zeit ab. Während Nevirapin zur Vorbeugung einer Mutter-zu-Kind-Übertragung (PMTCT = Prevention of Mother to Child Transmission) eingesetzt wird, ist Efivarenz in der Schwangerschaft kontraindiziert. Angesichts der Wirkung auf das zentrale Nervensystem ist die Verkehrstauglichkeit fraglich. Ein Vorteil von Efavirenz gegenüber Nevirapin ist die geringere Lebertoxizität.
Delavirdin ist wegen der hohen Pillenzahl und der dreimal täglichen Einnahme den anderen Wirkstoffen unterlegen. Zudem ist es zurzeit nicht auf dem deutschen Markt zugelassen.
Proteaseinhibitoren (PI)
Kann das HIV-Enzym Protease das virale Makromolekül gag-pol-Polyprotein nicht spalten, so werden nicht-infektiöse Viruspartikel produziert. Protease-Inhibitoren wurden mit dem Wissen über die molekulare Struktur des Enzyms so modelliert, dass sie direkt im aktiven Zentrum der Protease binden können. Die gute Wirksamkeit von Proteaseinhibitoren wurde anhand von klinischen Endpunkten nachgewiesen. Sie haben zu einer deutlichen Verbesserung der Therapie beigetragen.[25] Bei der Langzeitbehandlung zeigen sich jedoch einige Probleme, die zu Störungen im Fettstoffwechsel führen und in der Folge Lipodystrophie (Fettverteilungsstörungen) und Dyslipidämie (erhöhte Blutfettwerte) auslösen können. Der Grund liegt wahrscheinlich in der mitochondrialen Toxizität, da Proteaseinhibitoren offenbar ähnlich den NRTI die Mitochondrien schädigen.[22] Weitere Nebenwirkungen sind gastrointestinale Beschwerden.
Proteaseinhibitoren haben relativ kurze Halbwertszeiten im Blutplasma. Schon nach acht Stunden ist die minimale Hemmkonzentration erreicht. Daher müssen die meisten Proteaseinhibitoren dreimal täglich eingenommen werden.
Der Abbau der Proteaseinhibitoren geschieht in der Leber durch das Cytochrom-P450-Enzymsystem. Der Proteaseinhibitor Ritonavir hemmt dieses System. Man ging daher dazu über, andere Proteaseinhibitoren zusammen mit Ritonavir zu verabreichen, um den Abbau zu verlangsamen und die Plasma-Halbwertszeit zu verlängern. Dies wird als „Booster“ bezeichnet. Mittlerweile gibt es den Proteaseinhibitor Lopinavir kombiniert mit einer Boosterdosis Ritonavir (Kaletra).[26] Dies führt zu einer fast 100-fach größeren Plasma-Konzentration von Lopinavir und zu einer größeren Barriere gegen Resistenzen. Daher wird Lopinavir/Ritonavir (Kaletra) zumeist nach Therapieversagen anderer Medikamente benutzt („Salvage-Bereich“).
Ein weiteres Problem ist die Wechselwirkung von Proteaseinhibitoren mit vielen anderen Substanzen: Zum einen über das Cythochrom-P450 Enzym-System mit den Alkaloiden von Grapefruit, zum anderen besteht eine gegenseitige Wechselwirkung (sowohl gegenseitige Abschwächung als auch gegenseitige Verstärkung) zu Östrogen, was den gleichzeitigen Einsatz von Proteasehemmern und hormonellen Kontrazeptiva verhindert.[27]
Entry-Inhibitoren
Entry-Inhibitoren unterbrechen den Eintritt des Virus in die Wirtszelle.
Fusions-Inhibitoren (FI)
Anfang 2003 wurde der erste Fusionsinhibitor Enfuvirtid (entwickelt unter der Bezeichnung T-20) auf den Markt gebracht. T-20 bindet an das für die Fusion des Virus mit der Zellmembran der T-Helferzellen wichtige Transmembranprotein gp41 und blockiert so den Eintritt des Virus in die Zelle. Besonders interessant wird die Substanz dadurch, dass sie keine mitochondriale Toxizität und damit kein Lipodystrophiesyndrom auslöst.
T-20 ist mit seinen 36 Aminosäuren zu groß für eine orale Einnahme. In seiner jetzigen Form muss T-20 täglich subkutan gespritzt oder über eine Infusionspumpe verabreicht werden. Als Nebenwirkung treten häufig Hautirritationen an der Einstichstelle auf.
Erste Studien ergaben, dass die eine bloße Hinzugabe von T-20 zu einer klassischen antiretroviralen Therapie nur einen begrenzten Erfolg mit sich bringt. Zwei große Studien, die T-20 zu einer optimierten HAART gegen eine optimierte HAART ohne T-20 verglichen, zeigte jedoch signifikant bessere Werte im T-20-Arm der Studie. Das lässt darauf schließen, dass besonders diejenigen Patienten von T-20 profitieren, die gleichzeitig auch noch andere medikamentöse Optionen haben.[28]
T-20 kann offenbar zu Interaktionen mit Granulozyten führen, die bei einigen Patienten zu vermehrten Infektionen führten.
Eine rasche Resistenzbildung des Virus ist zudem recht wahrscheinlich. Jedoch scheint die virale Angepasstheit an den menschlichen Wirt der resistenten Stämme vermindert zu sein.
Dennoch ermöglicht T-20 Patienten eine Option, die auf Grund von Nebenwirkungen oder Resistenzen ihre Therapie umstellen müssen. Erste Wahl zu Therapiebeginn ist T-20 derzeit jedoch nicht, und das nicht nur auf Grund der Studienlage. T-20 ist nach Aussage der Herstellerfirma F. Hoffmann-La Roche AG einer der am aufwändigsten zu produzierenden Substanzen der Firmengeschichte. Dies macht sich im Preis deutlich, der mit über 24.000 Euro pro Jahr höher als einige Dreifachkombinationen herkömmlicher antiretroviraler Medikamente liegt.
Weiterhin gibt es seit Frühjahr 2007 Maraviroc (MVC) im Extended Acces-Programm zur Letztbehandlung von HIV-Patienten, die sonst keine Therapieoption mehr haben.
An anderen Fusionsinhibitoren und an einer wöchentlich zu verabreichenden T-20-Injektion wird geforscht.
Integrase-Inhibitoren
Nach vielen Fehlschlägen und Schwierigkeiten in den 1990ern begann ab 2000 die Entwicklung der Integrase-Inhibitoren an Fahrt aufzunehmen. Damals wurde das Prinzip der Strangtransfer-Inhibition aufgedeckt.[29] Seit 2005 geht es nun auch in klinischen Studien rasant voran, spätestens nach den ersten Daten der Phase-III Studien zu Raltegravir (MK-0518) sind die Integrasehemmer die nächste neue Substanzgruppe in der HIV-Therapie. MK-0518 ist mittlerweile im Expanded Access Programm, also zur Letztbehandlung von HIV-Patienten, die sonst keine Therapieoption mehr haben, zugelassen.[30]
Experimentelle Therapien
Maturations-Inhibitoren
Maturations-Inhibitoren („Reifungshemmer“) hemmen die Knospung neuer Virionen. Wie bei den Integrasehemmern wurde 2005 erstmals in vivo eine antiretrovirale Wirkung nachgewiesen. Bevirimat (PA-457) ist ein Derivat der Betulinsäure, die als Triterpen-Carbonsäure aus Birken- oder Platanenrinde isolierbar ist und als Zytostatikum gegen Melanome eingesetzt wird. PA-457 hemmt die Knospung bzw. Reifung neuer Virionen.[31] Studien der Phase-IIa sind bereits veröffentlicht.[32] Studien der Phase-IIb verlaufen aufgrund unerwarteter Schwierigkeiten in der Dosisfindung schleppend.[33]
Tre-Rekombinase
Am 29. Juni 2007 stellten Wissenschaftler des Hamburger Heinrich-Pette-Instituts für Experimentelle Virologie und Immunologie sowie des Max-Planck-Instituts für Molekulare Zellbiologie und Genetik in Dresden im US-Wissenschaftsjournal Science den Grundstein für eine neue AIDS-Therapie vor.[34] Ihnen gelang es nach eigenen Angaben erstmals, aus menschlichen Zellen das Erbgut des AIDS-Erregers gezielt zu entfernen. Für ihr erfolgreiches Experiment entwickelten die vier Forscher ein spezielles Enzym – Tre-Rekombinase genannt –, das als molekulare Schere fungiert. Es trennt das HI-Virus aus der DNA der Zelle heraus und macht es auf diese Weise unschädlich. Joachim Hauber, einer der Wissenschaftler, erklärte der Presse gegenüber: „Wir sind das Virus in den Zellen wieder losgeworden. Das hat bislang noch niemand geschafft.“[35] Die Untersuchungen fanden bislang lediglich in Zellkulturen statt, nicht jedoch in Tierversuchen oder im Rahmen von klinischen Studien am Menschen. Ob mit Hilfe der Tre-Rekombinase eine effiziente Therapie gegen HIV-Infektionen entwickelt werden kann, kann derzeit noch nicht abgeschätzt werden.
Vorbeugung
Prävention ist die effektivste Maßnahme gegen HIV. Durch den Gebrauch von Kondomen, sterilen Nadeln bei der Einnahme von Drogen und bei Impfungen sowie Blutspenden kann man einer Infektion sehr sicher entgehen. Nach einem Ereignis mit Ansteckungsrisiko kann die Wahrscheinlichkeit einer Infektion vermindert werden, wenn eine so genannte Postexpositionsprophylaxe durchgeführt wird.
Eine HIV-Impfung existiert nicht. An der hohen Mutationsrate des HI-Virus scheiterten bisher die langjährigen Forschungen um Impfstoffe, die die Bildung von schützenden Antikörpern gegen das Oberflächenprotein gp120 fördern sollten. Als das Mittel gegen das sehr ähnliche SIV (SI-Virus, simian Immunodeficiency virus) der Affen erfolgreich getestet worden war, hatte das HI-Virus in freier Wildbahn die Struktur seines gp120 Oberflächenproteins verändert.
Epidemiologie
Die Prävalenzratio beträgt weltweit 0.0059, in Deutschland 0.0007, in Österreich 0.0011 (Stand 2006).
Allgemein
Aus epidemiologischer Sicht ist das weltweite Verteilungsmuster von HIV interessant: Während sich die meisten Viren gleichmäßig schnell ausbreiten, war dies bei HIV anders.
Der erste entdeckte AIDS-Erreger ist ein HI-Virus 1 vom Subtyp B aus der Hauptgruppe M. Dieses Virus tauchte erstmals um 1930 in Zentralafrika auf. Ein internationales Forscherteam kommt nach Gen-Analysen zahlreicher HIV-Subtypen aus aller Welt zu dem Schluss, dass dieses AIDS-Virus um das Jahr 1966 herum von Afrika nach Haiti gelangte. Die Untersuchungen belegen ferner, dass sich das Virus mit hoher Wahrscheinlichkeit zunächst innerhalb von Haiti und dann von dort über die ganze Welt ausbreitete. So erreichte es von Haiti aus 1969 die USA. Zu diesem Schluss gelangten Forscher um Michael Worobey an der Universität Arizona nach der eingehenden Analyse von Virusproben der ersten bekannten AIDS-Patienten aus Haiti.[36] In den USA habe sich das Virus zunächst sehr langsam in der heterosexuellen Bevölkerung ausgebreitet, bevor es sich dann wenig später innerhalb der Hochrisiko-Gruppe homosexueller Männer stärker verbreitete.
Während die HIV-Epidemie in den USA bereits in den 1980er Jahren begann, gab es einige Länder, die von HIV verschont zu sein schienen, dann aber mit großer Geschwindigkeit vom Virus erobert wurden. So geschah es vor allem in Osteuropa und Asien Mitte der 1990er Jahre. In anderen Ländern, zum Beispiel Kamerun, blieb die Prävalenz von HIV Jahre lang stabil, um dann sprunghaft anzusteigen. Auch eine Obergrenze in der HIV-Prävalenz scheint es nicht zu geben. So stieg die Quote der schwangeren Frauen mit HIV in städtischen Zentren in Botswana nach 1997 in vier Jahren von 38,5 auf 55,6 Prozent.
Eine nachhaltig erfolgreiche Bekämpfung von HIV/AIDS in afrikanischen Hochprävalenzländern muss die Reduktion sowohl von AIDS-bedingten Todesfällen als auch von Neuinfektionen umfassen. Daten aus einigen schwer von der HIV-Epidemie getroffenen Ländern wie Kenia, Ruanda, Uganda und Simbabwe zeigen, dass sich die Rate der Neuinfektionen durch Änderungen im Sexualverhalten verringern lässt. Als Grundlagen dieses Erfolges gelten die landesweite Einführung von Sexualkundeunterricht, die zunehmende Einführung der antiretroviralen Therapie, flächendeckende Kampagnen zur Steigerung der Akzeptanz von Kondomen, HIV-Tests, deren Ergebnisse noch am selben Tag bekannt gegeben wurden und Selbsthilfe-Kits für sexuell übertragbare Krankheiten. Diese Erfolge sind jedoch nur mit finanziellen Mitteln durchführbar, die viele der Hochendemie-Länder in Afrika nicht allein aufbringen können. Unabdingbar ist ferner ebenso ein politischer Wille, diese Seuche aktiv zu bekämpfen. Laut Daten aus Uganda konnte die Prävalenz von HIV bei schwangeren Frauen von fast 30 Prozent im Jahr 1992 auf 5,4 Prozent im Jahr 2007 gesenkt werden [3]. Das Erfolgsmodell Uganda ist nicht unumstritten: Zur Reduktion der HIV-Prävalenz haben auch eine verbesserte Datenerhebung und die dramatische Sterblichkeitsrate von Menschen mt HIV/AIDS beigetragen.
Weltweit
Jahr Mit HIV/AIDS lebende Personen Neuinfektionen Todesfälle Todesfälle aufsummiert Quelle 1980 (~ 2.000.000) 1 — — — — 1993 (12.900.000) 1 — — (2.500.000) 1 — 1999 — 4.000.000 — — — 2000 — 3.800.000 — — — 2001 34.900.000 (40.000.000) 1 3.400.000 2.500.000 20–22 Mio. — 2002 — (42.000.000) 1 3.500.000 3.100.000 ~ 21.1 Mio. — 2003 37.800.000 4.800.000 2.900.000 ~ 24.0 Mio. — 2004 39.400.000 4.900.000 3.100.000 ~ 27.1 Mio. — 2005 40.300.000 4.900.000 3.100.000 > 25 Mio. AIDS epidemic update December 2005 (UNAIDS) 2006 39.500.000 4.300.000 2.900.000 > 25 Mio. AIDS epidemic update 2006 (UNAIDS) 2007 33.200.000 2.500.000 2.100.000 > 25 Mio. AIDS epidemic update 2007 (UNAIDS) 1 Bei der Berechnung der Gesamtzahl aller Infektionen wandte UNAIDS ab 2004 eine neue Methodik an, die eine relative Korrektur der Zahlen nach unten nach sich zog. Nach alter Methodik ermittelte Zahlen sind zur Unterscheidung kursiv gesetzt, für 2001 finden sich zum Vergleich beide Werte angegeben, ein korrigierter Wert für 2002 ist nicht bekannt. Globale Verteilung 2001 2002 2003 2004 2005 Subsahara-Afrika 23,8 Millionen 24,4 Millionen 25,0 Millionen 25,4 Millionen 25,8 Millionen Süd- und Südostasien 5,9 Millionen 6,4 Millionen 6,5 Millionen 7,1 Millionen 7,4 Millionen Latein-Amerika 1,4 Millionen 1,5 Millionen 1,6 Millionen 1,7 Millionen 1,8 Millionen Osteuropa und Zentralasien 890.000 1,0 Millionen 1,3 Millionen 1,4 Millionen 1,6 Millionen Ostasien 680.000 760.000 900.000 1,1 Millionen 870.000 Nordamerika 950.000 970.000 1 Million 1 Million 1,2 Million West- und Zentraleuropa 540.000 600.000 580.000 610.000 720.000 Nordafrika und Naher Osten 340.000 430.000 480.000 540.000 510.000 Karibik 400.000 420.000 430.000 440.000 300.000 Ozeanien 24.000 28.000 32.000 35.000 74.000 Alle Zahlen von UNAIDS Im südlichen Afrika ist die Rate am höchsten. Die Rate der schwangeren HIV-Infizierten unter 20 Jahren ist in Südafrika auf 15,4 Prozent gesunken (1998: 21 Prozent); dies bedeutet, dass Aufklärungsprogramme langsam Erfolge zeigen. Jedoch sind die AIDS-Raten bei älteren Frauen immer noch sehr hoch. 32 Prozent der Frauen zwischen 24 und 29 Jahren sind derzeitig mit der Krankheit infiziert. Insgesamt sind 20 Prozent der Bevölkerung Südafrikas mit HIV infiziert. Das Land mit der weltweit höchsten AIDS-Rate ist das benachbarte Swasiland, wo 2005 42 Prozent der Bevölkerung infiziert waren.
Deutschland
In den 90er Jahren kam es jährlich zu etwa 2000 HIV-Neuinfektionen. Von 2000 bis 2006 stieg die Zahl der Neuinfektionen jährlich kontinuierlich an, besonders bei Männern, die Sex mit Männern haben. Seit 2007 scheinen sich die jährlichen Neuinfektionen bei einem Wert von etwa 3000 zu stabilisieren. Ende 2008 lebten etwa 63.500 HIV-infizierte Menschen in der Bundesrepublik, davon 51.800 Männer und 11.700 Frauen sowie ca. 200 Kinder. 10.500 von ihnen sind an AIDS erkrankt.
Von den etwa 3000 Neuinfizierten waren etwa 88 Prozent Männer; geschätzte 72 Prozent von ihnen sind Männer, die Sex mit Männern haben, 20 Prozent waren Übertragungen durch heterosexuellen Sex, 8 Prozent Infektionen durch infizierte Spritzen bei Drogenmissbrauch und weniger als ein Prozent Übertragungen von der Mutter auf das Kind während der Schwangerschaft und der Geburt.
Die Zahl der neu an AIDS Erkrankten lag Ende 2008 bei 1100. Von Anfang der 1980er Jahre bis 2008 haben sich in der Bundesrepublik Deutschland etwa 81.500 bis 86.000 Menschen mit HIV infiziert, etwa 35.200 Menschen sind an AIDS erkrankt und etwa 27.500 sind an den Folgen der HIV-Infektion gestorben.
Die vom Berliner Robert Koch-Institut (RKI) ermittelten Daten zur Verbreitung von HIV und AIDS sind nur begrenzt mit früher publizierten Schätzungen vergleichbar, da zusätzliche Daten und Informationen sowie die Anpassung der Erhebungsmethodik die Berechnungen von Jahr zu Jahr verändern.
Es gibt Befürchtungen, dass die Infizierungsrate ansteigt, da zum einen die Aufklärungswelle der 1990er Jahre verebbt sei und sich zum anderen gerade bei Jugendlichen zwischen 13 und 16 Jahren eine erstaunliche Unkenntnis in Bezug auf die latente Ansteckungsgefahr beim ungeschützten Sexualakt zeigt. So behauptet erschreckenderweise jeder fünfte Jugendliche, dass man einem HIV-Positiven „die Krankheit ansehen könne“. Hinzu kommt eine Verharmlosung und gelegentliche Faszination von Gefahren, die bei manchen zu bewusst risikoreicherem Verhalten (Barebacking) führt.
Grund zur Besorgnis gibt weiterhin der kontinuierliche Anstieg von anderen sexuell übertragbaren Krankheiten. Nicht nur, dass sich damit das Risiko einer Ansteckung erhöht, es zeigt auch, dass die Akzeptanz von Kondomen rückläufig zu sein scheint. Diese Befürchtungen werden bestärkt durch die Tatsache, dass sich nach Angaben des Robert Koch-Institutes in den ersten acht Monaten des Jahres 2005 zwanzig Prozent mehr Menschen mit HIV angesteckt haben als im vergleichbaren Zeitraum des Vorjahres.
Mehr als 80 Prozent sind Männer und nahezu 70 Prozent der Gesamtzahl sind Männer, die gleichgeschlechtliche Kontakte hatten. Das Infektionsrisiko für diese Männer ist damit doppelt so groß wie vor fünf Jahren − und so hoch wie seit dreizehn Jahren nicht mehr.
In Deutschland zählt AIDS mit etwa 650 Toten pro Jahr zu den unbedeutendsten Todesursachen. Nach der Statistik des Bundesamts in Wiesbaden erlagen von 2002 bis 2006 jährlich zwischen 518 und 504 Menschen in Deutschland den Folgen der Immunschwäche. 83 Prozent der Opfer waren im vergangenen Jahr Männer, 17 Prozent waren Frauen. Im Vergleich zu 1996 sank die Zahl der Todesfälle 2006 allerdings um 68 Prozent, was auf einen Erfolg der Langzeitmedikationen hinweist. Das durchschnittliche Sterbealter stieg in diesem Zeitraum von 41 auf 48 Jahre und acht Monate.[37]
Österreich
Anfang 2008 leben etwa 12.000 bis 15.000 HIV-Infizierte in Österreich, etwa die Hälfte davon in Wien. Die Zahl der Neuinfizierungen beträgt seit 2003 etwa 450 pro Jahr (2007: 515). Die niedrigste Rate war 1997 mit 297, die höchste 1993 mit 561 Neuinfektionen. Der Anstieg der Neuinfektionen kann durch das Ende der Aufklärungswelle der 1990er Jahre erklärt werden, sie bleibt mittlerweile aber relativ konstant. Zwischen 1983 und dem 5. Mai 2008 sind in Österreich 2608 Menschen an AIDS erkrankt und 1468 gestorben. Von 2003, mit 50 neuen Erkrankungen, stiegen sie im Jahr 2004 auf 65 an.
2006 erfolgten fast 42 Prozent der Neuinfektionen über heterosexuelle Kontakte (1998 waren es 27 Prozent), 28,6 Prozent über homosexuelle Kontakte und 20,5 Prozent über intravernösen Drogenkonsum.
Pro Jahr werden in Österreich rund 1 Mio. HIV-Antikörper-Tests durchgeführt (500.000 davon durch Spenden finanziert). Ein Problem ist, dass die Tests oft in der falschen Zielgruppe durchgeführt werden (PensionistInnen). Einerseits wird sehr viel getestet, andererseits wird bei vielen der Betroffenen die HIV-Infektion erst im Zuge der tatsächlichen Erkrankung bekannt.
Schweiz
In der Schweiz wurden im Jahr 2005 702 positive HIV-Tests gemeldet. Seit 2002 hat die Anzahl der Neuansteckungen von 791 leicht abgenommen. Besonders stark betroffen sind die Kantone Zürich, Waadt und Genf.
Bei den Männern sind 2005 die meisten Ansteckungen mit 49,1 Prozent nach homosexuellem Geschlechtsverkehr zu verzeichnen. Seit 2003 zeigt sich in dieser Gruppe eine Zunahme von 13,9 Prozent und bewegt sich damit über dem Höchststand von 1994. Die Anzahl der Ansteckungen nach heterosexuellem Kontakt folgt mit 38,1 Prozent. Diese Gruppe stieg nach 2002 wieder an, sank aber 2005 wieder und scheint sich auf gleichbleibend hohem Niveau zu halten. Die Ansteckungen nach Drogenkonsum sinken seit 2003 weiter auf 9,7 Prozent.
Bei den Frauen ist das Ansteckungsrisiko bei heterosexuellem Kontakt mit 80,6 Prozent am größten und stieg seit 2002 um 10,7 Prozent. Die Infizierungen nach Drogenkonsum bleiben mit 11,1 Prozent auf konstantem Niveau.
Bei Ansteckungen nach homosexuellen Kontakten sind hauptsächlich Bürger aus der Schweiz mit etwa 72 Prozent betroffen, gefolgt mit 15 Prozent von Personen aus der EU. Das Verhältnis bewegt sich bei Ansteckungen nach Drogenkonsum etwa im gleichen Verhältnis (63 Prozent aus der Schweiz und 20,4 Prozent EU). Bei den heterosexuellen Beziehungen zeigt sich jedoch ein stark größerer Anteil an ausländischen Personen. Besonders stark betroffen sind Personen aus der Subsahara mit 41 Prozent.
AIDS in Afrika
Siehe Hauptartikel: HIV/AIDS in Afrika
Ausbreitung
Die AIDS-Pandemie hat ihre schlimmsten Ausmaße südlich der Sahara. Hier leben 26 Millionen Menschen mit einer HIV-Infektion. In einigen Ländern hat sich durch die Immunschwächeerkrankung die Lebenserwartung um mehr als zehn Jahre gesenkt. Warum sich die Erkrankung hier so viel schneller verbreitet, ist nicht ganz geklärt.
Es scheint einige Faktoren zu geben, die die Ausbreitung des HI-Virus begünstigen: während in Europa und Nordamerika schon kurz nach der Entdeckung des HI-Virus die Massenmedien große Teile der Bevölkerung mit Informationskampagnen über die tödlichen Gefahren einer HIV-Infektion und Prävention informierten, blieb AIDS in vielen Teilen Afrikas ein Tabuthema. So hatte das HI-Virus fast zwanzig Jahre mehr Zeit, sich ungehindert auszubreiten.
AIDS in den Nachfolgestaaten der Sowjetunion
Die ersten HIV-Infektionen in der Sowjetunion wurden erst Ende der 1980er Jahre registriert. Eine epidemische Ausbreitung begann Anfang der 1990er Jahre, und zwar zunächst fast ausschließlich unter Benutzern von Injektionsdrogen. Der Hauptansteckungsweg war der gemeinsame Gebrauch von Spritzen. Mit der sich nach dem Zusammenbruch der Sowjetunion ausbreitenden Drogensucht stieg auch die Zahl der Infektionen mit HIV.
Bis heute, wo je nach Region bereits bis zu 60 Prozent der Neuinfektionen auf sexuellem Weg stattfinden, prägt ihre Entstehung im Drogenmillieu das Erscheinungsbild der HIV-Epidemie in den Nachfolgestaaten der Sowjetunion.
Am stärksten betroffen und im Hinblick auf die Charakteristika der Epidemie beispielhaft für viele Regionen der ehemaligen Sowjetunion ist die Ukraine.
Siehe Hauptartikel: HIV/AIDS in der Ukraine
Entstehungstheorien
HIV ist eng mit Viren verwandt, die AIDS-ähnliche Symptome in Primaten auslösen, und es ist eine derzeit allgemein akzeptierte Annahme, dass einer dieser Virustypen Anfang des 20. Jahrhunderts auf den Menschen übertragen wurde, obwohl es Hinweise darauf gibt, dass dies in isolierten Fällen bereits früher geschah.
Genaue Angaben über Zeit, Ort, Wirtstier, Art und Anzahl der Übertragungen sind nicht bekannt.
Ein Virus, das fast identisch mit dem menschlichen HI-Virus ist und SIV genannt wird, wurde in Schimpansen gefunden. Nach jüngsten Untersuchungen von Virologen der Universität Birmingham/Alabama löst HIV-1, das von dem im Schimpansen gefundenen SI-Virus abstammt, vermutlich die Immunschwächekrankheit aus. Durch eine genetische Analyse konnten die Wissenschaftler zeigen, dass das SI-Virus eine Kombination aus zwei Virusstämmen ist, die in bestimmten Meerkatzen vorkommen. Da Meerkatzen von Schimpansen gejagt und gefressen werden, müssen sich die Schimpansen mit den zwei Virusstämmen infiziert haben, aus denen sich dann in ihrem Körper das SI-Virus gebildet hat. Die Übertragung dieses SI-Virus auf den Menschen erfolgte nach Ansicht der Forscher wohl bereits vor den 30er Jahren des 20. Jahrhunderts.
Weitere wissenschaftliche Untersuchungen ergaben, dass das HI-Virus zuerst in Westafrika auftrat, aber es ist nicht mit letzter Sicherheit geklärt, ob es nicht mehrere Virusherde gab. Neue sogenannte phylogenetische Untersuchungen, das heißt, Verwandtschaftsvergleiche zwischen den unterschiedlichen Subtypen von HIV und zwischen HIV und SIV, lassen vermuten, dass mehrere unabhängige Übertragungen vom Schimpansen auf den Menschen in Kamerun und/oder dessen Nachbarländern stattfanden.
Die älteste Blutprobe, die nachgewiesenermaßen HIV-Antikörper enthält, wurde 1959 im Kongo von einem erwachsenen Menschen genommen. Weitere Proben stammen von einer im Kongo gestorbenen Frau (1960, Lymphknotengewebe), einem US-Amerikaner (1969) und einem norwegischen Matrosen (1976).
Geschichte
Die früheste dokumentierte Infektion mit HIV-1 wurde anhand 1959 entnommener Blutproben eines Mannes aus Kinshasa (Demokratische Republik Kongo) nachgewiesen. Der Vergleich mit späteren Proben von einer 1976 an AIDS verstorbenen Familie eines norwegischen Seemanns deutet auf Divergenz von einem gemeinsamen Vorfahren aus den 1940er bis frühen 1950er Jahren hin. Es wird angenommen, dass HIV-1 einige Jahre zuvor auf den Menschen übersprang. Der genetische Unterschied zwischen HIV-1 und HIV-2 deutet jedoch auch darauf hin, dass diese Subtypen bereits weitaus früher divergierten.[38] Die Genetikerin Bette Korber vom Los Alamos National Laboratory datierte im Jahre 2000 anhand der Probe von 1959 die erste Übertragung auf etwa das Jahr 1931. Der Evolutionsbiologe Michael Worobey von der University of Arizona datierte im Jahre 2008 mit Hilfe einer zusätzlichen Probe aus dem Jahre 1960 die erste Übertragung auf die Zeit zwischen 1884 und 1924. Er vermutet dadurch, dass die Gründung der Kolonialstädte dem Virus half Fuß zu fassen.[39]
1981 beschrieb Michael Gottlieb in der am 5. Juni erschienenen Ausgabe des Morbidity and Mortality Weekly Report, einem wöchentlichen Bulletin der US-Gesundheitsbehörde CDC, eine Häufung einer seltenen Form der Lungenentzündung. Diese durch den Pilz Pneumocystis jirovecii ausgelöste Form befällt nahezu ausschließlich Patienten mit schwerwiegender Immunschwäche, wurde von Gottlieb jedoch bei fünf zuvor gesunden, homosexuellen Männern in Los Angeles festgestellt.[40] Ähnliche Berichte aus anderen US-amerikanischen Städten folgten. Zudem wurden verstärkt auch andere opportunistische Erkrankungen – etwa Kaposi-Sarkome – festgestellt, die überwiegend Patienten mit geschwächtem Immunsystem befallen.[41]
Schon früh wurde eine erworbene Immunschwächeerkrankung als wahrscheinliche Ursache in Betracht gezogen. Im Juni 1982 wurde eine, anfänglich als Gay Related Immune Deficiency (GRID) oder Gay People's Immuno Defiency Syndrome (GIDS) bezeichnete, sexuell übertragene Krankheit vermutet.[42] Weitere epidemiologische Untersuchungen in den USA zeigten jedoch, dass die Krankheit auch unter Hämophilen[43], Empfängern von Blut (z. B. durch Bluttransfusionen) und heterosexuellen Drogenabhängigen auftrat, was neben sexueller auch eine parenterale Übertragung nahelegt. Aus diesem Grund wurde die Krankheit ab August 1982 unter ihrem neuen Namen „AIDS“[1] bzw. im französischen Sprachraum „Syndrome d’Immuno-Déficience Acquise“ (SIDA) referenziert.
In Deutschland wurde die Krankheit erstmalig 1982 bei einem Patienten aus Frankfurt am Main diagnostiziert.
1983 isolierte eine französische Forschergruppe um Luc Montagnier ein zuvor unbekanntes Retrovirus, das Lymphadenopathie-Virus (LAV), das sie als Ursache für AIDS vermuteten.[44] Eine kausale Beziehung zwischen dem Virus und der Immunschwächeerkrankung wurde kurze Zeit später behauptet. Im selben Jahr wurde in Berlin die AIDS-Hilfe gegründet. 1984 wurde im US-Krebsinstitut ein bei AIDS-Patienten entdecktes Virus Human T-cell Lymphotropic Virus-III (HTLV-III) genannt.[45] Im März 1985 stellte sich aufgrund weiterer Berichte zu LAV und HTLV-III heraus, dass diese identisch sind. 1985 erhielt Robert Gallo das US-Patent für den ersten ELISA-Antikörper-Test, der von der US-Zulassungsbehörde zugelassen wurde. Im gleichen Jahr fand in Atlanta (USA) die erste Welt-AIDS-Konferenz statt.
Im Jahr 1986 wurde für das Virus der Name Humanes Immunschwächevirus (HIV) etabliert. Ein Jahr später, 1987, wurde mit AZT (Retrovir) das erste Therapeutikum zugelassen. Im Jahr 1988 wurde von der WHO der 1. Dezember zum Welt-AIDS-Tag erklärt. 1989 wurde bei HIV-Patienten die Pentamidin-Inhalation zur Prophylaxe der Pneumocystis-Pneumonie eingeführt.
Im Jahr 1990 wurde aus Protest gegen die Diskriminierung von HIV-Infizierten auf der AIDS-Konferenz in San Francisco das Red Ribbon, ein rotes Armband, etabliert. Ein Jahr später wurde die Rote Schleife international zum Symbol für den Kampf gegen AIDS. 1992 wurde aufgrund der US-Einreisebestimmungen der Welt-AIDS-Kongress von Boston nach Amsterdam verlegt. Außerdem wurde im Gedenken an Freddie Mercury von den verbleibenden Queen-Mitgliedern die Stiftung Mercury Phoenix Trust gegründet.
1994 wurde die HIV-PCR als wichtiger diagnostischer Test für die Therapiekontrolle des Infektionsverlaufes etabliert. Im folgenden Jahr, 1995, kam der erste Protease-Hemmer, Saquinavir, in den USA auf den Markt. Im folgenden Jahr wurde Nevirapin als erster nicht-nukleosidischer Reverse-Transkriptase-Hemmer zugelassen. Durch die intensive Kombinationstherapie nahm die Sterberate in den USA 1997 drastisch ab. 2003 wurde mit Enfuvirtid (Fuzeon) der erste Fusionshemmer in den USA zugelassen. 2004 wurde von der WHO die Initiative 3 by 5 gestartet: Drei Millionen Infizierte sollten im Jahr 2005 mit Medikamenten versorgt werden.
Zu Anfang galt die Erkrankung in der öffentlichen Wahrnehmung als Problem von „Randgruppen“ wie Homosexuellen und Drogenabhängigen. Dies änderte sich jedoch auf dramatische Weise durch das Aufkommen von HIV-Tests. Denn auch Menschen ohne klinische Symptome hatten Antikörper, was auf eine Inkubationszeit von mehreren Jahren hindeutete, in der das Virus möglicherweise auch weitergegeben wurde. 1984 ergaben Untersuchungen, dass AIDS in Kinshasa bei Männern und Frauen gleich häufig auftrat, unabhängig von Drogenkonsum und Bluttransfusionen.
In den USA wurde 1985 berichtet, dass bei untersuchten Hämophiliekranken („Blutern“), die sich durch Blutkonserven infiziert hatten, die Ansteckungsrate der Ehefrauen bei 70 Prozent lag. Die Erkenntnis, dass die Ansteckungsgefahr bei heterosexuellem Geschlechtsverkehr deutlich höher zu sein schien als zunächst angenommen, führte zu einem großen öffentlichen Interesse. Die Kombination aus den nun bekannten Ansteckungswegen und langer Inkubationszeit ließen epidemiologische Hochrechnungen ein pessimistisches Bild zeichnen.
Die jährliche Verdopplung von Neuerkrankungen hielt in Deutschland nur von 1984 bis 1987 an, danach verlief der Anstieg der Zahl von Erkrankten weniger steil, bis sich die Zahlen im Jahre 1993 auf ca. 2000 einpendelte. Dadurch änderte sich auch schnell wieder das öffentliche Interesse an AIDS. 2003 steckten sich weltweit ungefähr 4,8 Millionen Menschen neu mit dem Virus an, im selben Jahr starben etwa 2,9 Millionen Menschen daran.
Abweichende Sichtweisen
Siehe Hauptartikel: AIDS-Leugnung
Trotz gesicherter wissenschaftlicher Erkenntnisse bestreitet eine sehr geringe Zahl von Wissenschaftlern entweder die Existenz von HIV oder den Zusammenhang von HIV und AIDS. Dazu gehören insbesondere der Retrovirologe Peter Duesberg[46] und der Chemiker Kary Mullis. Ihre Thesen beeinflussten den ehemaligen Präsidenten Südafrikas, Thabo Mbeki, der Duesberg 2001 zum Mitglied der südafrikanischen AIDS-Beratungskommission ernannte. In Südafrika liegt die Verbreitungsrate von HIV/AIDS bei über 20 Prozent, etwa 370.000 Menschen starben 2003 allein in Südafrika an AIDS.[47] Mbeki bestreitet selber vehement den Zusammenhang zwischen HIV und AIDS.[48] Kary Mullis ist für die Entdeckung des PCR-Verfahrens bekannt, mit dem unter anderem HI-Viren im Körper von Betroffenen nachgewiesen werden. Nachdem er sich aber als mögliches Entführungsopfer von Außerirdischen bezeichnet und seine Vorliebe für Astrologie bekundet hat, wird er von den meisten Wissenschaftlern nicht mehr ernst genommen.[49]
Diese Positionen werden von der überwältigenden Mehrheit der Mediziner als gefährliche Verschwörungstheorien eingestuft und scharf kritisiert. In Südafrika seien die AIDS-Leugner für den Tod hunderttausender Menschen verantwortlich.[50][51][52][53][54][55]
Sozialethische Beurteilung
Das Krankheitssyndrom AIDS hat sich weltweit zu einer ernsten Herausforderung für direkt Betroffene, für die medizinische Wissenschaft, aber auch für all jene, die derartige Patienten zu betreuen haben oder mit ihnen zusammenleben müssen, entwickelt.
Fernab von jeder Stigmatisierung[56] AIDS-kranker Patienten gilt es, Mittel und Wege zu finden, ihnen besser wirksam zu helfen: Sei es durch immer noch nicht ausreichend verfügbare therapeutische Maßnahmen, sei es im Sinn der symptomatischen Therapie und Palliativmedizin. Geboten ist zudem umfassende und wirksame Prävention.
Die Suche nach einer ethisch vertretbaren AIDS-Bekämpfungsstrategie führt zu teils gegenteiligen Ergebnissen: Die einen betonen die unbedingte Notwendigkeit eines ausschließlich oder doch primär „technischen“ Schutzes gegen die Ausbreitung der Krankheit. Andere sehen diese Antwort als nicht ausreichend an bzw. lehnen diese aus Gründen einer religiösen Ethik ab. Sie betonen den Wert der dauerhaften ehelichen Treue neu bzw. fordern im konkreten Fall auch zeitweise oder völlige Enthaltsamkeit ein. Die Propagierung von Kondomen als Schutz gegen AIDS sei vom religiös-christlichen Standpunkt aus bedenklich. Man argumentiert, auf diese Weise werde ein mit Promiskuität und gewissen sexuellen Praktiken assoziierter verantwortungsloser Lebensstil gefördert, der die eigene Person sowie andere Menschen einer todbringenden Gefahr aussetze.
Verweise
Einzelnachweise
- ↑ a b Marx, J. L.: New disease baffles medical community. In: Science. 217, Nr. 4560, 1982, S. 618–621. PMID 7089584
- ↑ http://www.unaids.org/en/KnowledgeCentre/HIVData/Epidemiology/epidemiologySlidesAuto.asp
- ↑ a b UNAIDS: 2008 Report on the global AIDS epidemic. ([1] ; Stand: 2008-12-22).
- ↑ Keou FX, Bélec L, Esunge PM, Cancre N, Gresenguet G.: World Health Organization clinical case definition for AIDS in Africa: an analysis of evaluations. PMID 1335410.
- ↑ Alison D Grant, Kevin M De Cock HIV infection and AIDS in the developing world http://www.bmj.com/cgi/content/full/322/7300/1475.
- ↑ Greenberg AE, Coulibaly IM, Kadio A, Coulibaly D, Kassim S, Sassan-Morokro M, Maurice C, Whitaker JP, Wiktor SZ. Impact of the 1994 expanded World Health Organization AIDS case definition on AIDS surveillance in university hospitals and tuberculosis centers in Côte d'Ivoire. PMID 9412706
- ↑ E.M. Lackritz et al.: „Estimated Risk of Transmission of the Human Immunodeficiency Virus by Screened Blood in the United States“. In: New England Journal of Medicine. 333, Nr. 26, 1995, S. 1721-1725. PMID 7491134
- ↑ a b A. Plettenberg et al.: „HIV-PEP State of the art“. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. 43, Nr. 13, 2000, S. 18–25. DOI
- ↑ HIV and Its Transmission, CDC.
- ↑ Postexpositionelle Prophylaxe der HIV-Infektion.
- ↑ PETERMAN TA, STONEBURNER RL, ALLEN JR, JAFFE HW, CURRAN, JW. Risk of human immunodeficiency virus transmission from heterosexual adults with transfusion-associated infections. JAMA 1988; 259: 55–58 http://archderm.ama-assn.org/cgi/content/abstract/135/11/1393
- ↑ De Cock KM et al. Prevention of mother-to-child-transmission in resource-poor countries. Jama 2000; 283: 1175-82
- ↑ http://www.aerztezeitung.de/medizin/krankheiten/infektionskrankheiten/aids/?sid=519086 Ärzte Zeitung Extra, 1. Dezember 2008
- ↑ Rapid HIV Testing, AboutCom.
- ↑ a b Hecht, F. M. et al.: Use of laboratory tests and clinical symptoms for identification of primary HIV infection.. In: AIDS. 16, Nr. 8, 2002, S. 1119-1129. PMID 12004270
- ↑ http://www.iht.com/articles/2005/05/04/healthscience/snlive.php?page=2.
- ↑ http://www.daignet.de/site-content/hiv-therapie/leitlinien-1
- ↑ http://www.rki.de/cln_091/nn_196034/DE/Content/InfAZ/H/HIVAIDS/Therapie/Leitlinien/leitlinien__node.html?__nnn=true
- ↑ http://www.aidsinfo.nih.gov/Guidelines/)
- ↑ http://www.eacs.eu/guide/index.htm
- ↑ http://www.who.int/hiv/pub/guidelines/en/
- ↑ a b Brinkman, K. et al: Mitochondrial toxicity induced by nucleoside-analogue reverse-transcriptase inhibitors is a key factor in the pathogenesis of antiretroviral-therapy-related lipodystrophy.. In: Lancet. 354, Nr. 9184, 1999, S. 1112-1115. PMID 10509516
- ↑ Torre, D. et al: Nevirapine or efavirenz combined with two nucleoside reverse transcriptase inhibitors compared to HAART: a meta-analysis of randomized clinical trials.. In: HIV Clinical Trials. 2, Nr. 2, 2001, S. 113-121. PMID 11590519
- ↑ Fumaz, C. R. et al.: Quality of life, emotional status, and adherence of HIV-1-infected patients treated with efavirenz versus protease inhibitor-containing regimens.. In: Journal of acquired immune deficiency syndromes. 29, Nr. 3, 2002, S. 244-253. PMID 11873073
- ↑ Dauer, B.: Protease inhibitors: the current status.. In: Journal of HIV Therapy. 10, Nr. 4, 2005, S. 72-74. PMID 16519246
- ↑ Oldfield, V. Plosker, G. L.: Lopinavir/Ritonavir: a review of its use in the management of HIV infection.. In: Drugs. 66, Nr. 9, 2006, S. 1275-1299. PMID 16827606
- ↑ http://www.hiv-wechselwirkungen.de/index_5045_de.html
- ↑ J. P. Lalezari et al.: „Enfuvirtide, an HIV-1 Fusion Inhibitor, for Drug-Resistant HIV Infection in North and South America“. In: New England Journal of Medicine. 348, Nr. 22, 2003, S. 2175–2185. PMID 12637625
- ↑ Hazuda DJ, Felock P, Witmer M, et al. Inhibitors of strand transfer that prevent integration and inhibit HIV-1 replication in cells. Science 2000, 287:646-50. http://amedeo.com/lit.php?id=10649997
- ↑ Cooper D, Gatell J, Rockstroh J, et al. Results of BENCHMRK-1, a phase III study evaluating the efficacy and safety of MK-0518, a novel HIV-1 integrase inhibitor, in patients with triple-class resistant virus. Abstract 105aLB, 14th CROI 2007, Los Angeles. Abstract: http://www.retroconference.org/2007/Abstracts/30687.htm
- ↑ Li F, Goila-Gaur R, Salzwedel K et al. PA-457: a potent HIV inhibitor that disrupts core condensation by targeting a late step in Gag processing. Proc Natl Acad Sci U S A 2003, 100:13555-60. http://amedeo.com/lit.php?id=14573704
- ↑ Beatty G, Jacobson J, Lalezari J, et al. Safety and Antiviral Activity of PA-457, the First-In-Class Maturation Inhibitor, in a 10-Day Monotherapy Study in HIV-1 Infected Patients. Abstract Abstract H-416D, 45th ICAAC 2005, Washington.
- ↑ http://www.aidsmap.com/en/news/8E7E3BF6-72FA-4C92-B8F5-A83E1EDC45B7.asp Bericht über Phase-IIb bei Berivimat
- ↑ [2] Indrani Sarkar, Ilona Hauber, Joachim Hauber, Frank Buchholz; HIV-1 Proviral DNA Excision Using an Evolved Recombinase; Science, 316, Nr. 5833, 2007, pp. 1912–1915
- ↑ Berliner Morgenpost – „Forscher schneiden Aids-Virus aus der Zelle“
- ↑ spiegel.de: GENANALYSE: Aids blieb in USA ein Jahrzehnt lang unerkannt
- ↑ [3] Robert Koch Institut: Epidemiologisches Bulletin, 23. November 2007/No. 47]
- ↑ T. Zhu, B. T. Korber, A. J. Nahmias, E. Hooper, P. M. Sharp, D. D. Ho: „An African HIV-1 sequence from 1959 and implications for the origin of the epidemic“. In: Nature. 391, Nr. 1998-02-05, 1998, S. 594–597. PMID 9468138
- ↑ New Study Traces Origins of HIV to Turn of the Century, The Advocate, 2. Oktober 2008
- ↑ „Epidemiologic Notes and Reports: Pneumocystis Pneumonia --- Los Angeles.“, Morbidity and Mortality Weekly Report, 5. Juni 1981 / 30(21);1-3
- ↑ „Epidemiologic Notes and Reports Update on Kaposi's Sarcoma and Opportunistic Infections in Previously Healthy Persons -- United States“, Morbidity and Mortality Weekly Report, 11. Juni 1982 / 31(22);294,300-1
- ↑ „A Cluster of Kaposi's Sarcoma and Pneumocystis carinii Pneumonia among Homosexual Male Residents of Los Angeles and range Counties, California“, Morbidity and Mortality Weekly Report, 18. Juni 1982 / 31(23);305-7
- ↑ „Epidemiologic Notes and Reports Pneumocystis carinii Pneumonia among Persons with Hemophilia A“, Morbidity and Mortality Weekly Report, 16. Juli 1982 / 31(27);365-7
- ↑ F. Barre-Sinoussi et al.: „Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)“. In: Science. 220, Nr. 4599, 1983, S. 868–871. PMID 6189183
- ↑ Popovic et al.: „Detection, isolation, and continuous production of cytopathic retroviruses (HTLV-III) from patients with AIDS and pre-AIDS“. In: Science. 224, Nr. 4648, 1984, S. 497-500. PMID 6200935
- ↑ Jon Cohen: The Duesberg Phenomenon. Science, 266:5191, 1994, S. 1642-1644, PMID 7992043
- ↑ CIA World Factbook: South Africa
- ↑ FAZ: Der Aidskritiker von Toronto, 19. August 2006.
- ↑ Nathan Geffen et al.: Errors in Celia Farber’s March 2006 article in Harper’s Magazine, 25. März 2006, S. 28.
- ↑ Mortal Combat: AIDS Denialism and the Struggle for Antiretrovirals in South Africa
- ↑ Alexander von Paleske: Das Ende einer tödlichen HIV-Behandlungs-Irrfahrt, 10. November 2006
- ↑ Watson J.: Scientists, activists sue South Africa's AIDS ‚denialists‘. In: Nature Medicine 12(1):6 Jänner 2006, PMID 16397537
- ↑ Discredited doctor's 'cure' for Aids ignites life-and-death struggle in South Africa, by Sarah Boseley. The Guardian 14. Mai 2005. Zugegriffen am 27. November 2007.
- ↑ The Durban Declaration. In: Nature. 406, Nr. 6791, 2000, S. 15-6. PMID 10894520 — full text available here.
- ↑ Smith TC, Novella SP: HIV Denial in the Internet Era. In: PLoS Med.. 4, Nr. 8, 2007, S. e256. doi:10.1371/journal.pmed.0040256. PMID 17713982
- ↑ Scott Burris, Edwin Cameron, Michaela Clayton: The Criminalization of HIV: Time for an Unambiguous Rejection of the Use of Criminal Law to Regulate the Sexual Behavior of Those with and at Risk of HIV; Kürzer in: S. Burris, E. Cameron: The Case Against Criminalization of HIV Transmission., JAMA, Bd. 300, Heft 6, 6. August 2008, S. 578-581
Literatur
- C. Hoffmann, J. Rockstroh, B. Kamps (Hrsg.): HIV.NET 2007. 15. Auflage. Steinhäuser Verlag, 2007, ISBN 978-3924774561 Text online frei einsehbar, zuletzt eingesehen am 7. Mai 2008
- UNAIDS: 2004 Report on the Global HIV/AIDS Epidemic: 4th Global Report, Genf, 2004, ISBN 92-9173-355-5
- Hansjoerg Dilger: Leben mit Aids. Krankheit, Tod und soziale Beziehungen in Afrika. Eine Ethnographie. Campus, Frankfurt am Main 2005, ISBN 3-593-37716-0
- Stratton, Allan: Worüber keiner spricht, Deutscher Taschenbuch Verlag, 2005, ISBN 3-423-78204-8
- Stephan Dressler: HIV/AIDS Taschenlexikon, S. Dressler, Berlin 2008, 161 S., Text online frei einsehbar, zuletzt eingesehen am 10. September 2008
- Ilse Zündorf: Entdeckung und Ursprung des HI-Virus. Pharmazie in unserer Zeit 30(3), S. 190–192 (2001), ISSN 0048-3664
- Ilse Zündorf, Theo Dingermann: Struktur des HI-Virus. Pharmazie in unserer Zeit 30(3), S. 202–207 (2001), ISSN 0048-3664
- H. Leisch: Die AIDS-Pandemie - regionale Auswirkungen einer globalen Seuche. Geographische Rundschau 53(2), S. 26–31 (2001), ISSN 0016-7460
Fernsehdokumentationen
- Sindis letzte Chance: Billige AIDS-Medikamente für Südafrika, WDR 2001
- Tödlicher Ausverkauf: Wie AIDS nach Asien kam, WDR 2004
- Teboho Edkins: Ask me, I'm positive, 2003, Dokumentation im Rahmen des Projekts steps for the future
- Karsten Hein: Am Rande. Sechs Kapitel über AIDS in der Ukraine. (2006)
Siehe auch
Weblinks
- Deutsche AIDS-Hilfe (mit Kontaktadressen)
- AIDS-Hilfe Schweiz (viele Broschüren downloadbar)
- www.aidsonline.de – Online-Beratung
- Das HIV-NET – unter anderem eine 800-Seiten-Publikation zu AIDS und HIV zum Herunterladen
- AIDS-Informationsseite der Vereinten Nationen (englisch)
- DAGNÄ e.V. – Informationen, aktuelle Entwicklungen und Liste niedergelassener HIV-Schwerpunktpraxen
- Deutsche AIDS-Stiftung
- Österreichische AIDS-Hilfe
- Lage in Deutschland
Dokumente
- Abschlussbericht der südafrikanischen AIDS-Expertenkommission 2001 (Mitglieder waren Verfechter und Kritiker der viralen AIDS-Erklärung, so unter anderem Luc Montagnier und Peter Duesberg) (PDF-Datei, englisch)
- Stellungnahme des RKI zu den Thesen der Perth Group, einer Untergruppe der „Group for the Scientific Reappraisal of the HIV-Aids Hypothesis“ (Gruppe für die wissenschaftliche Überprüfung der HIV-AIDS-Hypothese) (PDF-Datei)
Videos
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
SIDA — Saltar a navegación, búsqueda Síndrome de inmunodeficiencia adquirida (SIDA) Clasificación y recursos externos Aviso médico … Wikipedia Español
SIDA — Décrit pour la première fois aux États Unis en 1981, le sida, syndrome d’immunodéficience humaine (autrement dit S.I.D.A., ou A.I.D.S. pour les Anglo Saxons) sévit de façon préoccupante dans le monde entier. Cette pandémie est due au virus de… … Encyclopédie Universelle
SIDA — inmun. Siglas de Síndrome de Inmunodeficiencia Adquirida. Enfermedad infecciosa causada por el retrovirus VIH, virus RNA con una transcriptasa inversa capaz de replicar su RNA a partir del DNA de la célula infectada. El contagio de la enfermedad… … Diccionario médico
Sida — may refer to:* Sida (genus), a genus of flowering plants * SIDA, Security Identification Display Area, US FAA * Amphoe Sida, a district in Thailand * Swedish International Development Cooperation Agency, a Swedish governmental agency * Acquired… … Wikipedia
Sida — ist: eine Pflanzengattung der Malvengewächse, siehe Sida (Gattung) eine Pflanzenart, siehe Sandmalve eine schwedische Behörde für internationale Entwicklungszusammenarbeit, siehe Sida (Schweden) die französische Abkürzung für Aids (sida =… … Deutsch Wikipedia
sida — sída s. f. Trimis de siveco, 10.08.2004. Sursa: Dicţionar ortografic SÍDA f. Boală transmisibilă pe cale sexuală şi sangvină, caracterizată prin distrugerea apărării imunitare a organismului. [G. D. sidei] /<fr. sidda Trimis de siveco, 31.10 … Dicționar Român
Sida — SIDA, æ, Gr. Σίδα, ας, (⇒ Tab. XVIII.) des Danaus Tochter, von welcher die Stadt Sida, in Lakonien, den Namen bekommen haben soll. Pausan. Lacon. c. 22. p. 206 … Gründliches mythologisches Lexikon
sida — s. f. [Portugal] [Medicina] Doença grave, transmitida por via sexual ou sanguínea e caracterizada pela destruição ou pelo desaparecimento das reações imunitárias do organismo. [O agente da sida é o retrovírus VIH. A doença caracteriza se pela… … Dicionário da Língua Portuguesa
SIDA — o sida sustantivo masculino 1. Sigla de Síndrome de Inmuno deficiencia Adquirida , España. Enfermedad viral grave transmitida por vía sexual y sanguínea que ataca al sistema de inmunidad del organismo (en inglés AIDS ) … Diccionario Salamanca de la Lengua Española
sida — o sida sustantivo masculino 1. Sigla de Síndrome de Inmuno deficiencia Adquirida , España. Enfermedad viral grave transmitida por vía sexual y sanguínea que ataca al sistema de inmunidad del organismo (en inglés AIDS ) … Diccionario Salamanca de la Lengua Española
Sida — Si da, n. [NL., fr. Gr. ??? a kind of plant.] (Bot.) A genus of malvaceous plants common in the tropics. All the species are mucilaginous, and some have tough ligneous fibers which are used as a substitute for hemp and flax. Balfour (Cyc. of… … The Collaborative International Dictionary of English