- L-Aminosäure
-
Aminosäuren (unüblich Aminocarbonsäuren, veraltet Amidosäuren), sind eine Klasse organischer Verbindungen mit mindestens einer Carboxylgruppe (–COOH) und einer Aminogruppe (–NH2). Die Stellung der Aminogruppe zur Carboxylgruppe teilt die Klasse der Aminosäuren in Gruppen auf. Die wichtigsten Aminosäuren haben eine endständige Carboxylgruppe und in direkter Nachbarschaft die Aminogruppe. Dies nennt man vicinal oder α-ständig; diese Aminosäuren gehören zu den so genannten α-Aminosäuren.
Der Begriff Aminosäuren wird häufig vereinfachend als Synonym für die proteinogenen Aminosäuren verwendet. Diese α-Aminosäuren sind die Bausteine der Proteine. Bisher sind 22[1] proteinogene Aminosäuren bekannt, das Spektrum der Klasse der Aminosäuren geht aber weit über diese hinaus. So sind bisher 250 nicht-proteinogene natürlich vorkommende Aminosäuren bekannt, die biologische Funktionen haben.[2] Die Anzahl der synthetisch erzeugten und die der theoretisch möglichen Aminosäuren ist noch erheblich größer.
Inhaltsverzeichnis
Allgemeiner Aufbau der Aminosäuren
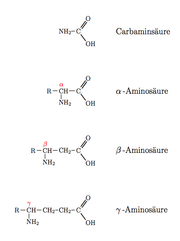
Die instabile Carbaminsäure ist formal die einfachste Aminosäure[3]. Sie enthält nur die Carboxyl- und am selben Kohlenstoffatom die Aminogruppe. Alle weiteren Aminosäuren bestehen aus mindestens zwei Kohlenstoffatomen. Dabei entscheidet das Kohlenstoffatom, an dem sich die Aminogruppe befindet, um welche Klasse von Aminosäuren es sich handelt. Sind im Molekül mehrere Aminogruppen vertreten, so bestimmt dasjenige Kohlenstoff, dessen Aminogruppe dem Carboxyl-Kohlenstoff am nächsten steht, um welche Klasse von Aminosäuren es sich handelt.
- α-Aminosäuren: Die Aminogruppe der α-Aminosäuren befindet sich am zweiten Kohlenstoffatom, einschließlich des Carboxyl-Kohlenstoffatoms. Die Zählung beginnt immer mit dem Carboxyl-Kohlenstoff. Die IUPAC-Bezeichnung lautet daher 2-Aminocarbonsäuren. Der einfachste Vertreter der α-Aminosäuren ist die proteinogene Aminosäure Glycin.
Der Begriff Aminosäuren wird meist synonym für eine Gruppe von α-Aminosäuren verwendet, die hauptsächlich aus L-α-Aminosäuren besteht: die proteinogenen Aminosäuren. Die proteinogenen Aminosäuren sind die Bausteine sämtlicher Proteine allen Lebens auf der Erde und neben den Nukleinsäuren Grundbausteine des Lebens. - β-Aminosäuren: Die Aminogruppe der β-Aminosäuren befindet sich am dritten Kohlenstoffatom (das Carboxyl-Kohlenstoffatom mitgezählt). Die IUPAC-Bezeichnung lautet 3-Aminocarbonsäuren. Der einfachste Vertreter ist β-Alanin.
- γ-Aminosäuren: Die Aminogruppe der γ-Aminosäuren befindet sich am vierten Kohlenstoffatom (das Carboxyl-Kohlenstoffatom mitgezählt). Die IUPAC-Bezeichnung lautet 4-Aminocarbonsäuren. Der einfachste Vertreter ist γ-Aminobuttersäure (GABA).
Die Bezeichnung weiterer Klassen der Aminosäuren ergibt sich nach dem gleichen Schema.
Die Aminosäuren einer Klasse unterscheiden sich durch ihre Seitenkette, die auch Aminosäurerest oder kurz Rest (bzw. R) genannt wird. Ist der Rest R verschieden von den anderen Substituenten, die sich am Kohlenstoff mit der Amino-Gruppe befinden, so befindet sich hier ein Stereozentrum und es existieren von der entsprechenden Aminosäure zwei Enantiomere. Enthält der Aminosäurerest weitere Stereozentren, so ergeben sich auch Diastereomere und die Zahl möglicher Stereoisomerer nimmt entsprechend zur Anzahl der weiteren Stereozentren zu. Von Aminosäuren mit zwei verschieden substituierten Stereozentren gibt es vier Stereoisomere.
Säure- und Base-Verhalten
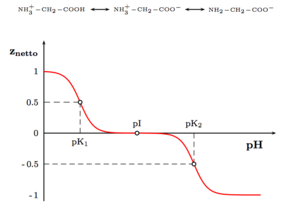
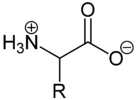
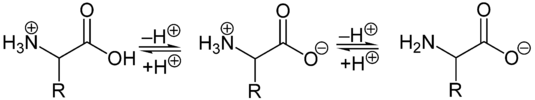
Als Feststoffe und in neutralen wässrigen Lösungen liegen Aminosäuren als Zwitterionen vor, d. h. die Aminogruppe ist protoniert und die Carboxylgruppe ist deprotoniert. Diese Eigenschaft führt zu der in der Regel guten Löslichkeit von Aminosäuren in Wasser. Verallgemeinert lässt sich das Zwitterion so darstellen:
Als Zwitterion kann die Carboxylgruppe als Base (Protonenakzeptor) und die Aminogruppe kann als Säure (Protonendonator) reagieren. In sauren Lösungen liegen Aminosäuren als Kationen und in basischen Lösungen als Anionen vor:
Die Ladung eines Aminosäuremoleküls hängt also vom pH-Wert der Lösung ab. Bei einem Zwitterion ist die Gesamtladung des Moleküls gleich null. Der entsprechende pH-Wert wird als isoelektrischer Punkt (pHI, pI) einer Aminosäure bezeichnet.
Proteinogene Aminosäuren
Als proteinogene Aminosäuren werden alle Aminosäuren bezeichnet, die die Bausteine der Proteine von Lebewesen sind. Dabei handelt es sich bei den proteinogenen Aminosäuren stets um α-Aminosäuren. Bis auf die Aminosäure Glycin ist für alle proteinogenen Aminosäuren das α-Kohlenstoffatom asymmetrisch (die Moleküle sind chiral): Es existieren von jeder dieser Aminosäuren zwei Enantiomere.[4] Dabei ist nur eines der beiden Enatiomere proteinogen und zwar die L-Aminosäure: der zum Aufbau der Proteine notwendige Apparat – das Ribosom, die tRNA, die Aminoacyl-tRNA Synthetase (diese belädt die tRNA mit Aminosäuren) und andere – sind selbst auch chiral und können nur die L-Variante erkennen.[5]
D-Aminosäuren kommen in Lebewesen vereinzelt vor. Sie werden dann aber unabhängig vom proteinogenen Stoffwechsel synthetisiert und bleiben daher nichtproteinogen. Sie werden z. B. in der bakteriellen Zellwand und kurzen bakteriellen Peptiden wie Valinomycin (siehe Carrier) eingebaut.
Kanonische Aminosäuren
20 der proteinogenen Aminosäuren werden durch Codons des genetischen Materials kodiert. Sie werden daher als kanonische Aminosäuren oder auch als Standardaminosäuren bezeichnet.
Die kanonische Aminosäure Prolin besitzt, im Gegensatz zu den anderen kanonischen Aminosäuren, keine primäre, sondern eine sekundäre Aminogruppe, und wird daher auch als sekundäre Aminosäure, fälschlicherweise bzw. veraltet oft auch als Iminosäure, bezeichnet.
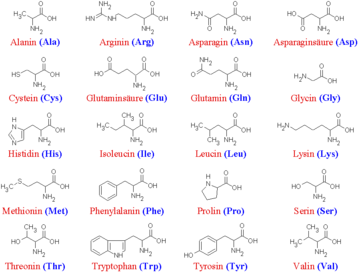
In Aminosäuresequenzen werden die Aminosäuren meist im Einbuchstabencode oder im Dreibuchstabencode dargestellt.
Die 20 kanonischen Aminosäuren Aminosäure Dreibuchstabencode Einbuchstabencode Bemerkung Alanin Ala A nicht-essentiell Arginin Arg R semi-essentiell Asparagin Asn N nicht-essentiell Asparaginsäure Asp D nicht-essentiell Cystein Cys C nicht-essentiell* Glutamin Gln Q nicht-essentiell Glutaminsäure Glu E nicht-essentiell Glycin Gly G nicht-essentiell Histidin His H semi-essentiell Isoleucin Ile I essentiell Leucin Leu L essentiell Lysin Lys K essentiell Methionin Met M essentiell Phenylalanin Phe F essentiell Prolin Pro P nicht-essentiell Serin Ser S nicht-essentiell Threonin Thr T essentiell Tryptophan Trp W essentiell Tyrosin Tyr Y nicht-essentiell* Valin Val V essentiell *für Kinder und Schwangere essentiell Nicht-kanonische Aminosäuren
Zu den nicht-kanonischen Aminosäuren gehören alle anderen proteinogenen Aminosäuren. Diese wiederum können in drei Klassen eingeteilt werden:
- Zur ersten Klasse gehören die Aminosäuren, die durch eine Rekodierung des genetischen Materials in Proteine eingebaut werden. Die 21. und die 22. proteinogene Aminosäuren – Selenocystein und Pyrrolysin – gehören zu dieser Klasse. Es wird vermutet, dass diese Aminosäuren wahrscheinlich keine eigene kanonische tRNA haben, sondern sich ihre tRNA von den kanonischen tRNAs ableitet (siehe Selenocystein). Die Aminosäuren dieser Klasse werden nicht von allen Organismen verwendet.
- Zur zweiten Klasse gehören die Aminosäuren, die aus kanonischen Aminosäuren entstehen, deren Aminosäurerest R nach dem Einbau in Proteine verändert wird. So kann beispielsweise Prolin zu Hydroxyprolin, Serin zu O-Phosphoserin, Tyrosin zu O-Phosphotyrosin und Glutamat zu γ-Carboxyglutamat umgewandelt werden. Eine wichtige Änderungen des Aminosäurerestes stellt auch die Glykosylierung dar: hier werden Kohlenhydratreste auf die Aminosäurereste übertragen, wodurch Glykoproteine entstehen.
- Zur dritten Klasse gehören die Aminosäuren, die der Organismus nicht von den kanonischen Aminosäuren unterscheiden kann und die er deshalb anstelle dieser in Proteine unspezifisch einbaut. Dazu gehört beispielsweise Selenomethionin, das anstelle des Methionin eingebaut werden kann, das Canavanin, das der Organismus nicht vom Arginin unterscheiden kann oder die Azetidin-2-carbonsäure, die als Prolin-Analogon wirkt. Viele der proteinogenen Aminosäuren dieser Klasse sind toxisch, da sie oft zu einer Fehlfaltung des Proteins führen, wodurch die Funktionsfähigkeit des Proteins beeinträchtigt werden kann. So ist Azetidin-2-carbonsäure ein toxischer Bestandteil des Maiglöckchens, wobei sich das Maiglöckchen mit einer hochspezifischen Prolyl-tRNA-Synthetase vor dem unkontrollierten Einbau dieser Aminosäure schützt. Wegen ihrer oft toxischen Wirkung werden diese Aminosäuren oft nicht zu den proteinogenen Aminosäuren gezählt, zu denen sie jedoch per definitionem gehören.
Der Mensch selbst nutzt die 20 kanonischen Aminosäuren sowie Selenocystein. Von den 20 kanonischen Aminosäuren werden 12 vom menschlichen Organismus bzw. durch im menschlichen Verdauungstrakt lebende Mikroorganismen synthetisiert. Die restlichen 8 Aminosäuren sind für den Menschen essentiell, d. h. er muss sie über die Nahrung aufnehmen.
Biochemische Bedeutung
Aminosäuren als Bausteine von Proteinen
L-Aminosäuren sind in der Biochemie von großer Bedeutung, da sie die Bausteine von Peptiden und Proteinen (Eiweißen) sind. Im Allgemeinen werden in der Literatur zwanzig so genannte proteinogene Aminosäuren genannt, d. h. solche, die im Genom für Proteine kodiert sind, allerdings sind in letzter Zeit zwei weitere (Selenocystein und Pyrrolysin) hinzugekommen. Bei diesen handelt es sich stets um α-Aminosäuren, da die Aminogruppe und die Carboxylgruppe mit demselben Kohlenstoffatom (Cα) verbunden sind. Diese 20 L-Aminosäuren werden durch je drei Nukleinbasen in der DNA kodiert. Darüber hinaus gibt es noch weitere Aminosäuren, die Bestandteile von Proteinen sind, jedoch nicht kodiert werden.
Aminosäureketten werden in Abhängigkeit von ihrer Länge als Peptide oder Proteine bezeichnet. Aminosäureketten mit einer Länge von unter ca. 100 Aminosäuren werden meist noch als Peptide bezeichnet, erst ab einer größeren Kettenlänge spricht man von Proteinen. Die einzelnen Aminosäuren sind dabei innerhalb der Kette über die so genannte Peptidbindung (Säureamid) verknüpft. Ein automatisiertes Verfahren zur Synthese von Peptiden liefert die Merrifield-Synthese.
In Form von Nahrung aufgenommene Proteine werden bei der Verdauung in L-Aminosäuren zerlegt. In der Leber werden sie weiter verwertet. Entweder werden sie zur Proteinbiosynthese verwendet oder abgebaut (siehe auch: Aminosäureindex). Die wichtigsten Mechanismen des Aminosäurenabbaus sind:
Essentielle Aminosäuren
Aminosäuren, die ein tierischer Organismus benötigt, jedoch nicht selbst herstellen kann, heißen essentielle Aminosäuren und müssen mit der Nahrung aufgenommen werden. Alle essentiellen Aminosäuren sind L-α-Aminosäuren. Für Menschen sind Valin, Methionin, Leucin, Isoleucin, Phenylalanin, Tryptophan, Threonin und Lysin essentielle Aminosäuren. Semi-essentielle Aminosäuren müssen nur in bestimmten Situationen mit der Nahrung aufgenommen werden, z. B. während des Wachstums oder bei schweren Verletzungen. Die übrigen Aminosäuren werden entweder direkt synthetisiert oder aus anderen Aminosäuren durch Modifikation gewonnen. Cystein kann aus der essentiellen Aminosäure Methionin synthetisiert werden. Für Kinder ist zusätzlich zu den generell essentiellen Aminosäuren Tyrosin essentiell, da in diesem Lebensalter die Körperfunktion zu dessen Herstellung aus Phenylalanin noch nicht ausgereift ist. Es gibt auch Erkrankungen, die den Aminosäurestoffwechsel beeinträchtigen, dann müssen unter Umständen eigentlich nicht-essentielle Aminosäuren dennoch mit der Nahrung aufgenommen werden. Hühnereier z. B. enthalten alle essentiellen bzw. semi-essentiellen Aminosäuren, die der menschliche Körper benötigt.
Pflanzen und Mikroorganismen können alle für sie notwendigen Aminosäuren selbst synthetisisern; daher gibt es für sie keine essentiellen Aminosäuren.[4]
Chemisch-Physikalische Eigenschaften
Die proteinogenen Aminosäuren lassen sich nach ihren Resten in Gruppen aufteilen (siehe Tabellenübersicht der Eigenschaften). Dabei kann eine Aminosäure in verschiedenen Gruppen gleichzeitig auftauchen. In einem Mengendiagramm lassen sich die Überlappungen der Gruppen grafisch darstellen.
Säure- und Basen-Verhalten
Für das Säure-Base-Verhalten proteinogener Aminosäuren ist vor allem das Verhalten des Aminosäurerestes R interessant. Das liegt daran, dass für die Biochemie vor allem Proteine interessant sind. In Proteinen sind aber die NH2- und COOH-Gruppen wegen der Peptidbindung nicht titrierbar und damit ungeladen. Die Ausnahme ist der N- und der C-Terminus des Proteins. Daher ist für das Säure-Base-Verhalten von Proteinen und Peptiden der Aminosäurerest R so wichtig.
pK-Werte von Aminosäure-Seitenketten (für die freien Aminosäurenreste und im Protein) Aminosäure Bezeichnung frei im Protein Asp sauer 3,68 3,7–4,0 Glu sauer 4,25 4,2–4,5 His basisch 6,0 6,7–7,1 Cys semisauer 8,33 8,8–9,1 Tyr semisauer 10,07 9,7–10,1 Lys basisch 10,53 9,3–9,5 Arg basisch 12,48 – Das Verhalten der Seitenkette R hängt von ihrer Konstitution ab, d. h., ob die Seitenkette selbst wieder als Protonenakzeptor oder -donator wirken kann. Dazu werden die proteinogenen Aminosäuren in basische und saure Aminosäuren eingeteilt.
Zu den basischen Aminosäuren gehören:
Zu den sauren Aminosäuren gehören:
- Asparaginsäure (Aspartat)
- Glutaminsäure (Glutamat)
Weitere Aminosäuren mit ionisierbaren Resten:
Die Reste R der hier genannten Aminosäuren werden auch als titrierbare Reste bezeichnet.
Die Reste R der anderen proteinogenen Aminosäuren sind unter physiologischen Bedingungen nicht ionisierbar und wirken daher weder als Base noch als Säure. Der Seitenrest von Cystein wirkt zwar auch als schwache Säure, Cystein wird aber nicht zu den sauren Aminosäuren dazu gezählt, da sie unter physiologischen Bedingungen als Base (d. h. protoniert) vorliegt. Das gleiche gilt für Tyrosin.
Der pK-Wert ist der pH-Wert, bei der die titrierbaren Gruppen zu gleichen Teilen protoniert und deprotoniert vorliegen. D. h., die titrierbare Gruppe liegt zu gleichen Teilen in ihrer basischen, wie in ihrer sauren Form vor (siehe auch: Henderson-Hasselbalch-Gleichung).
Es ist meist üblich statt vom pKS vom pK zu sprechen, d. h. vom pK der Säure. In diesem Sinne müsste allerdings vom pK des Lysins als pKB, d.h. vom pK der Base gesprochen werden. Aus Gründen der Vereinfachung wird diese Notation aber allgemein weggelassen, da sie sich auch aus dem Sinnzusammenhang selbst ergibt (d. h. ob die Gruppe als Base oder Säure wirkt).
Der pK ist keine Konstante, sondern hängt von der Temperatur, der Ionenstärke und der unmittelbaren Umgebung der titrierbaren Gruppe ab und kann daher stark schwanken.
Ist der pH höher als der pK einer titrierbaren Gruppe, so liegt die titrierbare Gruppe in ihrer basischen (deprotonierten) Form vor. Ist der pH niedriger als der pK der titrierbaren Gruppe, so liegt die titrierbare Gruppe in ihrer sauren (protonierten) Form vor:
- für Asp (pK = 3,86) bei pH 7: die Seitenkette ist nahezu vollständig deprotoniert
- für Lys (pK= 10,53) bei pH 7: die Seitenkette ist nahezu vollständig protoniert
Die Seitenketten basischer Aminosäuren sind in ihrer protonierten (sauren) Form einfach positiv geladen und in ihrer deprotonierten (basischen) Form ungeladen. Die Seitenketten der sauren Aminosäuren (einschließlich Cystein und Tyrosin) sind in ihrer protonierten (sauren) Form ungeladen und in ihrer deprotonierten (basischen) Form einfach negativ geladen. Deswegen spielt der pH-Wert für die Eigenschaften der Seitenkette eine so wichtige Rolle, da das Verhalten der Seitenkette ein ganz anderes ist, wenn sie geladen bzw. ungeladen ist.
Die titrierbaren Seitenketten beeinflussen zum Beispiel das Löslichkeitsverhalten der entsprechenden Aminosäure. In polaren Lösungsmitteln gilt: geladene Seitenketten machen die Aminosäure löslicher, ungeladene Seitenketten machen die Aminosäure unlöslicher.
In Proteinen kann das dazu führen, das bestimmte Abschnitte hydrophiler oder hydrophober werden, wodurch die Faltung und damit die Aktivität von Enzymen vom pH-Wert abhängt. Mit stark sauren und basischen Lösungen können Proteine deswegen auch denaturiert werden.
Elektrische Eigenschaften der Aminosäuren.[6] Aminosäure pK2COOH pK1COOH Isoelektrischer
PunktpK1NH2 pK2NH2 Alanin - 2,3 6,1 9,9 - Arginin – 2,81 11,76 9,09 13,2 Asparagin – 2,02 5,41 8,80 - Asparaginsäure 3,65 1,88 2,85 9,60 - Cystein 8,33* 1,71 5,05 10,78 - Glutaminsäure 4,25 2,19 3,22 9,67 - Glutamin - 2,17 5,65 9,13 - Glycin - 2,21 5,97 9,15 - Histidin - 1,78 7,47 8,97 5,97 Isoleucin - 2,32 5,94 9,76 - Leucin - 2,4 5,98 9,6 - Lysin - 2,20 9,59 8,90 10,28 Methionin - 2,28 5,74 9,21 - Phenylalanin - 2,58 5,84 9,24 - Prolin - 1,99 6,3 10,60 - Serin - 2,21 5,68 9,15 - Threonin - 2,10 5,60 9,12 - Tryptophan - 2,15 5,64 9,12 - Tyrosin 9,11** 2,20 5,66 10,07 - Valin - 2,30 5,96 9,60 - * Thiolgruppe
** phenolische HydroxylgruppeTabellenübersicht der Eigenschaften
Eigenschaften der 20 kanonischen Aminosäurereste (R) nach Taylor.[6] Aminosäurerest Abk. Code Rest (R) Charakter von R Molare Masse von R (g/mol) van-der-Waals-Volumen von R Polarität von R Hydrophobizität[7] von R Acidität oder Basizität von R Säurekonstante (pKs) von R Alanin Ala A –CH3 aliphatisch 15,03 67 unpolar 1,8 neutral – Arginin Arg R –CH2CH2CH2NH-C(NH)NH2 aliphatisch 100,14 148 polar −4,5 basisch (stark) 12,48 Asparagin Asn N –CH2CONH2 aliphatisch 58,06 96 polar −3,5 neutral – Asparaginsäure Asp D –CH2COOH aliphatisch 59,04 91 polar −3,5 sauer 3,90 Cystein Cys C –CH2SH aliphatisch 47,10 86 polar 2,5 neutral 8,18 Glutamin Gln Q –CH2CH2CONH2 aliphatisch 72,09 114 polar −3,5 neutral – Glutaminsäure Glu E –CH2CH2COOH aliphatisch 73,07 109 polar −3,5 sauer 4,07 Glycin Gly G –H aliphatisch 1,01 48 unpolar −0,4 neutral – Histidin His H –CH2(C3H3N2) aromatisch 81,1 118 polar −3,2 basisch (schwach) 6,04 Isoleucin Ile I –CH(CH3)CH2CH3 aliphatisch 57,11 124 unpolar 4,5 neutral – Leucin Leu L –CH2CH(CH3)2 aliphatisch 57,11 124 unpolar 3,8 neutral – Lysin Lys K –CH2CH2CH2CH2NH2 aliphatisch 72,13 135 polar −3,9 basisch 10,54 Methionin Met M –CH2CH2SCH3 aliphatisch 75,15 124 unpolar 1,9 neutral – Phenylalanin Phe F –CH2(C6H5) aromatisch 91,13 135 unpolar 2,8 neutral – Prolin Pro P –CH2CH2CH2– heterocyclisch 42,08 90 unpolar −1,6 neutral – Serin Ser S –CH2OH aliphatisch 31,03 73 polar −0,8 neutral – Threonin Thr T –CH(OH)CH3 aliphatisch 45,06 93 polar −0,7 neutral – Tryptophan Trp W –CH2(C8H6N) aromatisch 130,16 163 polar −0,9 neutral – Tyrosin Tyr Y –CH2(C6H4)OH aromatisch 107,13 141 polar −1,3 neutral 10,46 Valin Val V –CH(CH3)2 aliphatisch 43,09 105 unpolar 4,2 neutral – Nicht-proteinogene Aminosäuren
Von den nicht-proteinogenen, das heißt nicht in Proteinen vorkommenden, Aminosäuren sind bislang über 250 bekannt, die in Organismen vorkommen. Dazu gehört etwa das L-Thyroxin, ein Hormon der Schilddrüse, L-DOPA, L-Ornithin oder das in fast allen Arten von Cyanobakterien nachgewiesene Neurotoxin Beta-Methylamino-Alanin (BMAA). Die L-Azetidin-2-carbonsäure ist ein toxischer Bestandteil der Rhizome einheimischer Maiglöckchen (Convallaria majalis) und Zuckerrüben. Sie wirkt hemmend auf das Pflanzenwachstum.
Die meisten nicht-proteinogenen Aminosäuren leiten sich von den proteinogenen ab, die L-α-Aminosäuren sind. Dennoch können dabei auch β-Aminosäuren (β-Alanin) oder γ-Aminosäuren (GABA) entstehen.
Zu den nicht-proteinogenen Aminosäuren zählen auch alle D-Enantiomeren der proteinogenen L-Aminosäuren.
Zu den synthetischen Aminosäuren gehört die 2-Amino-5-phosphonovaleriansäure (APV), ein Antagonist des NMDA-Rezeptors und das ökonomisch wichtige D-Phenylglycin [Synonym: (R)-Phenylglycin], das in der Seitenkette vieler semisynthetischer β-Lactamantibiotica als Teilstruktur enthalten ist. (S)- und (R)-tert-Leucin (Synonym: (S)- und (R)-β-Methylvalin) sind synthetische Strukturisomere der proteinogenen Aminosäure (S)-Leucin und werden als Edukt in stereoselektiven Synthesen eingesetzt.
Es gibt auch α-Aminosulfonsäuren [Beispiel: 2-Aminoethansulfonsäure (Synonym: Taurin)], α-Aminophosphonsäuren und α-Aminophosphinsäuren.[8] [9] [10][11] Das sind auch α-Aminosäuren, jedoch keine α-Aminocarbonsäuren. Statt einer Carboxylgruppe (–COOH) ist eine Sulfonsäure-, Phosphonsäure- bzw. Phosphinsäuregruppe in diesen α-Aminosäuren enthalten.
Einige nicht-proteinogene Aminosäuren Aminosäure Biologische Bedeutung Thyroxin Hormon der Schilddrüse GABA inhibitorischer Neurotransmitter L-Homoserin Stoffwechselzwischenprodukt der Argininsynthese Ornithin Stoffwechselzwischenprodukt im Harnstoffzyklus Citrullin Stoffwechselzwischenprodukt im Harnstoffzyklus Argininosuccinat Stoffwechselzwischenprodukt im Harnstoffzyklus L-DOPA Stoffwechselzwischenprodukt bei der Synthese von Katecholaminen 5-Hydroxytryptophan Stoffwechselzwischenprodukt bei der Serotoninsynthese β-Alanin Baustein von Coenzym A β-Methylamino-Alanin Neurotoxin in Cyanobakterien Ibotensäure Pilzgift D-Valin Bestandteil des Antibiotikums Valinomycin D-Alanin Bestandteil in bakteriellen Zellwänden D-Glutamat Bestandteil in bakteriellen Zellwänden 2,6-Diaminopimelinsäure Bestandteil in bakteriellen Zellwänden Siehe auch
Einzelnachweise
- ↑ G. Poeggel: Kurzlehrbuch Biologie. Thieme Verlag, 2005, ISBN 978-3-13-140981-2.
- ↑ Stand: Februar 2006.
- ↑ Genau genommen ist es keine Aminosäure, sondern ein Amid, also eine Amidocarbonsäure, vergleiche Amidosulfonsäure.
- ↑ a b Wissenschaft-Online-Lexika: Eintrag zu Aminosäuren im Lexikon der Biologie, abgerufen am 25. April 2009
- ↑ G. Löffler, P. E. Petrides, P. C. Heinrich: Biochemie & Pathobiochemie. 8. Auflage, Springer, Heidelberg 2006, ISBN 978-3-540-32680-9
- ↑ a b c W. R. Taylor: The classification of amino acid conservation. In: J. Theor. Biol. 119, 1986, S. 205–218 (doi:10.1016/S0022-5193(86)80075-3)).
- ↑ J. Kyte, R. F. Doolittle: A simple method for displaying the hydropathic character of a protein.. In: Journal of Molecular Biology. 157, Nr. 1, 1982, S. 105–132.
- ↑ Karlheinz Drauz, Hans Günter Koban, Jürgen Martens, Werner Schwarze: Phosphonic and Phosphinic Acid Analogs of Penicillamine. In: Liebigs Annalen der Chemie. 1985, Nr. 3, 1985, S. 448–452 (doi:10.1002/jlac.198519850303).
- ↑ B. Boduszek, T. Olszewski: Synthesis of New Imidazole Aminophosphonic and Aminophosphinic Acids. In: Polish Journal of Chemistry. 75, 2001, S. 1619–1623 (doi:10.1002/chin.200307122).
- ↑ B. Boduszek, T. Olszewski: Synthesis of New Imidazole Aminophosphonic and Aminophosphinic Acids.. In: ChemInform. 34, Nr. 7, 2003 (doi:10.1002/chin.200307122).
- ↑ B. Boduszek: Novel heterocyclic aminophosphonic acids derived from furan and thiophene. In: Polish Journal of Chemistry. 76, 2002, S. 1271.
Literatur
Bücher
- Harold Hart: Organische Chemie: Ein kurzes Lehrbuch. VCH, 1989, ISBN 3-527-26480-9.
- Lubert Stryer: Biochemie. 4. Auflage, Spektrum Akademischer Verlag, 1995, ISBN 3-86025-346-8.
- Roland Glaser: Biophysik. 4. Auflage, Gustav Fischer Verlag, 1996, ISBN 3-334-60967-7 (Fischer), ISBN 3-8252-8116-7.
- Uwe Meierhenrich: Amino Acids and the Asymmetry of Life. Springer-Verlag, Heidelberg/Berlin 2008, ISBN 978-3-540-76885-2.
Zeitschriftenartikel
- Bing Hao, Weimin Gong, Tsuneo K. Ferguson, Carey M. James, Joseph A. Krzycki, Michael K. Chan: A New UAG-Encoded Residue in the structure of a Methanogen Methyltransferase. In: Science 296, 2002, S. 1462–1466.
- S. J. Freeland, L. D. Hurst: Der raffinierte Code des Lebens. In: Spektrum der Wissenschaft Nr. 6, 2004, S. 86–93.* Wolfgang * Lei Wang, Peter G. Schultz: Die Erweiterung des genetischen Codes. In: Angewandte Chemie 117, Nr. 1, 2005, ISSN 0044-8249, S. 34–68.
- Leuchtenberger, Ulf Plöcker: Herstellung von Aminosäuren mit Hilfe biotechnologischer Methoden. In: Chemie-Ingenieur-Technik 60, 1988, S. 16−23.
Weblinks
- Aminosäuren
- Amino Acids, FU Berlin
- Lerne die 20 proteinogenen Aminosäuren
- http://www.russell.embl.de/aas/ – Aminosäure Eigenschaften (engl.)
- α-Aminosäuren: Die Aminogruppe der α-Aminosäuren befindet sich am zweiten Kohlenstoffatom, einschließlich des Carboxyl-Kohlenstoffatoms. Die Zählung beginnt immer mit dem Carboxyl-Kohlenstoff. Die IUPAC-Bezeichnung lautet daher 2-Aminocarbonsäuren. Der einfachste Vertreter der α-Aminosäuren ist die proteinogene Aminosäure Glycin.
Wikimedia Foundation.

_svg.png)