- Hausmanit
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Mangan, Mn, 25 Serie Übergangsmetalle Gruppe, Periode, Block 7, 4, d Aussehen silbrig metallisch CAS-Nummer 7439-96-5 Massenanteil an der Erdhülle 0,09 % Atomar Atommasse 54,938049 u Atomradius (berechnet) 140 (161) pm Kovalenter Radius 139 pm Elektronenkonfiguration [Ar] 3d54s2 Elektronen pro Energieniveau 2, 8, 13, 2 Austrittsarbeit 4,1 eV 1. Ionisierungsenergie 717,3 kJ/mol 2. Ionisierungsenergie 1509 kJ/mol 3. Ionisierungsenergie 3248 kJ/mol 4. Ionisierungsenergie 4940 kJ/mol 5. Ionisierungsenergie 6990 kJ/mol 6. Ionisierungsenergie 9220 kJ/mol 7. Ionisierungsenergie 11500 kJ/mol Physikalisch Aggregatzustand fest Modifikationen α-Mn, β-Mn Kristallstruktur α-Mn:kubisch raumzentriert
β-Mn:kubisch-primitivDichte 7,47 g/cm3 Mohshärte 6,0 Schmelzpunkt 1517 K (1244 °C) Siedepunkt 2235 K (1962 °C) Molares Volumen 7,35 · 10-6 m3/mol Verdampfungswärme 226 kJ/mol Schmelzwärme 12,05 kJ/mol Dampfdruck 121 Pa bei 1517 K Schallgeschwindigkeit 5150 m/s bei 293,15 K Spezifische Wärmekapazität 480 J/(kg · K) Elektrische Leitfähigkeit 0,695 · 106 A/(V · m) Wärmeleitfähigkeit 7,82 W/(m · K) Chemisch Oxidationszustände 1, 2, 4, (5), 6, 7 Oxide (Basizität) (stark sauer) Normalpotential Elektronegativität 1,55 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 52Mn 5,591 d ε 4,712 52Cr 53Mn 3,74 · 106 a ε 0,597 53Cr 54Mn 312,3 d ε 1,377 54Cr β− 0,697 54Fe 55Mn 100 %
Stabil 56Mn 2,5785 h β− 3,695 56Fe NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung [1] Pulver

Leicht-
entzündlich(F) R- und S-Sätze R: 11 (Pulver) S: 7-33-43-60(Pulver) Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Mangan [maŋˈɡaːn] (von franz. manganèse „schwarze Magnesia“) ist ein chemisches Element im Periodensystem der Elemente mit dem Symbol Mn und der Ordnungszahl 25.
Inhaltsverzeichnis
Geschichte
Manganverbindungen werden seit Jahrtausenden vom Menschen genutzt. Farben mit Manganpigmenten aus Mangandioxid können 17.000 Jahre zurückverfolgt werden. Römer und Ägypter verwendeten Manganverbindungen in der Glasherstellung zur Färbung und Entfärbung. Spartaner nutzten manganhaltiges Eisenerz zur Herstellung ihrer Waffen. Dass die hohe Qualität der Waffen auf einer Eisen-Mangan-Legierung beruhte, muss als Spekulation angesehen werden.
Im 17. Jahrhundert stellte der Chemiker Johann Rudolph Glauber Permanganat her. Mitte des 18. Jahrhunderts nutzte man Manganoxid zur Herstellung von Chlor. Auf Anregung des schwedischen Chemikers Carl Wilhelm Scheele, der 1774 entdeckte, dass Braunstein kein Eisenerz ist, sondern ein bis dahin unbekanntes Metall enthalten müsse, gelang es Johan Gottlieb Gahn noch im gleichen Jahr, erstmals elementares Mangan aus Braunstein durch Reduktion mit Kohle herzustellen. Anfang des 19. Jahrhunderts begann der Einsatz von Mangan zur Eisenherstellung. 1816 war die festigkeitssteigernde Wirkung ohne erhöhte Sprödigkeit bekannt.
Vorkommen
Mangan ist mit einem Gehalt von 0,095 %[2] ein in der Erdkruste häufiges Element, in der nach Häufigkeit geordneten Liste der Elemente steht es an zwölfter Stelle. Es kommt nicht gediegen, sondern nur in Form verschiedener Verbindungen in Mineralen vor. Bei den meisten natürlichen Manganverbindungen handelt es sich um Silicate, Oxide oder Carbonate.
Die für die Mangangewinnung wichtigsten Erze stellen die durch Verwitterung der Silicate entstandenen Oxide und Carbonate dar. Die bedeutendsten sind Braunsteine MnO2, Braunit (3 Mn2O3 · MnSiO3), Hausmannit (Mn3O4), Manganit [γ-MnO(OH)] und Rhodochrosit MnCO3.
Das größte bekannte Manganvorkommen liegt in der Kalahari in der Nördlichen Kapprovinz in Südafrika. Daneben liegen größere Vorkommen in Australien, China, Gabun, Brasilien, der Ukraine und Indien.[3] Größere Mengen Mangan enthalten die Manganknollen und Mangankrusten in der Tiefsee.
 Stolleneingang des „Karl-Heinz-Stollen“ der Grube „Gilsenhang“ in Heckholzhausen die ausschließlich der Manganerzförderung diente (errichtet um 1910)
Stolleneingang des „Karl-Heinz-Stollen“ der Grube „Gilsenhang“ in Heckholzhausen die ausschließlich der Manganerzförderung diente (errichtet um 1910)Deutschland ist arm an Manganerzen, nennenswerte Mengen finden sich z. B. im Siegerländer Spateisensteinbezirk, im mittleren Thüringer Wald nahe Ilmenau, im Harz bei Ilfeld und im Westerwald. An einigen dieser Orte wurde er im nennenswerten Umfang gewonnen.
Gewinnung und Darstellung
Manganerze können ebenso wie Chromerze nicht durch Kohle zum Element reduziert werden. Dies liegt an der Bildung von stabilen Carbiden. Für viele technische Anwendungen von Mangan, wie Ferromangan, können Gemische aus Eisen- und Manganerzen eingesetzt und mit Kohlenstoff reduziert werden.
Metallisches Mangan wird überwiegend durch Elektrolyse von Mangan(II)-sulfat-Lösungen hergestellt:
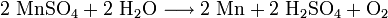
Ein weiterer, aber selten genutzter Herstellungsweg ist die Reduktion zu elementarem Mangan mit Hilfe des aluminothermischen oder silicothermischen Verfahrens.
Eigenschaften
Mangan ist ein grau-weißes, hartes und sehr sprödes Schwermetall, in einigen Eigenschaften dem Eisen ähnelnd. Andere Quellen weisen absolut kohlenstofffreies Mangan als duktil aus.
Mangan kommt hauptsächlich in den Oxidationsstufen +2, +4 und +7 vor. Es existieren aber alle Oxidationsstufen von −3 bis +7, wodurch das Mangan das Element mit den meisten verschiedenen Oxidationsstufen ist. Zum Erreichen einiger der Oxidationszahlen benötigt man allerdings drastische Bedingungen. Chemisch verhält sich Mn2+ oft ähnlich dem Ca2+ und kann dieses auch in biologischen Systemen, z. B. im Knochen, ersetzen. Mn+7 in Form des Permanganats ist ein häufig genutztes und relativ starkes Oxidationsmittel. Elementares Mangan ist relativ unbeständig. Von Wasser wird es unter Wasserstoffentwicklung angegriffen. In verdünnten, nichtoxidierenden Säuren löst es sich ebenfalls. In der Wärme reagiert es mit Bor, Kohlenstoff, Silicium, Stickstoff, Phosphor, Sauerstoff, Schwefel und den Halogenen. Mit Wasserstoff reagiert Mangan nicht unter Bildung eines Hydrides.
An Luft ist Mangan durch Bildung eines Oxidfilms (Schutzschicht) beständig.
α-Mn kristallisiert in der kubisch-raumzentrierten Packung mit 58 Atomen und 4 verschiedenen Lagen in der Elementarzelle. Die Atome sind in Form von Friauf-Polyedern angeordnet. β-Mn kristallisiert in der kubisch-primitiven Packung mit 20 Atomen und 2 verschiedenen Lagen.
Nachweis
Mangan(II)-Kationen werden für die Nachweisreaktion im Kationentrenngang im sogenannten „Alkalischen Bad“ − einer Mischung aus konz. Wasserstoffperoxid und Natriumhydroxid − zum Mangan(IV)-Kation oxidiert. Das Mangan(IV)-oxid-hydroxid „Braunstein“ wird dann durch Kochen in konz. Salpetersäure gelöst und mit Blei(IV)-oxid zum violetten Permanganat aufoxidiert:
1. Aufoxidation zum Mangan(IV)-Kation im alkalischen Bad:
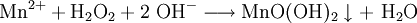
- Farblose Mangan(II)-Ionen reagieren im alkalischen Bad zu braunem Manganoxiddihydroxid, der als Niederschlag ausfällt, und Wasser.
2. Nachweis als Permanganat mit Blei(IV)-oxid:
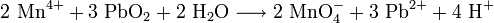
- Braune Mangan(IV)-Ionen reagieren mit Blei(IV)-oxid und Wasser zu violetten Permanganat-Ionen, Blei(II)-Ionen und Wasserstoff-Ionen.
Auch die Boraxperle wird zum qualitativen Nachweis einiger Metalle beim Kationentrenngang in der Analytische Chemie verwendet. In Anwesenheit von Mangan-Ionen färbt sie sich in der Oxidationszone violett. Ebenfalls als Vorprobe kann die alkalische Oxidationsschmelze (mit Alkalimetallnitraten und -Carbonaten) genutzt werden, wobei grünes Manganat(VI) (MnO42-) oder auch (bei nicht ausreichendem Angebot an Sauerstoff) blaues Manganat(V) (MnO43-) gebildet wird[4].
Verwendung
Mangan ist wegen seiner hohen Affinität zu Schwefel und Sauerstoff sowie seiner werkstoffverbessernden Eigenschaften von hoher Bedeutung für die Metallindustrie. Ca. 90% bis 95% des erzeugten Mangans beziehungsweise Ferromangans gehen in die Eisen-, Stahl- und Sonderwerkstoffherstellung:
- Desoxidation und Entschwefelung von Eisen und Stahl
- preisgünstiger Nickelersatz in korrosionsbeständigen Edelstählen
- stark festigkeitssteigerndes Legierungselement in Stählen
- Kupfer-Mangan-(Nickel-)Legierungen beispielsweise Manganin für temperaturunabhängige Widerstände
- Aluminium-Mangan-Legierungen
- Ausdehnungslegierungen mit extrem hohen Ausdehnungskoeffizienten, zum Beispiel aktive Schalter aus Bimetall
Mangandioxid dient als Oxidationsmittel in Trockenbatterien. Bei der Farbenherstellung werden Manganverbindungen als Sikkative verwendet.
Der Bedarf an Mangan wird in den nächsten Jahren nicht sinken, da keine ökonomisch sinnvollen Ersatztechnologien bekannt sind.
Physiologie
Gebundenes Mangan ist ein essentielles Spurenelement für alle Lebensformen. Es ist wichtiger Bestandteil vieler Enzyme und steigert die Verwertung des Vitamin B1, wichtig ist es für die Insulinproduktion der Bauchspeicheldrüse. In Pflanzen findet sich im Photosystem II ein Komplex mit 4 Manganionen. Dieser dient zur Spaltung von Wasser und der damit verbundenen Gewinnung von Elektronen.[5]
Der menschliche Körper enthält etwa 10 - 20 mg Mangan, entsprechend ca. 0,1 - 0,3 ppm, das meiste davon ist in den Knochen gebunden. Täglich sollten ungefähr 4 mg aufgenommen werden. Manganreich sind Nüsse, Vollkornprodukte, Keimlinge, Erdbeeren und Kakao. Milch, Mineralwässer und manche Trinkwässer sind manganarm.
Sicherheitshinweise
Mangan ist im Vergleich zu vielen anderen Schwermetallen relativ unproblematisch. Die Gefährlichkeit der meisten Verbindungen ist gering und es wurden praktisch noch nie Vergiftungsfälle durch orale Aufnahme von Manganverbindungen bekannt. Chronische Manganaufnahme über die Atemwege als Staub ist hingegen toxisch und führt zu Manganismus. Diese Krankheit befiel vor allem Bergarbeiter, aber auch Mitarbeiter von Batteriefabriken und zeigt sich vor allem durch motorische Störungen ähnlich dem Morbus Parkinson durch Anreicherung des Mangans in den Basalganglien. Dadurch wurden auch Wesensveränderungen und Psychosen beschrieben. Im Gegensatz zum Morbus Parkinson ist der Manganismus aber gegenüber den herkömmlichen Therapieformen (Levodopa) resistent. Der Kontakt mit Permanganat kann zu Verätzungen führen.
Verbindungen
- Kaliumpermanganat wird als relativ starkes Oxidationsmittel im Laborbereich eingesetzt. In der Medizin wird es als frisch angesetzte wässrige Lösung (0,05 bis 1%) zur Hautdesinfektion und zur äußerlichen Behandlung von infektiösen Hauterkrankungen verwendet. Ebenso findet es Verwendung bei der Therapie von parasitären Fischkrankheiten.
- Manganoxide
- Mangandioxid wird genutzt als Oxidationsmittel in Trockenzellen (Batterien vom Typ Zink-Kohle, Alkali-Mangan und Lithium). Als Glasmacherseife wird es zur Entfärbung von eisenhaltigen Glasschmelzen eingesetzt. Es kompensiert die gelbe Farbe der Fe3+ Ionen durch eine violette Färbung.
- Ferromangan als Legierungszuschlag in der metallurgischen Industrie.
- Himbeerspat (Rhodochrosit, Mangancarbonat) rosa bis blutrotes Mineral zur Herstellung von Schmucksteinen.
Einzelnachweise
- ↑ Sicherheitsdatenblatt (alfa-aesar)
- ↑ Mangan in: Roempp Chemie Lexikon, Thieme Verlag, 2008.
- ↑ Manganese, U.S. Geological Survey, Mineral Commodity Summaries, January 2008.
- ↑ Jander-Blasius, Lehrbuch der analytischen und präparativen anorganischen Chemie, 8. Auflage, S. Hirzel Verlag Stuttgart, 1969
- ↑ Kaim, W., Schwederewski, B.: Bioanorganische Chemie, Zur Funktion chemischer Elemente in Lebensprozessen. 4. Auflage, Teubner-Verlag, Wiesbaden, 2005.
Literatur
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3
Weblinks
- Mineralienatlas:Mangan (Wiki)
- Katalyse-Institut für angewandte Umweltforschung - Schwermetall Mangan
- Mangan (Periodensystem für den Schulgebrauch, Illustrationen)
- Bild in der Elementesammlung von Pniok.de
- WebElements.com - Manganese (engl.)
- International Manganese Institute (engl.)
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.




