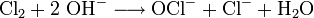- Cl2
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Chlor, Cl, 17 Serie Halogene Gruppe, Periode, Block 17, 3, p Aussehen gelblich-grün CAS-Nummer 7782-50-5 Massenanteil an der Erdhülle 0,19 % Atomar Atommasse 35,453 u Atomradius (berechnet) 100 (79) pm Kovalenter Radius 99 pm Van-der-Waals-Radius 175 pm Elektronenkonfiguration [Ne] 3s2 3p5 Elektronen pro Energieniveau 2, 8, 7 1. Ionisierungsenergie 1251,2 kJ/mol 2. Ionisierungsenergie 2298 kJ/mol 3. Ionisierungsenergie 3822 kJ/mol 4. Ionisierungsenergie 5159 kJ/mol 5. Ionisierungsenergie 6542 kJ/mol 6. Ionisierungsenergie 9362 kJ/mol 7. Ionisierungsenergie 11018 kJ/mol Physikalisch Aggregatzustand gasförmig Kristallstruktur orthorhombisch Dichte 3,214 kg · m−3 bei 273 K Mohshärte - Magnetismus diamagnetisch Schmelzpunkt 171,6 K (−101,5 °C) Siedepunkt 239,11 K (−34,04 °C) Molares Volumen 22,1 · 10−3 m3/mol Verdampfungswärme 10,2 kJ/mol Schmelzwärme 3,203 kJ/mol Dampfdruck 3,67 · 106 Pa Schallgeschwindigkeit 206 m/s Spezifische Wärmekapazität 480 J/(kg · K) Wärmeleitfähigkeit 0,0089 W/(m · K) Chemisch Oxidationszustände ±1, 3, 4, 5, 6, 7 Oxide (Basizität) (stark sauer) Normalpotential 1,358 V (Cl + e− → Cl−) Elektronegativität 3,16 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 33Cl 2,511 s ε 5,583 33S 34Cl 1,5264 s ε 5,492 34S 34metaCl 32,0 min ε 5,638 34S IT 0,146 34Cl 35Cl 75,77 %
Stabil 36Cl 301.000 a β- 0,709 36Ar ε 1,142 36S 37Cl 24,23 %
Stabil 38Cl 37,24 min β- 4,917 38Ar 39Cl 55,6 min β- 3,442 39Ar 40Cl 1,35 min β- 7,480 40Ar 41Cl 38,4 s β- 5,730 41Ar NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [1] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 23-36/37/38-50 S: (1/2)-9-45-61 weitere Sicherheitshinweise MAK 1,5 mg/m3[2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Chlor (von griech. χλωρός chlōrós „hellgrün, frisch“; wegen der gelbgrünen Farbe des Chlorgases) ist ein chemisches Element mit dem Symbol Cl und der Ordnungszahl 17. Im Periodensystem der Elemente steht es in der 7. Hauptgruppe und gehört damit zu den Halogenen. Es liegt unter Normalbedingung in Form des zweiatomigen Moleküls Cl2 gasförmig vor, ist sehr reaktiv und sehr giftig. Chlor kommt wie alle anderen Halogene ausschließlich in gebundener Form vor.
Inhaltsverzeichnis
Geschichte
Elementares Chlor wurde erstmals 1774 von Carl Wilhelm Scheele dargestellt. Er ließ dabei Salzsäure mit Braunstein reagieren. Dabei erkannte er jedoch nicht, dass es sich bei dem dabei entstehenden Produkt um ein bisher unentdecktes Element handelt. Stattdessen wurde von den meisten Chemikern wie Antoine Laurent de Lavoisier angenommen, dass der Stoff mit Sauerstoff angereicherte Muriumsäure sei. Der Grund für diese Annahme lag darin, dass die Salzsäure für eine sauerstoffhaltige Säure eines hypothetischen Elementes, des Muriums, gehalten wurde. Durch den Kontakt mit dem Mangandioxid sollte diese dann weiteren Sauerstoff aufnehmen.[3] Dies wurde scheinbar von Marcelin Berthelot bestätigt, der beobachtete, dass Chlorwasser bei Belichtung Sauerstoff abgibt.[4]
Nachdem Versuche gescheitert waren Sauerstoff, etwa durch Erhitzen mit Kohlenstoff, aus der Verbindung abzuspalten, erkannte Humphry Davy 1808[5], dass es sich bei der Substanz um ein neues Element und nicht um eine sauerstoffhaltige Verbindung handelt. Er nannte das neue Element auf Grund seiner charakteristischen hellgrünen Farbe nach dem griechischen χλωρός chlōrós „hellgrün, frisch“ auf den Namen Chlor.[6]
Zunächst wurde Chlor überwiegend nach einem von Walter Weldon entwickelten Verfahren aus Salzsäure und Mangandioxid gewonnen. Da dies nicht sehr effektiv war, wurde es 1866 durch das von Henry Deacon entwickelte Deacon-Verfahren ersetzt. Dabei diente billiger Luftsauerstoff als Oxidationsmittel und Kupfer(II)-chlorid als Katalysator. Chlor wurde zwar schon 1800 erstmals elektrolytisch hergestellt, jedoch spielte dies bis zur Entwicklung der nötigen Generatoren durch Werner von Siemens Ende des 19. Jahrhunderts keine große Rolle. Seitdem sind elektrochemische Herstellungsverfahren die weitaus wichtigsten Produktionsverfahren von Chlor.[5]
Die historisch wichtigste Verwendung von Chlor liegt in der Anwendung als Bleichmittel. Dazu konnte es entweder elementar eingesetzt werden oder durch Reaktion mit Calciumhydroxid zu Chlorkalk weiterverarbeitet werden.[3]
Im Ersten Weltkrieg wurde Chlorgas erstmals als chemische Waffe eingesetzt. Der Einsatz am 22. April 1915 in der Nähe der Stadt Ypern in Flandern durch deutsche Truppen führte zu vielen Toten und zahlreichen, teilweise lebenslang geschädigten Soldaten. Bald wurde es jedoch durch wirksamere Giftgase ersetzt, zum Beispiel Phosgen.
Vorkommen
Chlor ist auf der Erde ein relativ häufiges Element. In der kontinentalen Erdkruste kommt es mit einem Gehalt von 145 ppm[7] vor und ist damit in der Häufigkeit hinter Elementen wie Zirconium, Kohlenstoff oder Schwefel an 19. Stelle. Auf Grund der hohen Reaktivität kommt es nur in Verbindungen, meist in Form von Chloriden, und nicht elementar vor.
Da Chloride in Wasser gut löslich sind, ist im Meerwasser der Ozeane eine hohe Konzentration an Chloridionen enthalten. Chlor ist mit einem Gehalt von 19,4 g/l[7] nach Sauerstoff und Wasserstoff das häufigste Element in Meerwasser. Hohe Gehalte an Chlorid haben viele abflusslose Seen, wie beispielsweise das Tote Meer, da bei diesen das von den Flüssen zugeführte Wasser verdampft und das mitgeführte Salz zurückbleibt.
Die wichtigsten Chlorminerale sind Halit (Natriumchlorid), häufig auch als Steinsalz oder einfach Salz bezeichnet, Sylvin (Kaliumchlorid) und Carnallit (KMgCl3 • 6 H2O). Diese kommen in großen Lagern vor, die häufig durch Austrocknung von Meeresteilen entstanden sind. Die Minerale kommen in Schichten vor, da die geringer löslichen Natriumsalze zunächst ausfallen und erst bei fortschreitender Austrocknung sich die Kaliumsalze bilden und sich daher über den Natriumsalzen ablagern. Größere Vorkommen an Halit findet man in Deutschland beispielsweise in Bad Friedrichshall und Bad Reichenhall, ein Vorkommen in Österreich findet sich bei Hallein. Eine Übersicht über Chlorminerale liefert die Kategorie:Chlormineral.
Es ist eine Vielzahl von natürlichen chlororganischen Verbindungen bekannt, im Februar 2002 lag die Anzahl an bekannten chlororganischen Verbindungen bei 2200.[8] Der größte Teil wird dabei von Meereslebewesen, wie Seetang, Schwämmen, Manteltieren oder Korallen synthetisiert. Auf dem Land lebende Tiere und Pflanzen bilden in deutlich geringerem Umfang chlororganische Verbindungen. Auch bei Vulkanausbrüchen und der Verbrennung von Biomasse entstehen chlororganische Verbindungen.[8]
Gewinnung und Darstellung
Chlor ist eine der wichtigsten Grundchemikalien und zählt mit einer Menge von 43,3 Millionen Tonnen im Jahr 2001[5] zu den meistproduzierten Chemikalien. Technisch wird Chlor fast ausschließlich durch verschiedene elektrochemische Verfahren hergestellt, im kleineren Maßstab kann es auch auf chemischen Weg gewonnen werden. Als Nebenprodukt fällt es bei der elektrochemischen Produktion von Natrium und Magnesium aus den entsprechenden Chloriden an.
Ausgangsstoff für die Chloralkalielektrolyse ist eine wässrige Natriumchloridlösung. Aus dieser werden in verschiedenen Verfahren, die sich im Aufbau der Elektrolysezelle unterscheiden, Chlor, Natronlauge und Wasserstoff erzeugt.
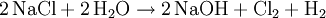
- Reaktionsgleichung für die Chloralkalielektrolyse
Wichtig bei allen Verfahren zur Chlorproduktion ist, dass die Anode, an der das Chlor entsteht, von der Kathode, an der Wasserstoff und Hydroxidionen gebildet werden, getrennt ist. Wären diese in einem Gefäß vereinigt, würde sich das explosive Chlor-Wasserstoff-Gemisch Chlorknallgas bilden, sowie eine Reaktion von Chlors mit den Hydroxidionen zu Hypochlorit stattfinden.
Das derzeit am häufigsten verwendete Verfahren ist das Diaphragmaverfahren (2001: 49 % Marktanteil[5]). Die Trennung der Elektrodenräume erfolgt dabei durch ein Diaphragma aus Asbest, durch das zwar Natriumionen, nicht jedoch Chlorid- und Hydroxidionen diffundieren können. Allerdings lässt sich mit diesem Verfahren nur eine niedrig konzentrierte und nicht reine Natronlauge, sowie mit Sauerstoff verunreinigtes Chlor erzeugen. Auch aus ökologischen Gründen ist es wegen des verwendeten krebserregenden Asbestes ungünstig. Deswegen wird es für neue Produktionsanlagen vom Membranverfahren abgelöst (2001: 28 % Marktanteil[5]). Dieses ist wegen der Verwendung einer Kunststoffmembran aus Nafion anstatt des Asbest-Diaphragmas ökologisch günstiger und bietet auch einige technische Vorteile. So ist durch die Membran eine bessere Trennung von Anoden- und Kathodenraum gegeben und ermöglicht damit die Produktion einer reineren und höher konzentrierten Natronlauge. Allerdings ist das Chlor wie beim Diaphragma-Verfahren durch Sauerstoff verunreinigt, der in einer Nebenreaktion an der Anode entsteht. Nachteile des Verfahrens sind die hohen Kosten für die Membranen und die nötigen hohen Reinheiten für die Ausgangssubstanzen.
Ein nur noch in geringem Maß eingesetztes Verfahren ist das Amalgamverfahren (2001: 18 % Marktanteil[5]). Bei diesem werden Anoden- und Kathodenraum vollkommen getrennt. Dazu wird eine Quecksilber-Kathode eingesetzt, die auf Grund der hohen Überspannung ermöglicht, dass anstatt Wasserstoff zunächst Natrium gebildet wird, das als Natriumamalgam vorliegt. Das Amalgam wird nun in einer zweiten Zelle an Graphitkontakten mit Wasser umgesetzt. Dabei bilden sich Quecksilber, Natronlauge und Wasserstoff. Diese räumliche Trennung ermöglicht sehr reine Produkte. Da Quecksilber stark toxisch und umweltgefährlich ist, wird dieses Verfahren jedoch nur noch wenig eingesetzt.
Es sind verschiedene Verfahren bekannt, mit denen durch chemische Oxidation aus Chlorwasserstoff Chlor hergestellt werden kann. Diese spielen für die Chlorproduktion nur eine geringe Rolle. Ein Beispiel ist das KEL-Verfahren, bei dem der Chlorwasserstoff mit Schwefelsäure und Nitrosylschwefelsäure umgesetzt wird. Nach Erprobung in einer Versuchsanlage wurde das Verfahren jedoch wegen Materialproblemen wieder eingestellt. Weitere Prozesse beruhen auf Kupfer(II)-chlorid- oder Chrom(III)-oxid-Katalysatoren.[5]
Eigenschaften
Physikalische Eigenschaften
Chlor ist bei Raumtemperatur ein gelbgrünes Gas, das mit einer Dichte von 3,214 g/l bei 0 °C etwa 2,5 mal so schwer wie Luft ist. Es kondensiert bei -34,06 °C zu einer gelben Flüssigkeit und erstarrt bei -101 °C.[9] Da der kritische Punkt mit 143,9 °C, 77,1 bar und 0,67 g/cm3 relativ hoch ist, lässt sich Chlor leicht unter Druck verflüssigen. So ist er bei einem Druck von 6,7 bar bei 20 °C flüssig und lässt sich in Stahlflaschen oder Kesselwagen transportieren.[9] Die Intensität der Farbe nimmt bei geringerer Temperatur ab, bei -195 °C ist Chlor fast farblos.[10]
Wie die anderen Halogene liegt auch Chlor als zweiatomiges Molekül vor. Der Abstand zwischen den Chloratomen beträgt 199 pm. Chlor hat mit 242 kJ/mol die höchste Dissoziationenthalpie aller Halogene.[11] Dies erkennt man auch an der Temperatur, bei der 1 % aller Halogenmoleküle dissoziiert sind, die bei Chlor 975 °C, bei Brom 775 °C und Iod 575 °C beträgt. Auch Fluor hat mit 765 °C eine niedrigere Temperatur.[12] Dass Chlor und nicht wie zu erwarten Fluor das Halogen mit der höchsten Dissoziationsenthalpie ist, liegt an der besonders kurzen Bindung des Fluors, bei der es zu Abstoßungen zwischen den freien Elektronenpaaren und damit zur Schwächung der Bindung kommt. Zwischen den weiter entfernten Chloratomen kommt es dagegen nicht zu einem solchen Effekt und daher trotz größerer Entfernung der Atome zu einer stärkeren Bindung.
Chlor kristallisiert im orthorhombischen Kristallsystem mit den Gitterkonstanten a = 6,24 Å, b = 4,48 Å und c = 8.26 Å.[13] Dabei sind die Chlor-Moleküle ebenso wie diejenigen von Iod und Brom in Schichten angeordnet. Jedes Atom eines Cl2-Moleküls ist dabei in einem Abstand von 3,34 Å schwach mit jeweils zwei weiteren Atomen anderer Moleküle assoziiert. Zwischen den Schichten sind die Abstände dagegen größer mit einem minimalen Abstand von 3,69 Å.[14] Dieser Schichtaufbau bedingt auch die plättchenförmige Gestalt und die leichte Spaltbarkeit von Chlorkristallen.[15]
Die Löslichkeit ist in verschiedenen Lösungsmitteln unterschiedlich ausgeprägt. In Wasser ist es unter teilweiser Dissoziation mäßig löslich, in einem Liter Wasser lassen sich etwa 2,3 Liter Chlor lösen.[4] Die entstandene Lösung wird als Chlorwasser bezeichnet. Dagegen löst es sich gut in flüssigen chlorhaltigen Verbindungen, etwa Dischwefeldichlorid, Siliciumtetrachlorid und organischen Chlorverbindungenn wie Chloroform. Auch in einigen organischen Lösungsmitteln wie Benzol, Essigsäure und Dimethylformamid lösen sich größere Mengen Chlor.[5]
Chemische Eigenschaften
Chlor zählt neben Fluor zu den reaktivsten Elementen und reagiert mit fast allen Elementen. Eine direkte Reaktion findet lediglich mit Sauerstoff, Stickstoff und den Edelgasen nicht statt. Viele Metalle, wie die Mangan, Zink oder die Edelmetalle Gold, Silber und Platin reagieren allerdings erst bei erhöhten Temperaturen mit Chlor. Eine wichtige Rolle spielt mitunter auch die Anwesenheit von Wasser, so reagieren Kupfer und Eisen mit vollkommen trockenem Chlor erst bei Temperaturen größer 200 °C, mit feuchtem Chlor dagegen schon bei deutlich niedrigeren Temperaturen.
Besonders stark ist die Neigung von Chlor zur Reaktion mit Wasserstoff. Nach einer nötigen Initiierung durch Spaltung eines ersten Chlormoleküls, die beispielsweise durch kurzwelliges blaues Licht ausgelöst werden kann, reagieren die Elemente in einer explosionsartig verlaufenden Kettenreaktion, der sogenannten Chlorknallgasreaktion. Durch die starke Neigung, Chlorwasserstoff zu bilden, reagiert Chlor auch mit anderen Wasserstoff enthaltenden Verbindungen wie Ammoniak, Ethin, Schwefelwasserstoff oder Wasser.
Isotope
Es sind insgesamt 23 Isotope und zwei weitere Kernisomere zwischen 28Cl und 51Cl bekannt. Von diesen sind zwei, die Isotope 37Cl und 39Cl stabil. Natürliches Chlor besteht zu 75,77 % aus 35Cl und zu 24,23 % aus 37Cl. Beide Kerne lassen sich mit Hilfe der NMR-Spektroskopie untersuchen. Mit einer Halbwertszeit von 301.000 Jahren ist 36Cl das langlebigste der sonst innerhalb von Minuten oder noch kürzeren Zeiten zerfallenden instabilen Isotope.[16]
36Cl entsteht in geringen Mengen durch Spallationsreaktionen von 40Ar und 36Ar mit kosmischer Strahlung in der Atmosphäre. Auch auf der Erdoberfläche kann 36Cl durch Neutronenadsorption, Reaktionen mit Myonen oder Spallation entstehen. Das Verhältnis von 36Cl zu 37Cl beträgt etwa 700 · 10-15:1. Durch die lange Halbwertszeit und konstante Atmosphärenkonzentration lässt sich die Konzentration an 36Cl zur Altersbestimmung für Grundwasser von bis zu einer Million Jahre nutzen. [17]
Die Konzentration an 36Cl war zwischen 1954 und 1963 durch im Meer stattfindende Kernwaffentests, bei denen im Meerwasser enthaltenes 35Cl Neutronenstrahlung adsorbiert und zu 36Cl reagiert, erhöht. Seit einem Vertrag zum Verbot dieser Art Tests nahm die Konzentration stetig ab und erreichte ab etwa 1980 die natürliche Verhältnis.[17]
Verwendung
Die hohe Reaktionsfreudigkeit und Wirkung von Chlor als Oxidationsmittel führte zum Einsatz als Bleichmittel, beispielsweise in der Papierindustrie. In dieser Rolle wird es wegen seiner Umweltschädlichkeit immer mehr durch Wasserstoffperoxid ersetzt. Nicht wegzudenken ist Chlor wegen seiner Reaktionsfähigkeit in der chemischen Industrie, wo es in Endprodukten wie z. B. PVC, Bleichmittel und Salzsäure anzutreffen ist. Chlor ist eine wichtige Grundchemikalie bei der Herstellung von Polyurethan und Polycarbonat.
Chlor wird als preiswertes Desinfektionsmittel für das Trinkwasser eingesetzt. Insbesondere die im Wasser entstehende hypochlorige Säure ist aufgrund ihrer Eigenschaft als starkes Oxidationsmittel wirksam gegen Mikroorganismen und Viren. Vorteilhaft gegenüber anderen Mitteln ist die so genannte Depot-Wirkung; d.h. nach der Zugabe im Wasserwerk wirkt Chlor auch im Rohrleitungsnetz noch über längere Zeit desinfizierend. Die Chlorung des Trinkwassers ist nach der DIN 2000 nicht vorgesehen, muss aber dennoch in den Wasserwerken vorgehalten werden. Eine Chlorung darf nur durch das Gesundheitsamt angeordnet werden. Außerdem verwenden die meisten Schwimmbäder es in sehr kleiner Dosierung als Desinfektionsmittel für ihr Badewasser. Durch die Reaktion von Chlor mit organischen Stoffen im Beckenwasser entstehen Abfallprodukte, diese machen den bekannten Schwimmbadgeruch aus: je mehr Verunreinigungen sich im Wasser befinden, desto mehr Geruchswahrnehmung entsteht für den Badbesucher.
Biologische Bedeutung
Physiologisch besitzt Chlor in seiner ionischen Form von Chlorid als Mineralstoff eine große Bedeutung. Aufgenommen wird es über die Nahrung überwiegend in Form von Kochsalz (Natriumchlorid). Tagtäglich nimmt man zwischen 3 und 12 g Chlorid zu sich. Die Ausscheidung erfolgt über die Nieren und im Schweiß.
Chlorid ist notwendig zur Produktion von Magensäure und zur Aufrechterhaltung der Osmose im Organismus. Es ist auch unentbehrlich für die Impulsleitung in den Nervenfasern. Viele organische und somit nicht-ionische Chlorverbindungen sind hingegen gesundheitsschädlich oder giftig, insbesondere für Insekten. Sie werden deshalb als Insektizide eingesetzt.
Nachweis
Chlor lässt sich nach Einleitung in Natriumiodid- oder -bromidlösung nachweisen, da es das Iodid zu Iod, beziehungsweise das Bromid zu Brom, oxidiert, welches mit Hexan extrahiert werden kann.
Chlorid kann in wässriger Lösung durch Zugabe von Silbernitrat-Lösung als weißes Silberchlorid (AgCl) nachgewiesen werden (siehe hierzu Nachweise für Chloridsalze).
Sicherheitshinweise
Gefährliche Reaktionen u. a. mit Ammoniak, Halogenwasserstoffen, Butadien, Butan, Buten, Ether, Kohlenmonoxid, Methan, Propan, Schwefeldioxid und Wasserstoff sind möglich.
Mit der Feuchtigkeit der Schleimhäute erfolgt Bildung von hypochloriger Säure und Salzsäure, die das Gewebe angreifen. Die Inhalation führt je nach Konzentration zu Reizung der Schleimhäute, Husten, bei längerer Einwirkung auch zu Bluthusten und Atemnot, sowie Erstickungserscheinungen. Bei Inhalation großer Mengen besteht Lebensgefahr. Flüssiges Chlor wirkt stark ätzend auf die Haut.
Gesundheitsgefährdung
Chlorgas ist giftig beim Einatmen. Die LD50 [18] liegt zwischen 293 ml/m³ (Ratte) bzw. 137 ml/m³ (Maus, jeweils 1 h Exposition). Bereits ab 3-6 ml/m³ wirkt es sehr stark reizend auf die Atemwege, aber auch auf Augen, Haut und die Verdauungswege. Lungenschäden, bei chronischer Einwirkung auch Herz- und Kreislaufschäden sind auch nach anfänglicher Beschwerdefreiheit möglich. Flüssiges Chlor wirkt auf die Haut stark ätzend. Als Spätfolgen nach schweren Verfgiftungen können Degradationsveränderungen der Lunge, Emphysen u.ä. auftreten.
Der maximale Arbeitsplatzgrenzwert in Deutschland (TRGS 900, Luftgrenzwert) liegt zurzeit bei 0,5 ml/m³ bzw. 1,5 mg pro Kubikmeter Luft.
Eine spanische Studie kam zu dem Ergebnis, dass chloriertes Wasser das Risiko für Blasenkrebs erhöhe. Demnach haben Menschen, die chloriertes Wasser tranken, ein um 35 Prozent erhöhtes Risiko auf Blasenkrebs. Schwimmen im Chlorwasser steigere die Gefahr sogar um 57 Prozent.[19]
Verbindungen
Chlor kommt mit Oxidationszahlen von −1 bis +7 vor. In der Oxidationsstufe −1 ist Chlor als Chlorid-Anion in vielen Salzen, v.A. der Alkalimetalle enthalten. Beispiele sind Natriumchlorid, Kaliumchlorid und Lithiumchlorid. Die wichtigste Cl−1-Verbindung ist aber Chlorwasserstoff HCl und die wässrige Lösung davon, die Salzsäure als eine der wichtigsten Säuren.
Verbindungen der Oxidationsstufen +1, +3, +5 und +7 gibt es v.a. als Chlorsauerstoffsäuren. Die sind mit Oxidationsstufe +1 die Hypochlorige Säure HClO mit ihren Salzen wie Natriumhypochlorit. Mit steigender Oxidationsstufe folgen die Chlorige Säure HClO2, die Chlorsäure HClO3 und die Perchlorsäure HClO4. Diese ist die stärkste dieser Säuren und als einzige Chlorsauerstoffsäure rein beständig, aber dennoch explosiv. Die anderen sind nur als Lösung oder Salz stabil.
Chlor spielt auch eine große Rolle für die organische Chemie .
Bsp. für Chlororganische Verbindungen sind
Siehe auch
Einzelnachweise
- ↑ Eintrag zu CAS-Nr. 7782-50-5 im European chemical Substances Information System ESIS
- ↑ Sicherheitsdatenblatt (Air Liquide)
- ↑ a b William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Wiesbaden 1997, S. 74, ISBN 3-528-06645-8.
- ↑ a b Chlor. In: Römpp Chemie-Lexikon, Thieme Verlag, 2008 (online)
- ↑ a b c d e f g h Peter Schmittinger et. al.: Chlorine. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2006. ISBN 978-3527303854
- ↑ George Porter: Chlorine – An Introduction. In: Pure a. Appl. Chem., 1996, 68, 9, S. 1683–1687. doi:10.1351/pac199668091683
- ↑ a b David R. Lide (ed.): CRC Handbook of Chemistry and Physics, 85. Auflage, CRC Press, Boca Raton, Florida, 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea.
- ↑ a b Gordon W. Gribble: The diversity of naturally produced organohalogens. In: Chemosphere, 2003, 52, S. 289–297, doi:10.1016/S0045-6535(03)00207-8.
- ↑ a b Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, S. 436, ISBN 978-3-11-017770-1.
- ↑ Th. M. Klapötke, I. C. Tornieporth-Oetting: Nichtmetallchemie. Wiley-VCH, Weinheim 1994, S. 397, ISBN 3-527-29052-4.
- ↑ Peter W. Atkins, Julio de Paula: Physikalische Chemie, 4. Auflage, Wiley-VCH, Weinheim 2006, S. 1122, ISBN 978-3-527-31546-8.
- ↑ Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, Wiley-VCH, Weinheim 1988, S. 1035, ISBN 3-527-26169-9.
- ↑ Robert L. Collin: The crystal structure of solid chlorine: correction. In: Acta Cryst., 1956, 9, S. 537, doi:10.1107/S0365110X56001467
- ↑ Robert L. Collin: The crystal structure of solid chlorine. In: Acta Cryst., 1952, 5, S. 431-432, doi:10.1107/S0365110X52001295.
- ↑ Ulrich Müller: Anorganische Strukturchemie. 6. Auflage, Teubner, Stuttgart 2008, S. 153, ISBN 978-3-8348-0626-0.
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties, in: Nuclear Physics, 2003, Bd. A 729, S. 3–128.
- ↑ a b Chlor bei SAHRA, Arizona Board of Regents, 2005 (engl., eingesehen am 14.2.2009).
- ↑ EG-Sicherheitsdatenblatt gemäß TRGS 220
- ↑ Cristina M. Villanueva et al.: Bladder Cancer and Exposure to Water Disinfection By-Products through Ingestion, Bathing, Showering, and Swimming in Pools. In: Am. J. Epidemiol. Bd. 165, Nr. 2, 2007, ISSN 0002-9262, S. 148–156. doi:10.1093/aje/kwj364
Weblinks
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.