- Na+
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Natrium, Na, 11 Serie Alkalimetalle Gruppe, Periode, Block 1, 3, s Aussehen silbrig weiß CAS-Nummer 7440-23-5 Massenanteil an der Erdhülle 2,7[1] % Atomar [2] Atommasse 22,989770 u Atomradius (berechnet) 180 (190) pm Kovalenter Radius 154 pm Van-der-Waals-Radius 227 pm Elektronenkonfiguration [Ne] 3s1 Elektronen pro Energieniveau 2, 8, 1 1. Ionisierungsenergie 495,8 kJ/mol Physikalisch [2] Aggregatzustand fest Kristallstruktur kubisch raumzentriert Dichte 0,968 g/cm3 Mohshärte 0,5 Magnetismus paramagnetisch Schmelzpunkt 370,87 K (97,72 °C) Siedepunkt 1156 K (883 °C) Molares Volumen 23,78 · 10−6 m3/mol Verdampfungswärme 97,7 kJ/mol Schmelzwärme 2,60 kJ/mol Dampfdruck 1 Pa bei 554 [3] K Schallgeschwindigkeit 3200 m/s bei 293,15 K Spezifische Wärmekapazität 1230 J/(kg · K) Elektrische Leitfähigkeit 21 · 106 A/(V · m) Wärmeleitfähigkeit 140 W/(m · K) Chemisch [2] Oxidationszustände 1 Oxide (Basizität) Na2O (stark basisch) Normalpotential −2,713 V (Na++ e− → Na) Elektronegativität 0,93 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 21Na 22,49 s ε 3,547 21Ne 22Na 2,602 a ε 2,842 22Ne 23Na 100 %
Stabil 24Na 14,959 h β− 5,516 24Mg 25Na 59,1 s β− 3,835 25Mg NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 

Leicht-
entzündlichÄtzend (F) (C) R- und S-Sätze R: 14/15-34 S: (1/2)-5-8-43-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Natrium ist ein häufig vorkommendes chemisches Element mit dem Symbol Na und der Ordnungszahl 11. Im Periodensystem der Elemente steht es in der 3. Periode und als Alkalimetall in der 1. Gruppe beziehungsweise 1. Hauptgruppe. Natrium ist ein Reinelement, dessen einziges stabiles Isotop 23Na ist.
Elementares Natrium wurde erstmals 1807 von Humphry Davy durch Schmelzflusselektrolyse aus Natriumhydroxid gewonnen und nach seinem Vorkommen in Soda Sodium genannt. Diese Bezeichnung wird u. a. im englischen und französischen Sprachraum verwendet, Ableitungen hiervon in den romanischen und zum Teil auch in slawischen Sprachen. Der deutsche Name „Natrium“ ist über das arabische „natrun“, „Natron“, vom ägyptischen „netjerj“ abgeleitet. Natrium und Ableitungen hiervon sind außer in Deutschland u. a. auch in Skandinavien und einigen slawischen Sprachen in Verwendung.
Unter Normalbedingungen ist Natrium ein wachsweiches, silberglänzendes und hochreaktives Metall. Wegen seiner Reaktionsfreudigkeit wird metallisches (elementares) Natrium unter inerten Bedingungen gelagert, meistens in Paraffinöl oder Petroleum.
Natrium gehört zu den zehn häufigsten Elementen in der Erdhülle und kommt dabei in zahlreichen natriumhaltigen Mineralen im Land- und Meeresboden vor. Auch in den Ozeanen ist eine erhebliche Menge Natrium gelöst.
Inhaltsverzeichnis
Geschichte
Die Ägypter prägten in der Antike für das aus Sodaseen gewonnene Soda den Begriff netjerj (neter). Die Griechen übernahmen dieses Wort als griech. νίτρον = nitron, die Römer als nitrium, die Araber als natrun.[5] Natriumverbindungen sind im Gegensatz zum elementaren Metall schon sehr lange bekannt und wurden seither aus Meerwasser oder Seen gewonnen, aus Erdlagerstätten abgebaut und gehandelt. Die wichtigste Natriumverbindung Kochsalz (Natriumchlorid) wurde in Bergwerken oder durch Trocknen von Meerwasser oder salzhaltigem Quellwasser in Salinen gewonnen. Der Handel mit Salz war für viele Städte die Grundlage ihres Reichtums, und prägte teils sogar ihren Namen (Salzgitter, Salzburg). Auf den keltischen Namen für Saline (Hall) weisen Ortsnamen wie Hallstatt, Hallein, Halle (Saale), Bad Hall, Schwäbisch Hall oder Hall in Tirol hin. Auch andere natürlich vorkommende Natriumverbindungen wie Natriumcarbonat (Soda oder Natron) und Natronsalpeter wurden seit der Antike gewonnen und gehandelt.
Die Herstellung von elementarem Natrium gelang erst im Jahre 1807 Humphry Davy durch Elektrolyse von geschmolzenem Natriumhydroxid (Ätznatron) unter Verwendung von Voltaschen Säulen als Stromquelle. Wie er am 19. November 1807 vor der Royal Society in London berichtete, gewann er zwei verschiedene Metalle: das in Soda enthaltene Natrium nannte er Sodium, was die noch heute gebräuchliche Bezeichnung des Metalls im französischen und englischsprachigen Raum ist; das andere Metall nannte er Potassium (Kalium). Berzelius schlug 1811 den heutigen Namen Natrium vor[5].
Vorkommen
Im Universum steht Natrium in der Häufigkeit an 14. Stelle[6], vergleichbar mit Calcium und Nickel. Im ausgestrahlten Licht vieler Himmelskörper, auch dem der Sonne, kann die gelbe Natrium-D-Linie gut nachgewiesen werden. Die Intensität dieser Strahlung im Spektrum des Sonnenlichts hat im Laufe der Evolution dazu geführt, dass sich das Empfindlichkeitsmaximum unserer Augen auf diese Farbe eingestellt hat.
Auf der Erde ist Natrium mit einem Anteil an der Erdkruste von 2,36 %[7] das sechsthäufigste Element. Es kommt aufgrund seiner Reaktivität nicht elementar, sondern stets in Verbindungen, den Natrium-Salzen vor. Ein großer Speicher von Natrium ist das Meerwasser. Ein Liter Meerwasser enthält durchschnittlich 11 Gramm Natriumionen.[1]
Häufige Natriumminerale sind Albit, auch Natronfeldspat genannt, NaAlSi3O8 und Oligoklas (Na,Ca)Al(Si,Al)3O8. Neben diesen gesteinsbildenden Mineralen, die zu den Feldspaten zählen, kommt Natrium in großen Salzlagerstätten vor. Es existieren vor allem große Lagerstätten an Halit (Natriumchlorid, umgangssprachlich häufig Steinsalz genannt), die durch das Austrocknen von Meeresteilen entstanden sind. Diese stellen die wichtigste Quelle zur Gewinnung von Natrium und seinen Verbindungen dar. Bekannte deutsche Salzförderstätten sind unter anderem Salzgitter, Bad Reichenhall, Stade und Bad Friedrichshall.
Neben Natriumchlorid kommen auch andere Natriumsalze in der Natur vor. So ist Natriumnitrat oder Natronsalpeter (auch Chilesalpeter genannt) NaNO3 eines der wenigen natürlichen Nitratminerale. Es kommt wegen seiner guten Wasserlöslichkeit aber nur in der besonders trockenen Gegenden, wie der Atacamawüste in Chile vor. Vor Erfindung des Haber-Bosch-Verfahrens war dies der wichtigste Rohstoff für viele Düngemittel und Sprengstoffe.
Natriumcarbonat Na2CO3 wird ebenfalls natürlich in mehreren Mineralen gefunden. Das bekannteste Mineral ist Soda Na2CO3 · 10 H2O. Es wird in großen Mengen abgebaut und vor allem in der Glasherstellung verwendet.
Daneben existieren noch eine Vielzahl weiterer Natriummineralen (siehe auch: Kategorie:Natriummineral). Ein bekanntes ist der Kryolith (Eisstein, Na3[AlF6]), der in geschmolzenem Zustand als Lösungsmittel für Aluminiumoxid bei der Aluminiumherstellung dient. Da das einzige bekannte Kryolith-Vorkommen in Grönland abgebaut ist, wird Kryolith heute künstlich hergestellt.
Gewinnung und Darstellung
Natrium wird hauptsächlich aus Natriumchlorid gewonnen, welches meist bergmännisch oder durch Austrocknung salzhaltiger Lösungen wie dem Meerwasser erhalten wird. Nur ein kleiner Teil des Natriumchlorids wird zu elementarem Natrium weiterverarbeitet, der größte Teil wird als Speisesalz oder für die Herstellung anderer Natriumverbindungen verwendet.
Die großtechnische Herstellung von Natrium erfolgt heute durch Schmelzflusselektrolyse von trockenem Natriumchlorid in einer sogenannten Downs-Zelle. Zur Schmelzpunkterniedrigung wird ein eutektisches Salzgemisch aus 60 % Calciumchlorid und 40 % Natriumchlorid eingesetzt, das bei 580 °C schmilzt. Auch Bariumchlorid ist als Zusatz möglich. Es wird eine Spannung von etwa sieben Volt[1] angelegt. Für die Herstellung von einem Kilogramm Natrium werden während der Elektrolyse etwa 10 kWh Strom verbraucht, im gesamten Produktionsprozess etwa 12 kWh.[8]
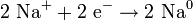
- Bildung von Natrium an der Kathode
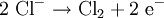
- Bildung von Chlor an der Anode

- Gesamtreaktion
Die zylindrische Elektrolysezelle besteht aus einer mittigen Graphitanode und einem seitlichen Kathodenring aus Eisen. Oberhalb der Zelle ist eine Glocke, die das entstandene Chlor sammelt und abführt. Das Natrium sammelt sich oberhalb der Kathoden und wird durch ein gekühltes Steigrohr aus der Zelle entfernt. Ebenfalls entstandenes Calcium kristallisiert dort aus und fällt in die Schmelze zurück.
Die Elektrolyse von Natriumchlorid löste das Castner-Verfahren ab. Dabei wurde das Natrium durch Schmelzflusselektrolyse von Natriumhydroxid gewonnen. Dieses hatte zwar den Vorteil des geringeren Schmelzpunktes von Natriumhydroxid (318 °C), es wird aber mehr elektrische Energie benötigt. Seit Einführung der Chlor-Alkali-Schmelzfluss-Elektrolyse hat sich der Preis für Natrium drastisch verringert. Damit ist Natrium volumenbezogen das preiswerteste Leichtmetall überhaupt. Der Preis hängt allerdings stark von den Stromkosten und dem Preis für das ebenfalls entstehende Chlor ab.
Eigenschaften
Physikalische Eigenschaften
Natrium ist ein silberweißes, weiches Leichtmetall. In vielen Eigenschaften steht es zwischen Lithium und Kalium. So liegt der Schmelzpunkt mit 97,82 °C zwischen dem des Lithiums (180,54 °C) und dem des Kaliums (63,6 °C).[1] Ähnlich ist dies beim Siedepunkt und der spezifischen Wärmekapazität. Mit einer Dichte von 0,968 g · cm−3[1] ist Natrium eines der spezifisch leichtesten Elemente. Von den bei Raumtemperatur festen Elementen haben nur noch Lithium und Kalium eine geringere Dichte. Mit einer Mohshärte von 0,5[10] ist Natrium so weich, dass es mit dem Messer zu schneiden ist.
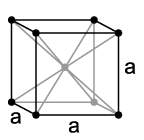
Natrium kristallisiert, wie die anderen Alkalimetalle, im kubischen Kristallsystem in einem raumzentrierten Gitter mit der Raumgruppe
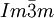 und zwei Formeleinheiten pro Elementarzelle. Unterhalb von 51 K geht es in eine hexagonal dichteste Kugelpackung mit den Gitterparametern a = 376 pm und c = 615 pm über[9].
und zwei Formeleinheiten pro Elementarzelle. Unterhalb von 51 K geht es in eine hexagonal dichteste Kugelpackung mit den Gitterparametern a = 376 pm und c = 615 pm über[9].Natriumdampf besteht sowohl aus einzelnen Metallatomen, als auch aus Dimeren der Form Na2. Am Siedepunkt liegen 16 %[1] der Atome als Dimer vor. Die Bindungslänge der Natrium-Natrium-Bindung liegt bei 371,6 pm.[10] Der Dampf ist gelb und erscheint in der Durchsicht purpurfarben.
Chemische Eigenschaften
Wie die anderen Alkalimetalle ist Natrium ein sehr unedles Element (Normalpotential: −2,71 V[1]) und reagiert leicht mit vielen anderen Elementen und zum Teil auch mit Verbindungen. Die Reaktionen sind vor allem mit Nichtmetallen, wie Chlor oder Schwefel, sehr heftig und laufen unter leuchtend gelber Flammenerscheinung ab.
Der ansonsten reaktive Sauerstoff stellt eine Besonderheit dar. Natrium und Sauerstoff reagieren ohne Anwesenheit von Wasser bei Raumtemperatur und auch beim Erwärmen nicht direkt miteinander. Unter einer vollkommen wasserfreien Sauerstoff-Atmosphäre kann Natrium sogar geschmolzen werden, ohne dass es zur Reaktion kommt. Sind dagegen Feuchtigkeitsspuren vorhanden, verbrennt es leicht zu Natriumperoxid.
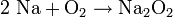
- Reaktion von Natrium mit Sauerstoff
Mit Wasser reagiert Natrium unter Bildung von Wasserstoff zu Natriumhydroxid. In Alkoholen setzt sich Natrium unter Bildung von Wasserstoff zu Natrium-Alkoholaten um. Durch die hohe Reaktionswärme schmilzt es häufig auf. Bei feiner Verteilung des Natriums und der damit einhergehenden großen Reaktionsoberfläche kann die Reaktion explosiv sein und den Wasserstoff entzünden. Kommt Natrium mit chlorierten Verbindungen wie Dichlormethan, Chloroform, Tetrachlormethan in Kontakt, kommt es unter Bildung von Natriumchlorid zu einer schnellen und exothermen Reaktion.
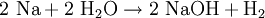
- Reaktion von Natrium mit Wasser
Natrium löst sich mit blauer Färbung in flüssigem Ammoniak. Die Farbe beruht auf freie Elektronen, die vom Natrium in die Lösung abgegenben werden. So leitet die Lösung auch elektrischen Strom und ist verdünnt paramagnetisch.
Isotope
Von Natrium sind insgesamt 15 Isotope und 2 weitere Kernisomere von 18Na bis 33Na bekannt.[11] Von diesen kommt nur eines, das Isotop 23Na natürlich vor. Damit ist Natrium eines von 22 Reinelementen. Die langlebigsten künstlichen Isotope sind 22Na, das mit einer Halbwertszeit von 2,602 Jahren[11] unter Betazerfall in 22Ne übergeht und 24Na, das mit einer Halbwertszeit von 14.959 Stunden[11] ebenfalls unter Betazerfall zu 24Mg zerfällt. Diese werden als Tracer in der Nuklearmedizin verwendet. Alle anderen Isotope und Isomere haben nur kurze Halbwertszeiten von Sekunden oder Millisekunden.
Verwendung
Es werden große Mengen Natriumchlorid und anderer Natriumverbindungen, wie Natriumcarbonat, gefördert. Davon wird aber nur ein sehr kleiner Teil zu Natrium weiterverarbeitet. Der größte Teil wird direkt verwendet oder zu anderen Verbindungen umgesetzt. Über Verwendungsmöglichkeiten von Natriumverbindungen: siehe Abschnitt Verbindungen.
Natrium ist das meistgebrauchte Alkalimetall. Es wird für diverse Zwecke sowohl technisch als auch im Labor eingesetzt. Aus einem Teil des Natriums wird eine Anzahl von Natriumverbindungen hergestellt. Dies sind beispielsweise das als Bleichmittel verwendete Natriumperoxid und die starke Base Natriumamid. Diese kommen nicht natürlich vor und können auch nicht direkt aus Natriumchlorid gewonnen werden. Auch Natriumcyanid und Natriumhydrid werden aus Natrium hergestellt.
Katalysator
Natrium katalysiert die Polymerisation von 1,3-Butadien und Isopren. Daher wurde es für die Produktion von künstlichen Kautschuk eingesetzt.[12] Mit Natrium als Katalysator gewonnener Kunststoff, der als Buna bezeichnet wurde, war das erste künstliche Gummi der Welt. Ab 1937 wurde er in den Buna-Werken (benannt nach Butadien und Natrium) in Schkopau produziert.[13]
Kühlmittel
Da Natrium gute Wärmeübertragungseigenschaften, einen niedrigen Schmelzpunkt mit gleichzeitig großem flüssigen Bereich besitzt, wird es auch als Kühlmittel verwendet:
In großem Umfang wird das Element in Verbrennungsmotoren zur Kühlung der thermisch hoch beanspruchten Auslassventile eingesetzt, wo die Natriumfüllung der Ventilschäfte zu einer besseren Wärmeableitung führt. Die Wärmeleitfähigkeit λ von Natrium ist mit 140 W/m·K mehr als doppelt so hoch wie die von Stahl mit ca. 50 W/m·K
In Brutreaktoren werden die bei der Kernspaltung entstehenden schnellen Neutronen nicht wie in anderen Reaktortypen abgebremst. Es darf zur Kühlung kein Wasser, das als Bremsmittel (Moderator) wirkt, anwesend sein. Daher wird Natrium verwendet[14].
Lichterzeugung
Natriumdampflampen nutzen das charakteristische gelbe Licht aus, das Natriumdampf bei einer elektrischen Entladung aussendet. Sie werden aufgrund ihrer hohen Lichtausbeute häufig zur Straßenbeleuchtung eingesetzt.
Reduktionsmittel
Einige Metalle, wie Titan, Zirconium, Tantal oder Uran können nicht durch Reduktion mit Kohlenstoff gewonnen werden, weil dabei stabile und nicht abtrennbare Carbide entstehen. Neben einigen anderen Elementen, insbesondere Aluminium und Magnesium, wird daher Natrium als Reduktionsmittel eingesetzt. Ein weiteres Element, zu dessen Darstellung Natrium eingesetzt wird, ist Kalium. Da Kalium ein sehr unedles Element ist, kann es nicht durch Reduktion mit Kohlenstoff gewonnen werden. Eine theoretisch mögliche Herstellung durch Elektrolyse ist technisch auf Grund der guten Löslichkeit von Kalium in einer Kaliumchloridschmelze nicht möglich.
Natrium spielt eine wichtige Rolle als Reduktionsmittel in der organischen Synthese. Über lange Zeit war die technisch wichtigste Natriumanwendung die Herstellung von Tetraethylblei aus Chlorethan. Dieses war ein wichtiges Antiklopfmittel, das dem Benzin beigemischt wurde. Aus Umweltschutzgründen wurde die Verwendung von Tetraethylblei stark eingeschränkt oder ganz verboten. Daher ging auch der Verbrauch an Natrium zurück. Auch in anderen Reaktionen wie der Birch-Reduktion wird Natrium verwendet.[15] Diese sind jedoch eher im Labormaßstab von Interesse.
Trocknungsmittel
Da das Metall mit Spuren von Wasser reagiert, wird es als Trocknungsmittel für organische Lösungsmittel, wie Diethylether oder Toluol genutzt. Dagegen dürfen halogenhaltige Lösungsmittel wegen der Reaktion von Natrium mit ihnen nicht auf diese Weise getrocknet werden.
Natrium-Kalium-Legierungen sind bei Raumtemperatur flüssig. Diese dienen zur Wärmeübertragung sowie zur Dehalogenierung in der organischen Synthese. Na-K eignet sich auch gut zum Trocknen einiger bereits gut vorgetrockneter Lösungsmittel, um besonders niedrige Rest-Wassergehalte zu erreichen.
Nachweis
Der qualitative Nachweis und die quantitative Bestimmung erfolgen atomspektroskopisch durch die intensiv gelbe Flammenfärbung oder genauer über die Na-Doppellinie bei 588,99 nm und 589,59 nm.
Der Nachweis von Natrium auf rein chemischem Weg ist sehr schwierig. Da fast alle Natriumverbindungen gut wasserlöslich sind, sind klassische Fällungsreaktionen und gravimetrische Bestimmungen kaum möglich. Ausnahmen bilden das gelbe Natriummagnesiumuranylacetat[16] NaMg(UO2)3(CH3COO)9·9 H2O und das farblose Natriumhexahydroxoantimonat Na[Sb(OH)6], die beide schwerlöslich sind.[17]Auch Farbreaktionen sind schwierig, da Natriumionen in wässriger Lösung farblos sind. Von praktischer Bedeutung sind heute daher neben der Ionenchromatographie nur noch die spektroskopischen Methoden.
Physiologie
Natrium ist eines der Elemente, die für alle tierischen Organismen essentiell sind. Im tierischen Organismus ist Natrium – zusammen mit Chlor – das neunthäufigste Element und stellt – nach Calcium und Kalium – das dritthäufigste anorganische Ion. Damit zählt es physiologisch zu den Mengenelementen. Natrium liegt in Lebewesen in Form von Na+-Ionen vor. Im menschlichen Körper sind bei einem durchschnittlichem Körpergewicht von 70 kg etwa 100 g Natrium als Na+-Ionen enthalten.[18] Der Mensch sollte pro Tag etwa 1–3 g Natrium (entspricht etwa 5 g Natriumchlorid) zu sich nehmen[18].
Verteilung im Organismus
Im Organismus sind die Na+-Ionen nicht gleichmäßig verteilt, vielmehr sind – wie die anderen Ionen auch – die Konzentrationen inner- und außerhalb von Zellen stark verschieden. Diese Konzentrationsgefälle von Na+-, K+- und Cl−-Ionen sowie organischer Anionen bedingen den Großteil des Membranpotentials lebender Zellen. Das Membranpotential und die Ionengradienten sind für die meisten Zellen überlebenswichtig. Da die Ionen beständig bestrebt sind, das Konzentrationsgefälle auszugleichen, bedarf es eines aktiven Prozesses, der dem entgegensteuert. Die wichtigste Rolle spielt dabei die Natrium-Kalium-Pumpe, die Na+- und K+-Ionen unter Energieverbrauch zurückpumpt.[19]
Regulation des Natriumhaushalts
Der Natriumgehalt wird streng kontrolliert, schwankt kaum und ist eng verbunden mit der Regulation des Wasserhaushalts. Die normale Natriumkonzentration im Serum liegt bei etwa 135-145 mmol/l. Ist der Natriumspiegel geringer wird von einer Hyponatriämie gesprochen, bei der es zu einer Steigerung des Zellvolumens kommt. Bei einer Hypernatriämie dagegen ist der Natriumspiegel zu hoch und die Zellen schrumpfen. In beiden Fällen wird vor allem die Funktion des Gehirns beeinträchtigt. Es kann zu epileptischen Anfällen und Bewusstseinsstörungen bis hin zum Koma kommen. Eine wichtige Rolle für die Regulation spielen das Renin-Angiotensin-Aldosteron-System, das Adiuretin und Atriopeptin.[20]
Funktionen in Nervenzellen
Na+-Ionen spielen eine wichtige Rolle bei der Entstehung und Weiterleitung von Erregung in Nervenzellen. An der Postsynapse von Nervenzellen und an der neuromuskulären Endplatte befinden sich bestimmte ligandengesteuerte Rezeptoren (z. B.: nicotinische Acetylcholinrezeptoren oder AMPA-Rezeptoren), die sich nach ihrer Aktivierung öffnen und für Natriumionen durchlässig werden. Dadurch kommt es zu einer lokalen Änderung des im Grundzustand stabilen Membranpotentials der Nervenzelle. Das Innere der Zelle wird gegenüber dem Äußeren weniger negativ, man spricht von einer Depolarisation. Ist diese Depolarisation stark genug, kommt es zur Öffnung eines weiteren Typs von Natriumkanal. Dabei handelt es sich um spannungsabhängige Natriumkanäle, die die örtliche Depolarisation – gemeinsam mit anderen Ionenkanälen – durch einen bestimmten Öffnungs- und Schließrhythmus weiterleiten. In Axonen von Nervenzellen entsteht so ein Aktionspotential. Bei der Wiederherstellung des Grundzustandes spielt wiederum die Natrium-Kalium-Pumpe eine essentielle Rolle.[19]
Natrium bei Pflanzen
Bei Pflanzen spielt Natrium hingegen eine untergeordnete Rolle. Während Kalium für alle Pflanzen und die meisten Mikroorganismen essentiell ist, wird Natrium nur von einigen C4- und CAM-Pflanzen benötigt, von C3-Pflanzen in der Regel jedoch nicht. Halophyten sind Pflanzen, die in der Lage sind, bei hohen Salzkonzentrationen in ihrer Umgebung zu wachsen. Jedoch ist ihr Stoffwechsel nicht unbedingt auf das Salz angewiesen, vielmehr benötigen sie Na+ und Cl− als osmotisch wirksame Ionen.[21]
Da die meisten Pflanzen Natrium nur in geringen Mengen enthalten, müssen viele Pflanzenfresser zusätzliches Natriumchlorid aus natürlichen Salzvorkommen aufnehmen.
Sicherheitshinweise
Kleinere Mengen Natrium werden unter Petroleum aufbewahrt. Für größere Mengen gibt es integrierte Handhabungssysteme mit Schutzgasatmosphäre. Das Natrium ist trotz Schutzgas oder Petroleum häufig von einer Schicht aus NaOH und Na2O überzogen.
Natriumbrände lassen sich mit Metallbrandpulver (Kochsalz), Kaliumchlorid, Grauguss-Spänen, behelfsweise mit Sand oder trockenem Zement löschen. Sand und Zement reagieren jedoch in gewissem Rahmen mit Natrium, was die Löschwirkung mindert. Keinesfalls dürfen Wasser, Schaum, Löschpulver, Kohlenstoffdioxid oder Halone verwendet werden. Diese Löschmittel reagieren mit Natrium zum Teil stark exotherm, was gegebenenfalls zu stärkeren Bränden und Explosionen führen kann.
Verbindungen
In Verbindungen kommt das Natrium ausschließlich in der Oxidationsstufe +1 vor. Alle Verbindungen weisen einen stark ionischen Charakter auf, fast alle sind gut wasserlöslich. Natriumverbindungen zählen zu den wichtigsten Salzen vieler Säuren. Industriell werden meist Natriumsalze zur Gewinnung der entsprechenden Anionen verwendet, da deren Synthese kostengünstig ist.
Hydride
Natriumhydrid NaH und Natriumborhydrid NaBH4 sind starke Reduktionsmittel. In ihnen liegt der Wasserstoff in der Oxidationsstufe −1 vor. Beide werden vorwiegend in der organischen Chemie als Reduktions- und Hydrierungsmittel verwendet. Wenn sie mit Wasser in Berührung kommen, entsteht gasförmiger Wasserstoff H2.
Halogenverbindungen
Natriumchlorid (NaCl), häufig als Speisesalz oder Kochsalz bezeichnet, ist das wichtigste und bekannteste Natriumsalz. Da es in großen Mengen vorkommt, ist es der wichtigste Rohstoff für die Gewinnung von Natrium und anderen Natriumverbindungen. Natriumchlorid stellt auch für den Menschen die wichtigste Natriumquelle dar. Technisch wird es unter anderem zur Konservierung von Lebensmitteln und als Streusalz im Straßenverkehr genutzt. Es ist Namensgeber für die Natriumchlorid-Struktur, eine für viele Salze typische Kristallstruktur.
Daneben sind alle anderen möglichen Natriumhalogenide, also Natriumfluorid NaF, Natriumbromid NaBr und Natriumiodid NaI, bekannt und stabil.
Sauerstoffverbindungen
Es sind insgesamt fünf Oxide des Natriums bekannt. Dies sind Natriumoxid Na2O, Natriumperoxid Na2O2, Natriumhyperoxid NaO2, Dinatriumtrioxid Na2O3 und Natriumtrioxid NaO3. Natriumoxid ist in vielen Gläsern enthalten, es entsteht bei der Glasherstellung aus dem eingesetzten Natriumcarbonat. Bei der Verbrennung von Natrium entsteht es nur bei bestimmten Temperaturen (150–200 °C[1]) und stöchiometrisch eingesetzten Mengen Natrium und Sauerstoff. Ist dies nicht der Fall, verbrennt Natrium zu Natriumperoxid. Dieses ist ein starkes Oxidationsmittel und das technisch wichtigste Natrium-Oxid. Es wird als Bleichmittel für Textilien und Papier, sowie als Sauerstoffquelle beim Tauchen und in U-Booten verwendet. Die anderen Oxide sind sehr instabil und zersetzen sich schnell.
Natriumhydroxid (NaOH) ist für die Industrie mit die wichtigste Base. Die wässrige Lösung von Natriumhydroxid wird Natronlauge genannt. Sie wird unter anderem für die Herstellung von Seife und Farbstoffen sowie zum Aufschluss von Bauxit bei der Aluminium-Produktion verwendet.
Schwefelverbindungen
Mit Schwefelwasserstoff bildet Natrium zwei Salze, das Natriumsulfid Na2S und das Natriumhydrogensulfid NaHS. Beide werden u. a. zur Schwermetallfällung verwendet.
Natriumsulfat Na2SO4, das Natriumsalz der Schwefelsäure, wird u. a. in Waschmitteln und in der Papierindustrie im Sulfatverfahren eingesetzt. Wie andere zweiwertige Anionen bildet Sulfat neben dem Natriumsulfat noch Natriumhydrogensulfat. Auch andere Schwefel-Sauerstoffsäuren bilden Natriumsalze. Ein Beispiel ist Natriumthiosulfat Na2S2O3, das in der Fotografie als Fixiersalz verwendet wird.
Weitere Natriumverbindungen
Natriumcarbonat Na2CO3 und Natriumhydrogencarbonat NaHCO3 sind die Natriumsalze der Kohlensäure. Sie zählen, neben Natriumchlorid und Natriumhydroxid, zu den wichtigsten Natriumverbindungen. Natriumcarbonat (häufig mit dem Trivialnamen Soda bezeichnet) wird in großen Mengen bei der Glasherstellung benötigt. Natriumhydrogencarbonat wird als Backpulver verwendet. Es bildet beim Erhitzen mit Säuren Kohlenstoffdioxid und Wasser.
Natriumnitrat NaNO3, das Natriumsalz der Salpetersäure, ist eine der seltenen natürlich vorkommenden Nitratverbindungen (Chilesalpeter). Natriumnitrat wird als Düngemittel und als Konservierungsmittel verwendet.
Organische Verbindungen des Natriums sind im Gegensatz zu denen des Lithiums sehr instabil. Sie sind äußerst reaktiv und können teilweise auch mit sonst unreaktiven aliphatischen Kohlenwasserstoffen reagieren. Ausreichend stabil für Anwendungen in Reaktionen sind nur Verbindungen mit aromatischen Resten, wie Cyclopentadien, die als Reduktionsmittel verwendet werden können.[22]
Siehe auch: Kategorie:Natriumverbindung
Einzelnachweise
- ↑ a b c d e f g h Holleman-Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, Berlin 2007. ISBN 978-3-11-017770-1
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Natrium) entnommen.
- ↑ David R. Lide (ed), CRC Handbook of Chemistry and Physics, 84th Edition, CRC Press, Boca Raton, Florida, 2003.
- ↑ Eintrag zu CAS-Nr. 7440-23-5 im European chemical Substances Information System ESIS
- ↑ a b Mineralienatlas: Natrium
- ↑ A. G. W. Cameron: Abundances of the elements in the solar system in: Space Science Reviews, 1970, 15, 121–146
- ↑ K. H. Wedepohl: The composition of the continental crust, in: Geochimica et Cosmochimica Acta, 1995, 59, 7, 1217–1232
- ↑ Zusammenfassung über Alkalimetalle von wiley-vch
- ↑ a b K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente in: Acta Crystallographica, 1974, B30, S. 193–204
- ↑ a b Natrium bei webelements.com, physikalische Eigenschaften
- ↑ a b c G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The Nubase evaluation of nuclear and decay properties
- ↑ K. Ziegler, F. Bersch und H. Wollthan: Untersuchungen über alkaliorganische Verbindungen. Der Mechanismus der Polymerisation ungesättigter Kohlenwasserstoffe durch Alkalimetalle und Alkalialkyle; in: Justus Liebig's Annalen der Chemie, 1934, 511, 1, S. 13–44
- ↑ Deutsches Chemie-Museum Merseburg, Geschichte der Busa-Werke Schkopau
- ↑ M. Volkmer: Basiswissen Kernenergie. Hamburgische Elektricitäts-Werke-AG, 1996, S. 52–53, ISBN 3-925986-09-X
- ↑ R. Brückner: Reaktionsmechanismen, Spektrum Akad. Verlag, 3. Auflage, 2004, ISBN 3-8274-1579-9
- ↑ Kationenanalyse, Universität Freiburg
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Natrium im Lexikon der Chemie
- ↑ a b W. Kaim, B. Schwederski: Bioanorganische Chemie, 4. Auflage, Teubner, Wiesbaden, 2005 ISBN 3-519-33505-0
- ↑ a b Müller-Esterl: Biochemie. Eine Einführung für Mediziner und Naturwissenschaftler. Spektrum Akademischer Verlag, 2004 ISBN 978-3-8274-0534-0
- ↑ Siegenthaler (Hrsg). Klinische Pathophysiologie. 9. Auflage, Seite 165-175. Georg Thieme Verlag Stuttgart 2006. ISBN 3-13-449609-7
- ↑ Sitte, Weiler, Kadereit et al.: Strasburger. Lehrbuch der Botanik. 35. Auflage. Spektrum Akademischer Verlag, 2002 ISBN 978-3-8274-1010-8
- ↑ Chr. Elschenbroich: Organometallchemie. 5. Auflage, Teubner, 2005
Literatur
- Holleman-Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, Berlin 2007. ISBN 978-3-11-017770-1
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, 1988, ISBN 3-527-26169-9
- David M. Adams: Inorganic Solids. Wiley, London 1974. ISBN 0-471-00470-7
Weblinks
- WebElements.com – Sodium
- EnvironmentalChemistry.com – Sodium
- Google Video über die Entsorgung von 10 t Natriummetall in einem See im Jahr 1947
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.